靶向MR-1 基因shRNA 表达载体的构建 及其对白血病K562 细胞增殖的抑制作用
2013-04-20赵午莉任开环李保卫邵荣光
赵午莉,任开环,李保卫,邵荣光
肌纤基因调节因子( myofibrillogenesis regulator1,MR-1)基因是由中国医学科学院医药生物技术研究所王以光教授研究组 2004 年发现的一种新的人类功能基因,由 GenBank 收录,收录号为 AF417001(NCBI 检索号为 NP_001070867)[1]。人 MR-1 基因定位于 2q35,编码一种 142 个氨基酸的蛋白,其中 75 ~ 92 个氨基酸形成一个疏水性结构域,主要分布在核膜上,少量分布在胞质中。以前的研究表明,MR-1 蛋白与细胞重构、信号传导及细胞凋亡等过程相关,可能参与了细胞增殖调控、心肌肥大及肿瘤的发生[2]。
MR-1 在多种实体瘤细胞中高表达,尤其在肝癌细胞 HepG2 和 BEL7402 中高表达,采用 siRNA 技术将 MR-1 下敲后,细胞增殖能力减缓,黏附能力以及迁移能力降低[3-4]。除在肝癌等实体瘤细胞中高表达外,我们的前期研究结果也表明 MR-1 在白血病细胞中高表达,尤其在慢性粒细胞急性发作 K562 细胞中的表达最高,这些结果表明 MR-1 与白血病的发生密切相关,因此探求 MR-1 在白血病发病中的作用进而寻找合适的白血病治疗靶点对于白血病的治疗很有必要。本研究目的在于阐明 MR-1 基因对白血病细胞 K562 增殖能力的影响,通过构建靶向 MR-1 的质粒使 MR-1 在 K562 细胞中表达降低,以研究 MR-1 基因对 K562 细胞增殖的影响。
1 材料与方法
1.1 主要材料
1.1.1 细胞系、质粒及菌株 人白血病细胞 K562、质粒 CDNA3.1 由本室保存;pCDshRNA 由本室构建保存;感受态的大肠杆菌 E.coli DH5α 购自北京鼎国生物技术有限责任公司。
1.1.2 主要试剂 RPMI 1640 培养基以及 100 bp DNA ladder 购自美国 Gibco 公司;新生胎牛血清购自美国 Hyclone 公司;限制性内切酶 BamH I、Hind III 酶及 T4 DNA 连接酶,小量抽提试剂盒和凝胶回收试剂盒购自日本 Takara 公司;脂质体 Lipofectamine LTX Reagent 购自美国 Invitrogen 公 司;G418、质粒提取试盒 A7640 和 A2150 购自美国Promega 公司;预染蛋白marker 为新西兰 Biolabs 公司产品;兔抗 MR-1 多克隆抗体(针对 MR-1 C 端 15 个氨基酸合成多肽)由王以光教授惠赠。
1.2 方法
1.2.1 shRNA 设计与合成 以 MR-1 基因序列为分析序列,采用 Ambion 公司网站(www.ambion. com)设计软件,参考 siRNA 设计原则,选择最佳干扰位点,本研究选取的靶位点是:5' ACCGUGU GAAGCAGAUGAA 3'。针对靶位点分别设计两条互补的寡核苷酸序列,寡核苷酸的两端带有与 BamH I 和 Hind III 酶切位点互补的黏端序列,能够直接与具有 BamH I 和 Hind III 酶切位点的载体连接。并通过 BLAST 对所选择的靶序列进行同源分析,排除 siRNA 非特异性抑制其他基因片段的可能。shRNA 序列茎环结构为 9 个与 MR-1 基因不互补的非同源碱基(TTCAAGACG),末端终止子为 TTTTT。设计的具有发夹结构的 shRNA 干扰片段序列结构模式为:BamH I + Sense + Loop + Antisense + 终止信号 + Hind III。MR-1 特异 siRNA 编码正义链为:5' GATCCCGTAACAGUCA ATAGCCTAGGTTCAAGAGACCTAGGCTATTGA CTGTTATTTTTGGAAA 3';反义链为:5' AGCTTTT CCAAAAAATAACAGUCAATAGCCTAGGTCTCT TGAACCTAGGCTATTGACTGTTACGG 3';实验中所采用的阴性对照 mock-shRNA 的正反义链序列为:5' GATCCCGTTCTCCGAACGTGTCACGTTTC AAGAGAACGTGACACGTTCGGAGAATTTTTTG GAAA 3' 和 5' AGCTTTTCCAAAAAATTCTCCG AACGTGTCACGTTCTCTTGAAACGTGACACGT TCGGAGAACGG 3'。标方框的序列为相应靶向 mRNA 的 DNA 序列,转录成 RNA 后会在此处形成发夹结构的双链 RNA。所形成的发夹 RNA 则可被 RNA Dicer 酶所识别切割成双链 siRNA,从而发挥 RNA 干扰作用,上述序列均为北京赛百盛基因技术有限公司合成。
1.2.2 shRNA 模板退火 将合成的单链寡核苷酸溶解于无核酸酶水中,终浓度为 1 g/L。将互补的两条寡核苷酸各取 2 μl,加入 46 μl 退火缓冲液,置 PCR 反应仪上,设定反应条件为:90 ℃ 3 min, 37 ℃ 1 h,得到退火产物。-20 ℃ 保存备用。
1.2.3 MR-1-shRNA 表达载体的构建与鉴定 本研究选择了目前常用的真核表达载体 pcDNA3.1 的主要序列作为基本序列,采用限制性内切酶将其 CMV 启动子去除,再插入连接用于 shRNA 表达的 H1 启动子从而建立了稳定表达靶基因 shRNA 的载体 pCD-shRNA。采用 BamH I 和 Hind III 酶切 pCD-shRNA 表达质粒载体,形成线性片段,除去酶切下来的小片段后,使用 Agarose Gel DNA Purification Kit 回收,电泳检测估算浓度,稀释 纯化。再用 T4 DNA 连接酶将退火后的 MR-1 shRNA 模板 DNA 双链与线性化的载体连接从而建立稳定表达 MR-1-shRNA 的载体,具体构建流程见图 1。将连接产物转化感受态 DH5α 大肠杆菌,经青霉素筛选取阳性克隆扩增,利用质粒小量提取试剂盒提取纯化重组质粒,用限制性内切酶切割,电泳,紫外灯下观察片段大小与所要目的片段是否相一致,若一致则可能为阳性克隆,送大连宝生物工程有限公司鉴定。
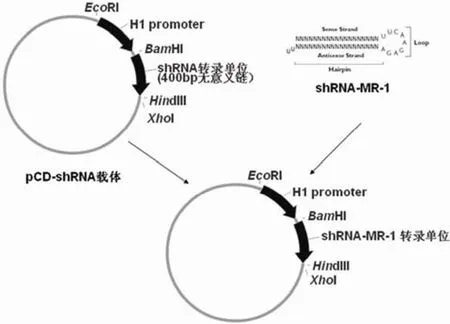
图1 pCD-shRNA-MR-1 表达载体的构建流程图Figure 1 Ligation flow diagram of pCD-shRNA-MR-1 expression vector
1.2.4 细胞转染 将处于对数生长期的 K562 细胞用无抗生素的 1640 洗涤后,以不含抗生素培养基接种于 24 孔板,10 万/孔。将 1 μg 质粒和 1 μl Lipofectamine LTX Reagent 脂质体用无抗生素无血清的 Opti-MEM 培养液 100 μl 稀释,质粒(μg)∶脂质体(μl)为 1∶1,混匀,室温 10 min,加入 Plus 2 μl 混匀,室温 25 min。在此过程中,不能剧烈振荡以免脂质体生成氧化物。质粒与脂质体复合物于室温静置 25 min 后,把 100 μl 质粒-脂质体复合物加到细胞培养板中,转染后每孔溶液终体积为
500 μl。
1.2.5 稳定克隆株的筛选 转染 48 h 后,将各组 细胞分别换成选择性培养液(含 G418 600 μg/ml)分孔培养,待未转染质粒的细胞被 G418 杀死后(约 10 d),将各孔细胞收集计数,调整细胞浓度为 100 个/20 ml,将细胞种到 96 孔板中,200 μl/孔。7 d 后,待克隆出现并增殖到一定数量后,将克隆细胞转移至 6 孔板中扩大培养,并采用 western blot 进行鉴定,鉴定后收集冻存。
1.2.6 Western blot 取实验组和对照组细胞,加入细胞裂解液,提取细胞总蛋白,蛋白定量后加热变性。每组取 40 μg 蛋白经 10% 的 SDS-PAGE 电泳分离后,采用半干电转移系统将蛋白转移至 PVDF 膜上,5% 脱脂奶粉封闭 2 h,加人一抗(1∶1000)4 ℃ 孵育过夜,采用 TBST 洗膜 5 次,加入 HRP 标记二抗(1∶5000),室温下孵育 1 h,增强化学发光法(ECL)发光显色。以 β-actin 作为内参。
1.2.7 肿瘤细胞增殖实验 细胞用 0.5 ml 含 10% 胎牛血清的 RMIP 1640 组织培养液以 5000 个/孔接种到 24 孔板中,48 h 后用台盼蓝计数法检测细胞增殖速度。
2 结果
2.1 pCD-shRNA-MR-1 表达载体的鉴定
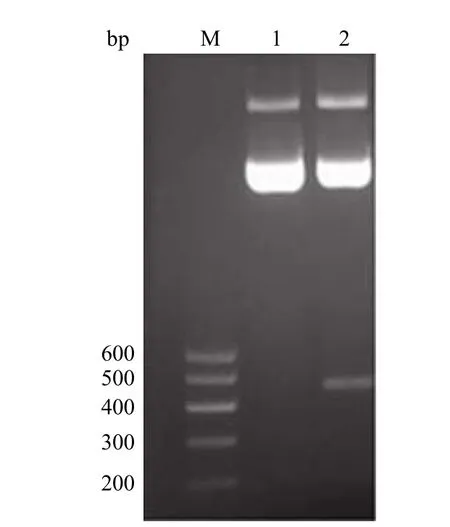
图2 pCD-shRNA 载体酶切图Figure 2 pCD-shRNA digested with BamH I and Hind III
pCD-shRNA 经 BamH I 和 Hind III 双酶切后形成 400 bp 大小的无意义小片段和线性空载体,琼脂糖电泳结果见图 2。线性载体经回收后与退火的表达 shRNA 的 DNA 双链进行连接。经青霉素筛选取阳性克隆扩增提取质粒,采用 EcoRI 和 Hind III 内切酶鉴定酶切结果,如图 3 所示。新构建质粒 pCD-shRNA-MR-1 经酶切后形成约为 150 bp 大小的片段和载体大片段,表明表达 shRNA 的 DNA 双链可能连入载体 pCD-shRNA 中。对酶切正确的质粒测序,结果表明插入序列和预期的完全一致(图 4)。综上所述,我们成功构建了 pCD-shRNA-MR-1 表达载体。

图3 pCD-shRNA -MR-1 重组质粒的酶切图Figure 3 pCD-shRNA-MR-1 digested with EcoRI and Hind III
2.2 MR-1 稳定沉默细胞系的建立
将 pCD-shRNA-MR-1 以及 pCD-shRNA-mock 转染人白血病细胞 K562,经 G418 筛选后单克 隆扩大培养,经 western blot 筛选,得到 mock 组细胞 shCon 和 2 株 MR-1 稳定敲除细胞系 shMR-1(1) 和 shMR-1(2),在这两株细胞系中 MR-1 均被下敲,尤其是 shMR-1(2) 细胞,MR-1 敲除更加明显。结果如图 5 所示。
2.3 MR-1 稳定下敲抑制了 K562 细胞的增殖
对已经建立的 MR-1 稳定下敲细胞的增殖活性进行检测,细胞于对数生长期铺于 24 孔板,48 h 后检测其增殖活性。结果如图 6 所示,MR-1 稳定下敲细胞 shMR-1(1) 和 shMR-1(2) 的增殖速率均降低,增殖速度约为对照的 50% 和 40%,说明MR-1 对 K562 细胞增殖有显著促进作用。
2.4 MR-1 稳定下敲抑制 Bcr-Abl 融合蛋白以及 Jak2 的活性

图4 pCD-sh-MR-1 转录模板区测序图Figure 4 Sequencing of DNA fragment inserted into the shRNA expression vector pCD-sh-MR-1

图5 MR-1 低表达稳定克隆株的 MR-1 蛋白表达分析 Figure 5 The analysis of MR-1 proteins of two transfected stable clones shMR-1(1) and shMR-1(2) of MR-1 silencing cells, shCon and K562 cells

图6 稳定下敲 MR-1 促进 K562 细胞的增殖活性 Figure 6 Proliferation activity of MR-1 stable silencing cells after seeded 48 h, and cell numbers were determined by trypan blue exclusion staining assay
对慢性粒细胞白血病中对增殖以及预后具有重要作用的融合蛋白 Bcr-Abl 及其活性形式进行 了检测,结果表明其活性形式即磷酸化蛋白的水平显著降低,但其他可被 Bcr-Abl 激活并执行促增殖作用的蛋白中除了 Jak2 外,其他蛋白的活性形式均未见明显降低(图 7),说明 MR-1 对细胞增殖的抑制作用主要通过调节 Bcr-Abl-Jak2 信号通路实现。
3 讨论
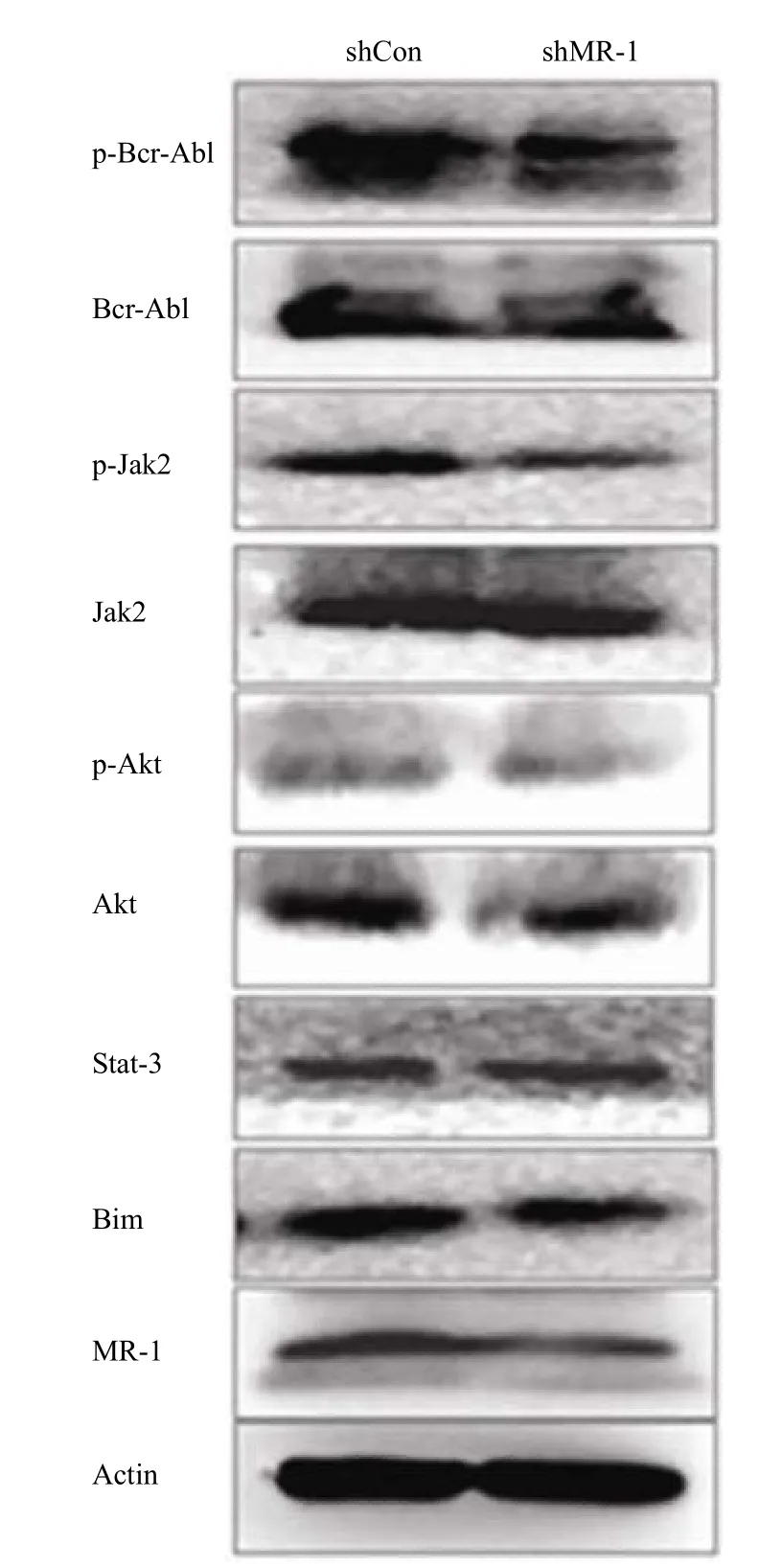
图7 MR-1 下敲后的细胞信号通路变化 Figure 7 The changes of signal pathways after MR-1 silencing in K562 cell
早期研究结果表明,MR-1 在心肌肥大的细胞中高表达。MR-1 过表达后促进了正常心肌细胞的肥大[5-6],表明 MR-1 在促使心肌细胞增殖和肥大 中具有非常重要的作用。近来的研究证实,MR-1 在多种肿瘤细胞中高表达,但在正常组织中低表达。降低 MR-1 表达后,肿瘤细胞的增殖减缓,黏附和迁移能力减弱[4],表明 MR-1 在肿瘤增殖和转移的调控中发挥着重要的作用。
我们的前期的研究结果表明,MR-1 在多株白血病细胞中高表达。为了进一步探求 MR-1 的高表达与白血病的关系,我们需下敲 MR-1 表达以进一步研究 MR-1 下敲后细胞所出现的生物学改变,从而明确 MR-1 在白血病致病中的作用。Ren 等[4]采用 siRNA 瞬时下敲人肝癌细胞中 MR-1 后成功地发现了 MR-1 具有促进细胞增殖和迁移的能力;Lu 等[7]也采用 siRNA 瞬时下敲 MR-1 后确认了 MR-1 对卵巢癌细胞具有促进增殖的作用;Li 等[5]同样也是采用 siRNA 瞬时下敲 MR-1 后进一步确认了 MR-1 具有促进心肌细胞肥大和增殖的作用,因此,MR-1-siRNA 在 MR-1 功能研究中发挥了重要的作用。目前 siRNA 的合成主要通过直接合成 siRNA 或通过质粒或病毒等 shRNA 表达载体在细胞内合成 shRNA 后再经不同的酶剪切生成 siRNA 等方法来得到[8-9]。Paddison 等[10]发现,在采用以 RNA 聚合酶 III 为启动子的表达 shRNA 载体转染细胞后,细胞能产生长期稳定的基因沉默[11-13]效应,这种用质粒等表达载体在细胞内转录酶切后生成 siRNA 与上述采用直接合成 siRNA 进行 MR-1 功能研究的方式相比,shRNA 稳定下敲方式不仅具有经济和容易操作等优点,更重要的是可以通过建立稳定表达 siRNA 的细胞克隆而延长了 RNA 的干扰效应从而能够观察长期下敲一个基因对于整个细胞的影响,尤其对于在瞬时 siRNA 干扰中往往得不到理想干扰效果的白血病悬浮细胞。本研究所构建的质粒 pCD-shRNA 是通过体内转录的方式生成发夹状双链 RNA 分子,然后通过 Dicer 酶生成 siRNA 分子而引起基因沉默。此质粒所采用的启动子为 H1 启动子,属于 RNA 聚合酶 III 启动子,能够在哺乳动物细胞中指导合成发夹状双链 RNA 分子,诱导基因特异性沉默。
pCD-shRNA 酶切后的线性载体与退火的 shRNA 双链连接后的酶切鉴定,采用了 EcoRI 和 Hind III 内切酶进行酶切而未采用 BamH I 和 Hind III 进行酶切,是因为 BamH I 和 Hind III 酶切后生成的 shRNA 片段只有 64 bp,电泳不易 观察到,因此采用 EcoRI 和 Hind III 内切酶将 95 bp 的 H1 启动子和 64 bp 的表达 shRNA 的 DNA 双链一起切下来,形成 150 bp 的片段,这样更容易观察到连接效果。如果未将表达 shRNA 的DNA 连入而还是原来的无意义片段,则切下来的片段为 500 bp 左右,电泳结果证实了我们的连入 是正确的。
将构建的表达载体 pCD-shRNA-MR-1 和 pCD-shRNA-mock 载体转染白血病细胞K562,在其稳定表达后采用 western blot 检测后发现,MR-1 在转染了 mock 干扰载体的 K562 细胞中表达并没有改变,而在转染了 MR-1 干扰载体的稳定细胞中,MR-1 表达降低,表明 mock 序列并没有影响 MR-1 的表达,我们前期的质粒构建表达以及细胞转染是成功的。对其增殖能力研究后发现,在 MR-1 稳定下敲的两株细胞中,细胞的增殖均降低,说明 MR-1 是一个对细胞增殖起负性调控的基因。在慢性粒细胞白血病中,约有超过 95% 的白血病患者有明显的特异染色体改变,比如染色体异位和翻转,且这些变异的基因非常稳定,因此采用针对这些特异癌基因的靶向分子治疗成为白血病治疗中非常有效的手段。
建立了稳定下敲 MR-1 的细胞株 shMR-1(1) 和 shMR-1(2),对其增殖能力检测发现细胞增殖活性明显下降;信号通路检测结果表明,MR-1 稳定下敲能明显抑制对白血病细胞增殖发挥关键作用的 Bcr-Abl 磷酸化形式。研究表明,90% 以上的慢性粒细胞白血病患者的血细胞中出现 Bcr-Abl 融合蛋白即 Ph1 染色体,t(9; 22)(q34; q11),其是 9 号染色体长臂上 C-abl 原癌基因易位至 22 号染色体长臂的断裂点集中区(Bcr),形成 Bcr-Abl 融合基因。此基因编码的蛋白为 P210,P210 具有增强酪氨酸激酶的活性,改变了细胞多种蛋白质酪氨酸磷酸化水平和细胞微丝机动蛋白的功能,从而扰乱了细胞内正常的信号传导途径,使细胞失去了对周围环境的反应性,并抑制了凋亡的发生[14],其中 AKT、Jak2、Stat3 和 Bim 在执行 Bcr-Abl 促增殖的作用中发挥了重要的作用[14]。而 Jak2 的作用尤为重要,研究结果表明在抑制了 Jak2 的磷酸化后,细胞的凋亡明显增加[14];在持续激活 Jak2 后,细胞的增殖能力明显增强[15],表明 Jak2 在白血病细胞的增殖中具有重要的作用。本实验中 MR-1 下敲细胞中除了 Bcr-Abl 的活性形式明显降低外,其下游的 Jak2 的磷酸化形式也明显下降,尽管和增殖以及 Bcr-Abl 有密切关系的其他蛋白表达或活性形式没有明显改变,原因可能为 MR-1下敲后还可能激活了其他可以调控这些蛋白的信号通路,这些通路与 Bcr-Abl 共同调控了这些蛋白的活性。因此,我们推测在 MR-1 下敲后引起细胞增殖减缓的关键原因是磷酸化的 Bcr-Abl 表达降 低,并引起 Jak2 活性形式降低,从而使细胞的增殖减缓。
而本实验中所构建的 MR-1 干扰质粒不但持续稳定地抑制了其表达,且可有效地降低 K562 细胞的增殖,具有操作简单、在体内稳定和成本低的优点,因此对于白血病的靶向治疗具有一定的参考意义。
[1] Li TB, Hu Y, Wang YG, et al. Cloning of mMR-1 gene and expression in Pichia pastoris systems. Chin J Biotechnol, 2005, 21(1):25-29. (in Chinese) 李天伯, 胡洋, 王以光, 等. mMR-1 基因的克隆和在毕赤酵母中分泌表达. 生物工程学报, 2005, 21(1):25-29.
[2] Li TB, Liu XH, Feng S, et al. Characterization of MR-1, a novel myofibrillogenesis regulator in human muscle. Acta Biochim Biophys Sin (Shanghai), 2004, 36(6):412-418.
[3] Wang JH, Bian CJ, Zhao CH. MR1 siRNA suppresses proliferation of human hepatoma BEL-7402 cells. Basic Clin Med, 2009, 29(1):1-5. (in Chinese) 王金华, 边春景, 赵春华. MR1 siRNA 抑制人肝癌细胞BEL-7402的增殖. 基础医学与临床, 2009, 29(1):1-5.
[4] Ren K, Jin H, Bian C, et al. MR-1 modulates proliferation and migration of human hepatoma HepG2 cells through myosin light chains-2 (MLC2)/focal adhesion kinase (FAK)/Akt signaling pathway. J Biol Chem, 2008, 283(51):35598-35605.
[5] Li HL, She ZG, Li TB, et al. Overexpression of myofibrillogenesis regulator-1 aggravates cardiac hypertrophy induced by angiotensin II in mice. Hypertension, 2007, 49(6):1399-1408.
[6] Xu FF, Liu XH, Wang YZ, et al. Effects of myofibrillogenesis regulator on myocardial hypertrophy. Chin J Pathophysiology, 2006, 22(3):443-447. (in Chinese) 徐菲菲, 刘秀华, 王彦珍, 等. 肌原纤维调节因子-1 在心肌肥大中的作用研究. 中国病理生理杂志, 2006, 22(3):443-447.
[7] Lu R, Sun M, Feng J, et al. Myofibrillogenesis regulator 1 (MR-1) is a novel biomarker and potential therapeutic target for human ovarian cancer. BMC Cancer, 2011, 11:270.
[8] Wang W, Zhu HZ, Xue JL. RNAi as a gene therapy approach. Prog Biochem Biophys, 2004, 31(7):590-595. (in Chinese) 王玮, 朱焕章, 薛京伦. RNA 干涉在基因治疗中的应用. 生物化学与生物物理进展, 2004, 31(7):590-595.
[9] Wang YZ, Liang ZQ, Liu XF, et al. Construction and identification of lentiviral vector encoding shRNA against Smad3. Acta Acad Med Militaris Tertiae, 2009, 31(8):701-702. (in Chinese) 王延洲, 梁志清, 刘晓芳, 等. Smad3基因RNAi慢病毒载体的构建与鉴定. 第三军医大学学报, 2009, 31(8):701-702.
[10] Paddison PJ, Caudy AA, Sachidanandam R, et al. Short hairpin activated gene silencing in mammalian cells. Methods Mol Biol, 2004, 265:85-100.
[11] Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science, 2002, 296(5567):550-553.
[12] Paddison PJ, Caudy AA, Bernstein E, et al. Short hairpin RNAs (shRNAs) induce sequence-specific silencing in mammalian cells. Genes Dev, 2002, 16(8):948-958.
[13] Paul CP, Good PD, Winer I, et al. Effective expression of small interfering RNA in human cells. Nat Biotechnol, 2002, 20(5):505-508.
[14] Will B, Siddiqi T, Jordà MA, et al. Apoptosis induced by JAK2 inhibition is mediated by Bim and enhanced by the BH3 mimetic ABT-737 in JAK2 mutant human erythroid cells. Blood, 2010, 115(14):2901-2909.
[15] Ruchatz H, Coluccia AM, Stano P, et al. Constitutive activation of Jak2 contributes to proliferation and resistance to apoptosis in NPM/ALK-transformed cells. Exp Hematol, 2003, 31(4):309-315.
