五种药用石斛内生真菌抑制HIV-1 整合酶 活性研究
2013-04-20祁婧张大为陈娟康永郭顺星
祁婧,张大为,陈娟,康永,郭顺星
内生菌(endophyte)是指存在于健康植物组织、器官内并不引起明显病害症状的一类真菌[1]。近年来,研究发现植物内生真菌能够产生结构新颖、功能特殊的次生代谢产物,是新化合物、新药物的潜在资源,在医药、工业、农业等领域具有重要的应用前景[2]。
石斛属(Dendrobium)植物为附生性兰科(Orchidacea)植物,多为我国传统名贵中药材。石斛属药用植物内生真菌具有丰富的多样性[3]。近年来,研究者从石斛属药用植物的内生真菌的代谢产物中已筛选出许多具有多种生理活性的物质[4-7],但鲜有关于石斛属药用植物内生真菌抑制 HIV-1 整合酶(HIV-1 IN)活性的报道。本实验采用 HIV-1 整合酶链转移反应活性高通量 ELISA 检测方法,对 202 株石斛属药用植物内生真菌的发酵液和菌丝体的粗提物共计 404 个样品进行了 HIV-1 整合酶抑制活性的筛选,旨在获得抑制 HIV-1 整合酶活性高的代谢产物,为发现新的治疗艾滋病的药物途径提供参考。
1 材料与方法
1.1 材料
本实验筛选所用的真菌菌株分离自束花石斛(Dendrobium chrysanthum)、流苏石斛(Dendrobium fimbriatum)金钗石斛(Dendrobium nobile)、兜唇石斛(Dendrobium aphyllum)、鼓槌石斛(Dendrobium chrysotoxum)的根,采自云南西双版纳等地,均由本实验室分离保藏。
Dynabeads 链霉亲和素磁珠 M-280 试剂盒和 Dynal MPC-9 板式磁珠收集器购自美国 Dynal Biotech 公司;碱性磷酸酶标记地高辛抗体购自美国 Sigma 公司;96 孔透明微孔板购自丹麦 Nunc 公司。
实验中所用的底物—寡核苷酸链是由上海生工生物工程技术服务有限公司合成、修饰并标记的,具体序列见表 1。
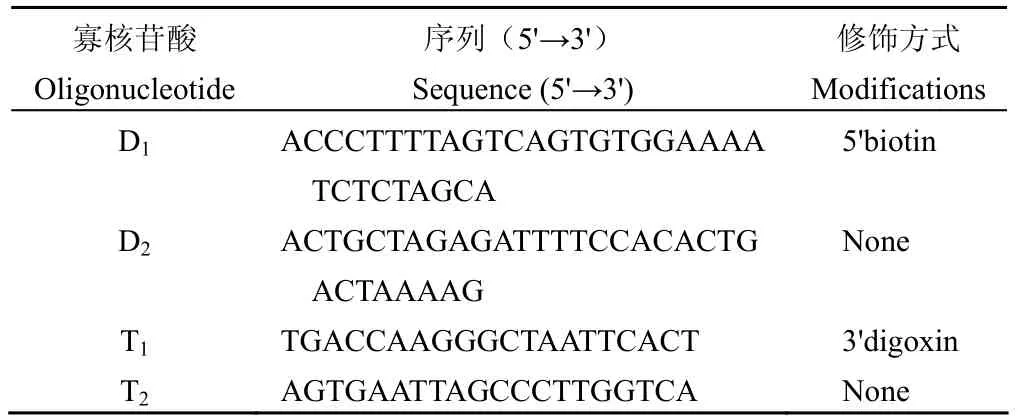
表1 实验所用的寡核苷酸的序列及修饰标记 Table 1 The sequence of the study
1.2 实验方法
1.2.1 样品制备 将分离自石斛的 202 株内生真菌的发酵产物发酵液和菌丝体的醇粗提取物分别记为 F 和 J,共 404 个,用 DMSO 溶解配制成浓度为 1 mg/ml 的初筛样品。
1.2.2 HIV-1 整合酶抑制剂的筛选 操作步骤参照文献[8]。将配置好的样品加入到用 1 × 反应缓冲液润洗过的 96 孔透明板中,与酶在 2 × 反应缓冲液中于 37 ℃ 温育 20 min,加入底物充分混匀后于 37 ℃ 反应 1 h。反应结束后每孔加入结合缓冲液和链霉亲和素磁珠彻底振荡混匀,20 ℃ 孵育 15 min,每 5 分钟振荡混匀一次。将微孔板置于磁珠收集器上静置 90 s 并弃上清液,用 PBST 充分洗磁珠 3 次后加入经稀释的碱性磷酸酶标记的地高辛抗体,振荡混匀后于 37 ℃ 温育 30 min。再次用 PBST 充分洗磁珠 3 次,将磁珠转移到用 PBS 润洗过的新微孔板中,加入显色底物缓冲液,避光显色 30 min 后于酶标仪测定 405 nm 处的 OD 值。HIV-1 链转移反应抑制剂筛选体系中待测样品的终浓度为 0.1 mg/ml,设置终浓度为 25 μmol/L 的二酮酸类 IN 抑制剂 baicalein 作为样品阳性对照组,不加入样品而直接加入 DMSO 的为阴性对照组。抑制率计算方法如下:

1.2.3 量效关系 将样品分别以 0.1、0.05、0.025、0.0125、0.00625 和 0.003125 mg/ml 为抑制反应终浓度,测定样品对 HIV-1 IN 链转移反应的抑制率并绘制量效关系曲线。
1.2.4 抑制肿瘤细胞活性 采用 MTT 法[9]对样品 5119F、5297F、5097F、5140J 和 5211F 分别进行体外抑制人肺癌细胞 A549、人胃癌细胞 SGC-7901 和人卵巢癌细胞 A2780 的活性筛选。过程如下:将细胞浓度为 1.5 × 104个/ml 的细胞悬液接种于透明 96 孔板中,每孔 90 μl,于 37 ℃、5% CO2培养箱中培养 12 h 后加入待测样品,使终浓度为 100 μg/ml,24 h 后采用 MTT 法于 570 nm 处检测 OD 值。设置只加培养基不加细胞的组为空白对照组,DMSO 终浓度为 1% 的组为阴性对照组。
2 结果
2.1 HIV-1 整合酶抑制剂筛选
通过对 202 株内生真菌的 404 个发酵产物的抑制 HIV-1 IN 链转移反应的筛选,得到抑制率大于 80% 的样品 19 个,其中 11 个为发酵液提取物,8 个为菌丝体提取物。对抑制率达到 100% 以上的样品(5094F、5097F、5119F、5119J、5140J、5211F、5297F)进行 3 次重复筛选,结果见表 2,其中 5119F,5297F,5097F,5140J 和 5211F 的抑制率仍能保持在 100% 以上,分别为 117.96%、113.53%、108.62%、103.74% 和 109.02%。
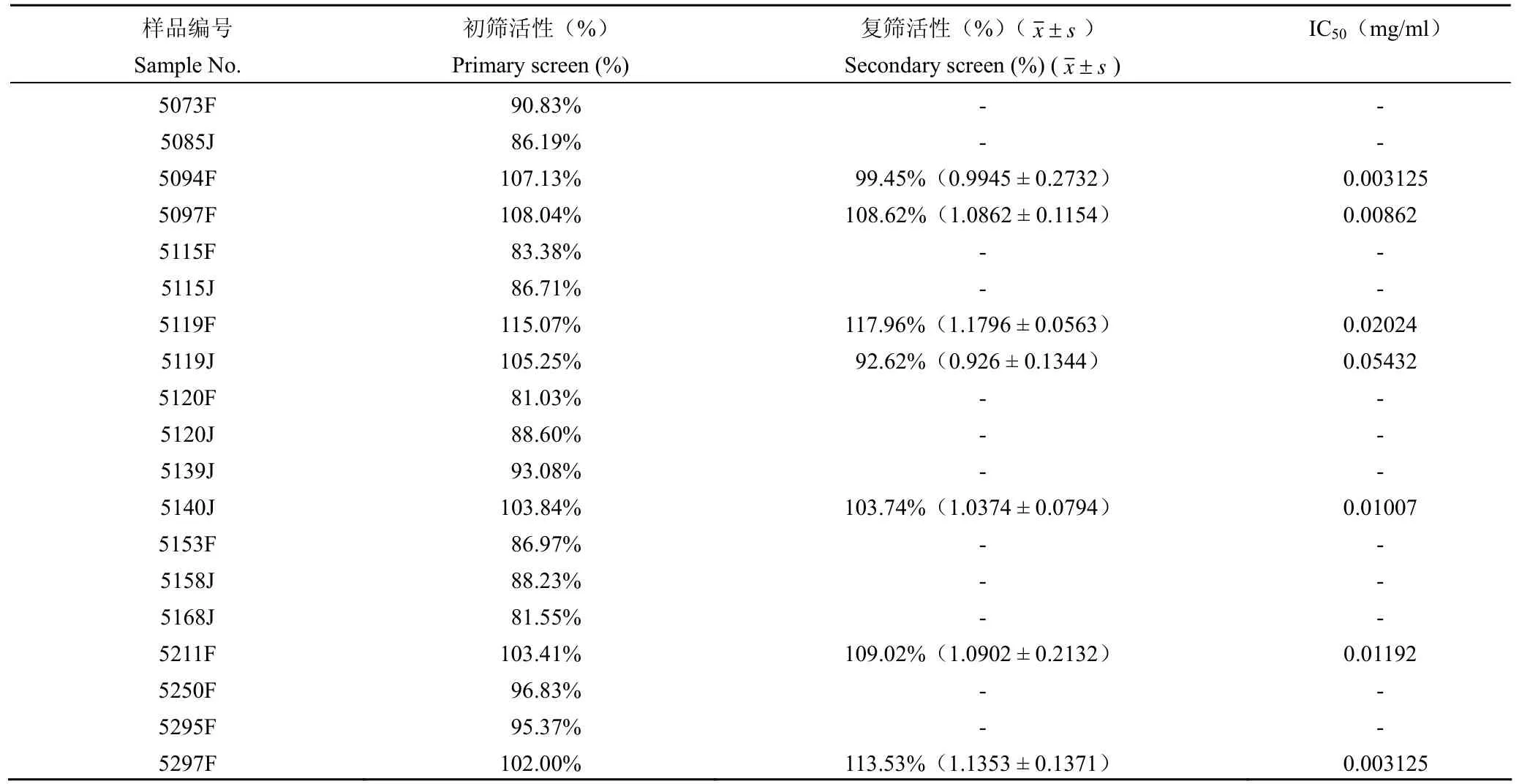
表2 HIV-1 整合酶抑制活性大于 80% 的组分 Table 2 The samples with their HIV-1 integrase inhibitory activity over 80%
2.2 量效关系结果
对 HIV-1 IN 抑制活性大于 100% 的样品进行量效关系考察,结果见图 1。5119F、5297F、5097F、5140J 和 5211F 样品抑制 IN 链转移反 应的 IC50分别为 0.02024、0.003125、0.00862、0.01007 和 0.01192 mg/ml(表 2)。从图中可以看出,随着样品 5119F、5297F、5097F 和 5211F 浓度的增加,抑制率上升的趋势由明显变为缓慢,量效曲线中表现为抑制率出现一个平台;随着反应体系中样品 5140J 浓度的增加,其抑制率仍有增加的趋势。
2.3 抑制肿瘤细胞活性筛选结果
对 HIV-1 IN 链转移活性的抑制率大于 100% 的 5 个样品进行体外抑制肿瘤细胞活性筛选,发现 5 个样品对人肺癌细胞 A549 和人胃癌细胞 SGC-7901 表现出较弱的抑制作用,但样品 5297F、 5097F 和 5140J 对人卵巢癌细胞 A2780 的抑制效果大于 50%(表 3)。

图1 HIV-1 IN 抑制活性大于 100% 的组分量效关系曲线 Figure 1 The dose-effect relationship curve of samples with HIV-1 integrase inhibitory activity over 100%
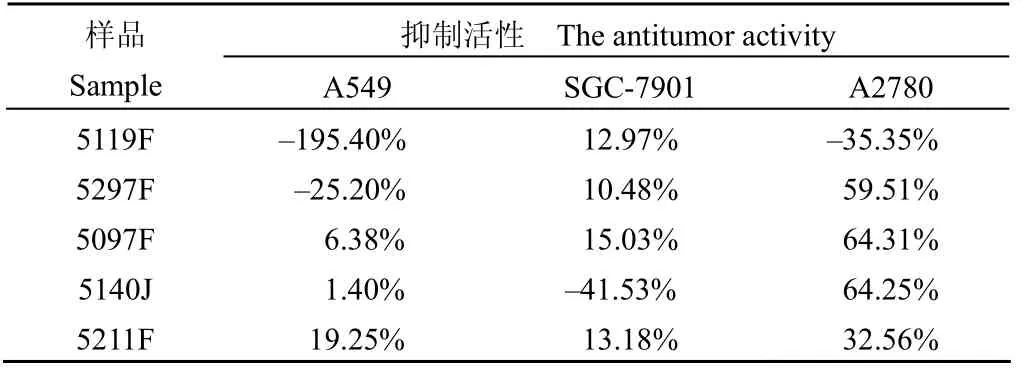
表3 抑制肿瘤细胞的活性 Table 3 The antitumor activity
3 讨论
本实验对 202 株石斛内生真菌的发酵液和菌丝体提取物分别进行了抑制 HIV-1 IN 活性筛选。实验结果显示,发酵液抑制 HIV-1 IN 的活性要明显好于菌丝体,这与张大为之前的研究结果[10]是一致的。但是,也有研究表明菌丝体样品对 HIV-1 IN 的抑制效果好于发酵液样品[11-12]。出现这样的情况,可能是因为:①由于筛选样品来源于不同的药用植物内生真菌,其在生长周期中所产生和积累的代谢产物也不同;②活性代谢产物有的为胞内产物,这样的菌丝体提取物的活性高;有的为胞外产物,则发酵液提取物样品的活性高。
5119 号、5297 号、5097 号和 5211 号菌的发酵液提取物,5140 号菌的菌丝体提取物对 HIV-1 IN 表现出较高的抑制活性。对这些活性样品进行了体外抑制肿瘤细胞的实验,发现其对肿瘤细胞的生长抑制并不明显。说明这 5 株菌的发酵产物对 HIV-1 IN 比较敏感,具有一定的特异性,可能从中获得活性单体,其中的活性化合物有待进一步追踪。
[1] Bacon CW, White JF. Microbial endophytes. New York: Marcel Dekker, 2000:85-117.
[2] Zou WX, Tan RX. Recent advances on endophyte research. Acta Botanica Sinica, 2001, 43(9):881-892. (in Chinese) 邹文欣, 谭仁祥. 植物内生菌研究新进展. 植物学报, 2001, 43(9): 881-892.
[3] Hu KX. Studies on the diversity of endophytic fungi from medicinal plants in dendrobium. Beijing: Chinese Academy of Medical Sciences & Peking Union Medical College, 2008. (in Chinese) 胡克兴. 石斛属药用植物内生真菌多样性研究. 北京: 中国医学科学院&北京协和医学院, 2008.
[4] Guo SX, Cao WQ, Gao WW. Isolation and biological activity of mycorrhizal fungi from Dendrobium candidum and D. nobile. China J Chin Mater Med, 2000, 25(6):338-341. (in Chinese) 郭顺星, 曹文芩, 高微微. 铁皮石斛及金钗石斛菌根真菌的分离及其生物活性测定. 中国中药杂志, 2000, 25(6):338-341.
[5] Zhang LC, Guo SX. Study on isolation of endophytic fungi from five dendrobium plants and its antimicrobial activity. Chin Pharm J, 2009, 44(20):1540-1543. (in Chinese) 张丽春, 郭顺星. 5 种石斛内生真菌的分离及其抗菌活性研究. 中国药学杂志, 2009, 44(20):1540-1543.
[6] Wang CL, Chen XM, Guo SX, et al. Studies on pharmacological activity of Mycena Dendrobii. Microbiology, 2001, 28(2):73-76. (in Chinese) 王春兰, 陈晓梅, 郭顺星, 等. 石斛小菇的药理活性研究. 微生物学通报, 2001, 28(2):73-76.
[7] Xing YM, Chen J, Cui JL, et al. Antimicrobial activity and biodiversity of endophytic fungi in Dendrobium devonianum and Dendrobium thyrsiflorum from Vietman. Curr Microbiol, 2011, 62(4): 1218-1224.
[8] He HQ, Ma XH, Liu B, et al. A novel high-throughpurt format assay for HIV-1 integrase strand transfer reaction using magnetic beads. J Acta Pharmacol Sin, 2008, 29(3):397-404.
[9] Guo B, Wang Y, Sun X, et al. Bioactive natural products from endophytes: a review. Prikl Biokhim Mikrobiol, 2008, 44(2):153-158.
[10] Zhang DW. Development and application of screening model for inhibitors targeting strand transfer reaction of HIV-1 integrase. Beijing: Chinese Academy of Medical Sciences & Peking Union Medical College, 2011. (in Chinese) 张大为. HIV-1 整合酶链转移反应抑制剂筛选模型的构建与应用. 北京: 北京协和医学院&中国医学科学院, 2011.
[11] He HQ, Jia YY. Soluble expression and inhibitor screening of the central core domain of HIV-1 integrase. China Biotechnol, 2012, 32(3):14-19. (in Chinese) 何红秋, 贾渝跃. HIV-1 整合酶核心区可溶性表达及抑制剂筛选. 中国生物工程杂志, 2012, 32(3):14-19.
[12] Wang YJ. Studies on anti-HIV-1 activity of extracts of endophytic fungi from medicinal plants. Beijing: Chinese Academy of Medical Sciences & Peking Union Medical College, 2009. (in Chinese) 王雅俊. 药用植物内生真菌发酵产物提取物抗HIV-1 活性研究. 北京: 北京协和医学院&中国医学科学院, 2009.
