长江朱杨江段和沱江富顺江段鱼类体内16种多环芳烃的含量
2013-04-19闫玉莲岳南南罗其勇谢小军
王 汨 闫玉莲 李 建 岳南南 罗其勇 谢小军
(西南大学生命科学学院, 水生生物及水环境研究所, 重庆 400715)
长江朱杨江段和沱江富顺江段鱼类体内16种多环芳烃的含量
王 汨 闫玉莲 李 建 岳南南 罗其勇 谢小军
(西南大学生命科学学院, 水生生物及水环境研究所, 重庆 400715)
于2010年9—11月在长江朱杨江段采集到9种鱼类标本, 分别为瓦氏黄颡鱼(Pelteobagrus vachelliRichardson)、圆筒吻(Rhinogobio cylindricusGünther)、鲤(Cyprinus carpioLinnaeus)、鲫(Carassius auratusLinnaeus)、大眼鳜(Siniperca kneriGarman)、铜鱼(Coreius heterodonBleeker)、圆口铜鱼(Coreius guichenotiSauvageetDabry)、大鳍鳠(Mystus macropterusBleeker)和鲇(Silurus asotusLinnaeus); 在该江段上游支流沱江富顺江段采集到6种鱼类标本, 分别为鲫、黄颡鱼(Pelteobagrus fulvidracoRichardson)、鲤、大眼鳜、大鳍鳠和鲇, 每种鱼的样本量为6—11尾, 共计192尾。采用快速溶剂萃取及气相色谱法对鱼体中的16种多环芳烃(PAHs)含量进行了检测。结果显示, 在两个江段的各种鱼体样本中均检测到了多种多环芳烃的存在。在长江干流朱杨江段所采集到的9种鱼中瓦氏黄颡鱼体内多环芳烃总量(∑PAHs)最高, 其含量为(2803.78± 215.37) ng/g; 鲇鱼体内∑PAHs最低, 其含量为(515.86±38.80) ng/g。在沱江富顺江段采集到的6种鱼中鲫体内∑PAHs最高, 为(8498.57±1128.22) ng/g; 鲇鱼体内∑PAHs最低, 其含量为(1295.05±69.69) ng/g。采集自长江朱杨段和沱江富顺段两采集地的相同种类有5种, 富顺段5种鱼体内∑PAHs均高于朱杨段同种类鱼体内的含量; 除大眼鳜外, 其余4种鱼的差异均达到显著水平。富顺江段鱼类体内高分子量多环芳烃比例较高,而朱杨江段鱼类体内富集的低分子量多环芳烃和中分子量多环芳烃的比例较高。通过讨论认为, 长江朱杨段及其支流沱江富顺段的鱼体均受到了多环芳烃的污染, 并且沱江鱼类受多环芳烃的污染程度高于长江干流朱杨段鱼类。此外, 沱江富顺段鱼体所含的高分子量多环芳烃组成百分比高于长江干流朱杨段的鱼体, 但其中、低分子量多环芳烃组成百分比相对于干流鱼类较低, 可能的原因是两个江段多环芳烃的污染源不同。
水体污染; 多环芳烃; 鱼类; 长江; 沱江
多环芳烃(Polycyclic Aromatic Hydrocarbons, PAHs)是指一类分子中含有2个或2个以上苯环的碳氢化合物[1]。多环芳烃为持久性有机污染物中的一类, 因其具有致癌、致畸、致突变的性质而受到广泛关注[2]。多环芳烃主要来源于人类活动, 如化石燃料不完全燃烧和生物质燃烧[3], 石油渗漏[4]等。美国环保总署在1987年将其中16种多环芳烃规定为重点监测污染物[5]。美国毒物和疾病登记署(Agency for Toxic Substances and Disease Registry, ATSDR)[6]根据多环芳烃的环数和分子量的不同将其分为三大类:低分子量 (Low Molecular Weight, LMW)、中分子量(Medium Molecular Weight, MMW)和高分子量(High Molecular Weight, HMW)多环芳烃。在我国的一些江河、湖泊的水体及其中的鱼类体内现已被检测出了多环芳烃的存在[7—9]。
鱼类处于水生生物的较高营养等级, 是水体生态系统的重要组成部分。水环境中的多环芳烃通过鳃、皮肤或食物进入鱼体内累积[10], 对鱼类产生各种毒害作用[11,12]。由于多环芳烃在鱼体内累积程度与其水环境中的背景浓度相一致[13,14], 因此鱼类也被认为是相关污染监测的重要指示物种[15,16]。目前,有关16种多环芳烃污染物对鱼类的影响已经成为鱼类环境毒理学研究和资源保护的主要关注点之一[16]。
长江朱杨江段位于长江三峡库区上游重庆段流水区域, 在长江上游珍稀特有鱼类国家自然保护区内。富顺位于沱江下游, 而沱江是长江的主要支流,在长江朱杨段的上游汇入长江。沱江的流域内大、中型工厂多达千余座, 人口密度之高冠于其他各支流河流域[17,18]。长江上游共分布有鱼类260余种, 是我国淡水鱼类种质资源最为丰富的地区之一[19,20]。目前已有研究者检测了长江上游水体底泥与水体多环芳烃的含量与分布[21], 但关于该流域鱼类体内多环芳烃含量的报道较少[22]。
本研究对长江朱杨江段以及其上游支流沱江富顺江段10种常见鱼类体内上述16种多环芳烃的含量进行了检测, 为进一步探讨长江上游江段水文环境的污染因子对鱼类种群动态的影响提供理论依据,并为库区及长江上游鱼类资源保护和生物多样性的重建以及水产品质量与安全评价等提供基础资料。
1 材料与方法
1.1 样本采集
于2010年10—11月在长江朱杨段采集瓦氏黄颡鱼(Pelteobagrus vachelli Richardson)11尾, 铜鱼(Coreius heterodon Bleeker)10尾, 圆口铜鱼(Coreius guichenoti Sauvage et Dabry)和鲇(Silurus asotus Linnaeus)各9尾, 圆筒吻(Rhinogobio cylindricus Günther)、大眼鳜(Siniperca kneri Garman)、鲤(Cyprinus carpio Linnaeus)和大鳍(Mystus macropterus Bleeker)各8尾, 鲫(Carassius auratus Linnaeus)6尾。同年的9—11月在沱江富顺段采集大眼鳜10尾, 黄颡鱼(Pelteobagrus fulvidraco Richardson)和鲇各9尾, 鲤、鲫和大鳍各8尾。样本采集后进行常规生物学测量(表1、表2), 用锡箔纸单尾包装置于−20℃下冷冻保存。
1.2 样品预处理
取采集的鱼体第3—5枚脊椎骨, 进行年龄鉴定。将鱼体(全鱼)样品在70℃下烘至恒重[23], 然后研磨为细末。多环芳烃抽提方法根据Liguori, et al.[24]修改: 称取鱼粉1—2 g, 与3 g硅藻土混合均匀; 在萃取池中依次装入3 g硅藻土、9 g氧化铝、6 g硅胶、2 g无水硫酸镁以及鱼粉与硅藻土的混合物; 采用二氯甲烷作为抽提溶剂, 使用快速溶剂萃取仪(APLE-1000, 北京吉天仪器公司)对样品在温度为100℃、压力为10.34 MPa条件下、加热5min后萃取6min; 以萃取池体积60%的二氯甲烷分4次进行淋洗, 氮气吹扫3min, 上述过程重复4次。所得萃取液以氮气浓缩至1 mL左右, 再加入10 mL正己烷浓缩至约1 mL, 最后用正己烷定容至5 mL作为气相色谱测定的样品。
1.3 样品多环芳烃含量测定
气相色谱条件 以Agilent 7890A GC型气相色谱仪(美国Agilent 公司)对样品萃取液中的16种多环芳烃(萘、苊烯、苊、芴、菲、蒽、荧蒽、芘、苯并[a]蒽、屈、苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、茚酚[1, 2, 3-cd]芘、二苯并[a, h]蒽和苯并[g, h, i]苝)进行检测。色谱条件如下: 检测器为氢火焰离子化检测器(FID); 采用HP-5毛细管柱(30 m×0.32 mm×0.25 μm), 载气为高纯氮气, 流量为1 mL /min,自动不分流进样, 进样体积为2 μL; 升温程序为:初始温度为80℃, 保持1min, 然后以20℃/min 升至150℃, 再以4℃/min 升至290℃, 保留5min; 进样口温度为290℃, 检测器温度为320℃。
标准样品 以正己烷为溶剂, 配制 16种多环芳烃(购自美国 Accu Standard Inc.公司, 2000 μg/mL)混标储备液, 混标储备液中16种多环芳烃含量均为200 μg/mL。使用时再用正己烷逐级稀释至建立标准曲线所需浓度, 用外标法计算样品中多环芳烃含量。建立标准曲线时, 所采用的标准液浓度为(μg/mL): 0.1、0.2、0.3、0.4、0.5和1.0。
质量控制与质量保证 所用试剂皆为分析纯,除乙醚外所有试剂均经双蒸处理, 经气相色谱检验合格后使用。实验中所用的中性氧化铝( 100—200目, AR级)、硅胶( 80—100目, AR级) 、硅藻土(AR级)均经快速溶剂萃取仪以二氯甲烷清洗并活化, 其中中性氧化铝在120℃活化12h, 硅胶和硅藻土在180℃活化4h。所用玻璃仪器用清洁剂经超声波清洗器洗净, 在120℃的条件下烘干后再以正己烷淋洗。分析过程参照美国国家环保局(USEPA)的QA/QC控制样监控: 试剂空白、空白加标、基质加标和样品平行样, 并以回收率指示样品制备过程的影响。其中16种多环芳烃的加标量均为0.2 μg/mL,每个样品重复6个平行, 样品平行偏差< 6%。样品中16种多环芳烃的加标回收率在90.14%—102.64% (表3)。

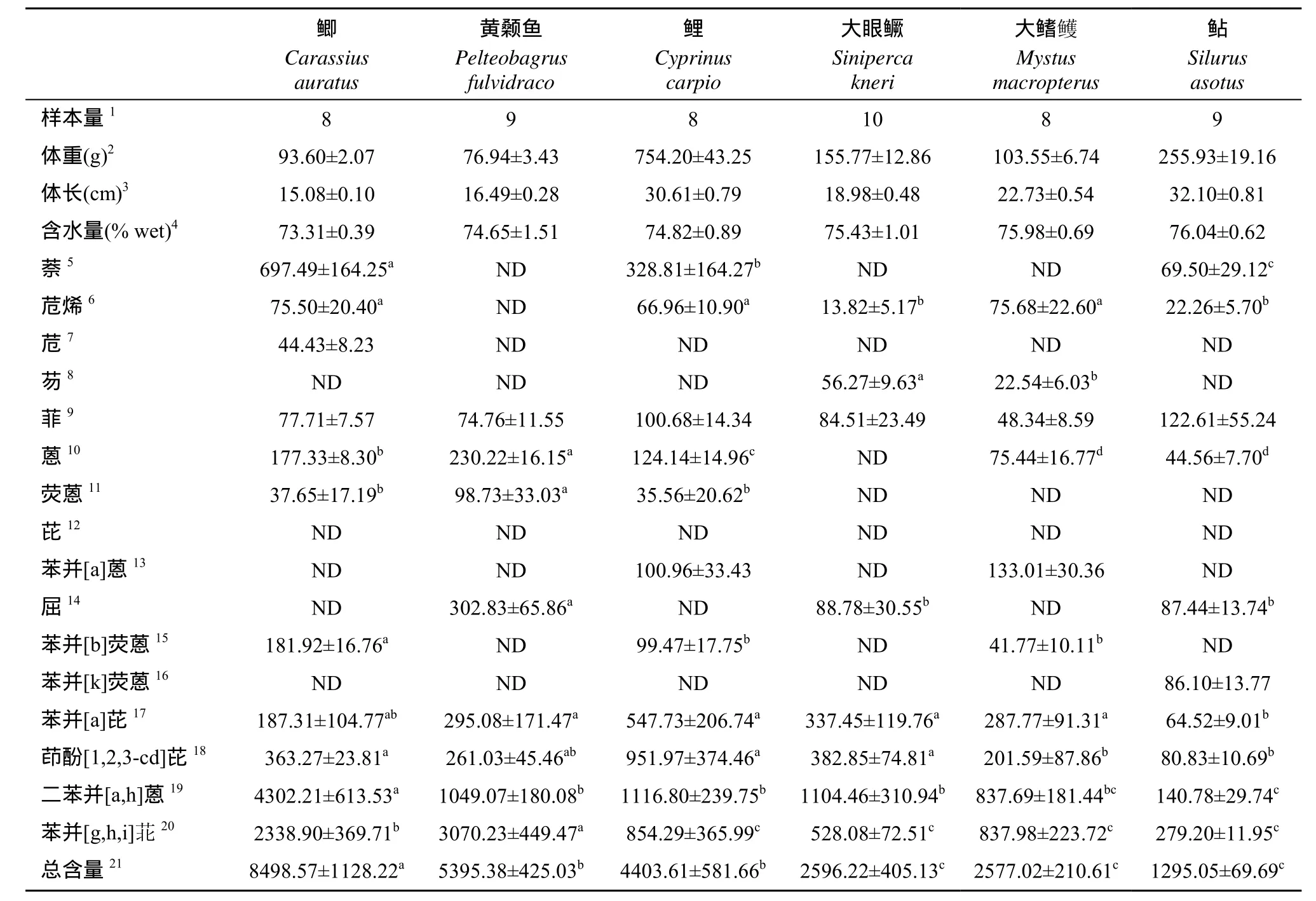
表2 沱江富顺江段鱼类多环芳烃含量(ng/g 湿重)Tab.2 Residual levels of PAHs in the fishes from the Fushun section of the Tuo River (ng/g wet weight)
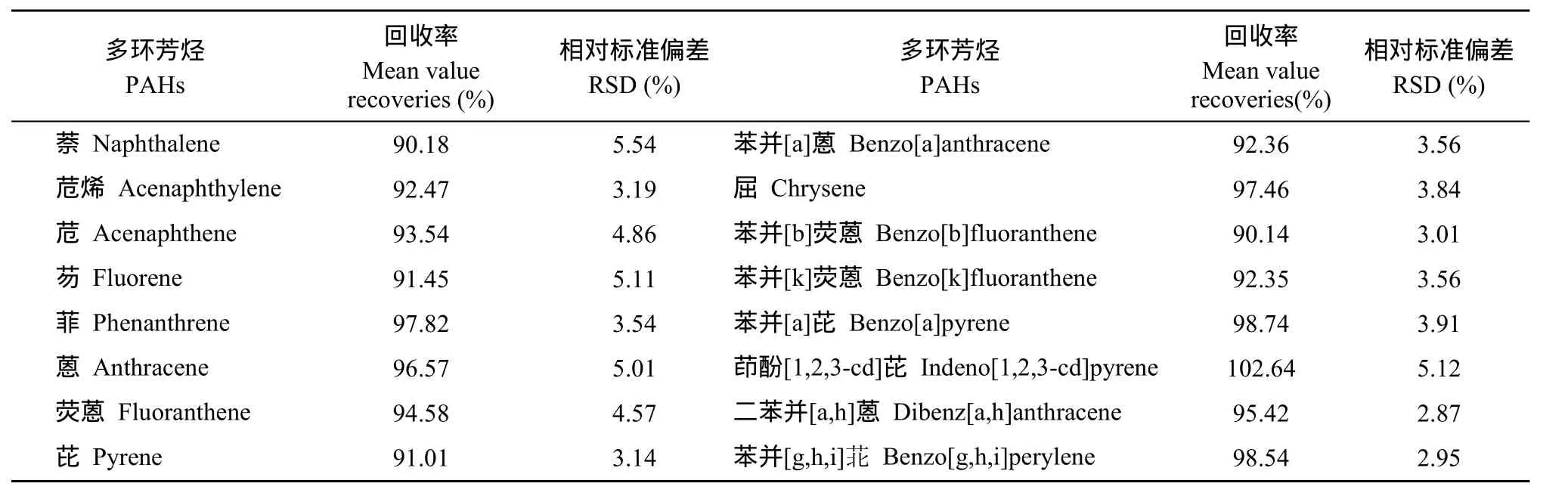
表3 16种多环芳烃在样品中加标的平均回收率及相对标准偏差(RSD)Tab.3 Recoveries and relative standard deviation (RSD) of the 16 polycyclic aromatic hydrocarbon (PAHs) in spiked samples (n=6)
1.4 数据处理方法
采用Excel (2003)和SPSS (11.5)软件进行数据的整理及统计分析, 统计数据以平均值±标准误(Mean ± SE)表示。采用单因素方差分析(Analysis of variance, ANOVA)及最小显著差数法(Least signifycant difference, LSD)多重比较相同江段不同鱼体内多环芳烃的含量; 采用独立样本t检验比较不同江段同种鱼类体内多环芳烃含量的差异, 均以P< 0.05作为差异达到显著性的标准。
2 结果
2.1 长江朱杨江段鱼类体内多环芳烃的含量及分布
长江朱杨江段的9种鱼类(共计77尾)体内16种多环芳烃(萘、苊烯、苊、芴、菲、蒽、荧蒽、芘、苯并[a]蒽、屈、苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、茚酚[1, 2, 3-cd]芘、二苯并[a, h]蒽和苯并[g, h, i]苝)的含量检测结果(以每克湿体重为量纲基准, ng/g,表1)。可见, 9种鱼类体内16种多环芳烃的总含量(∑PAHs, ng/g)从高到低依次为: 瓦氏黄颡鱼(2803.78±215.37)、圆筒吻(2034.76±179.92)、鲤(1988.12±329.83)、鲫(1505.90±288.58)、大眼鳜(1397.99±247.51)、铜鱼(1007.06±50.77)、圆口铜鱼(932.87±69.60)、大鳍鳠(801.43±44.12)、鲇(515.86± 38.80)。其中, 瓦氏黄颡鱼体内∑PAHs显著高于其他8种鱼类(P<0.05)。圆筒吻和鲤体内∑PAHs与鲫体内∑PAHs无显著差异, 但显著高于其他5种鱼类体内含量(P<0.05)。鲫体内∑PAH与鲇体内∑PAHs差异显著(P<0.05), 但与大眼鳜、铜鱼、圆口铜鱼和大鳍鳠4种鱼类差异不显著。大眼鳜与铜鱼、圆口铜鱼、大鳍鳠体内∑PAHs差异不显著, 但与鲇∑PAHs差异显著(P<0.05)。铜鱼、圆口铜鱼、大鳍鳠和鲇体内∑PAHs差异不显著。
鲫和大眼鳜体内富集了11种不同含量的多环芳烃, 其他7种鱼类分别不同程度的富集了7—9种不同种类的多环芳烃。在该江段的所有鱼体样本中均检测到了萘、苊烯、菲和蒽的存在。苯并[b]荧蒽、苯并[a]芘和苯并[g, h, i]苝的检出率最低, 仅分别在圆筒吻、鲫和大鳍鳠体内检测到。
2.2 沱江富顺江段鱼类体内多环芳烃的含量及分布
沱江富顺江段6种鱼类(共计52尾)体内16种多环芳烃的含量检测结果见表2。可见, 6种鱼体内16种多环芳烃的∑PAHs(ng/g)从高到低依次为: 鲫(8498.57±1128.22)、黄颡鱼(5395.38±425.03)、鲤(4403.61±581.66)、大眼鳜(2596.22±405.13)、大鳍鳠(2577.02±210.61)、鲇(1295.05±69.69)。其中, 鲫体内∑PAHs显著高于其他5种鱼(P<0.05); 黄颡鱼体内∑PAHs与鲤体内∑PAHs无显著差异, 但它们分别与其余3种含量较低的鱼类差异显著(P<0.05); 大眼鳜、大鳍鳠与鲇体内∑PAHs的含量无显著差异。
鲫和鲤体内分别不同程度地富集了11种不同种类的多环芳烃, 其他4种鱼类分别不同程度的富集了8—10种不同种类的多环芳烃。在该江段的所有鱼体样本中均检测到了菲、苯并[a]芘、茚酚[1, 2, 3-cd]芘、二苯并[a, h]蒽和苯并[g, h, i]苝的存在。在该江段的所有鱼体样本中均未检测到芘的存在。检出率较低的还有苊和苯并[k]荧蒽, 其中苊仅在鲫中检测到, 苯并[k]蒽仅在鲇中检测到。
2.3 朱杨和富顺江段鱼类体内多环芳烃含量和组成的比较
在长江朱杨江段和沱江富顺江段均收集到的相同种类有5种, 分别为大眼鳜、大鳍鳠、鲫、鲤和鲇。富顺5种鱼类体内∑PAHs均分别高于朱杨同种鱼类∑PAHs, 其中4种鱼类的差异达到显著水平(图1)。富顺江段鱼类体内高分子量多环芳烃(包括苯并[a]芘、二苯并[a, h]蒽、苯并[g, h, i]苝、茚酚[1, 2, 3-cd]芘)的相对比例较高(图2), 而朱杨江段鱼类体内富集的中分子量多环芳烃(包括荧蒽、芘、苯并[a]蒽、屈、苯并[b]荧蒽、苯并[k]荧蒽)和低分子量多环芳烃(包括萘、苊烯、苊、芴、荧蒽、菲、蒽)的比例较高(图3、图4), 且差异均达到显著水平。
3 讨论
3.1 长江朱杨段和沱江富顺段的鱼体均受到多环芳烃的污染
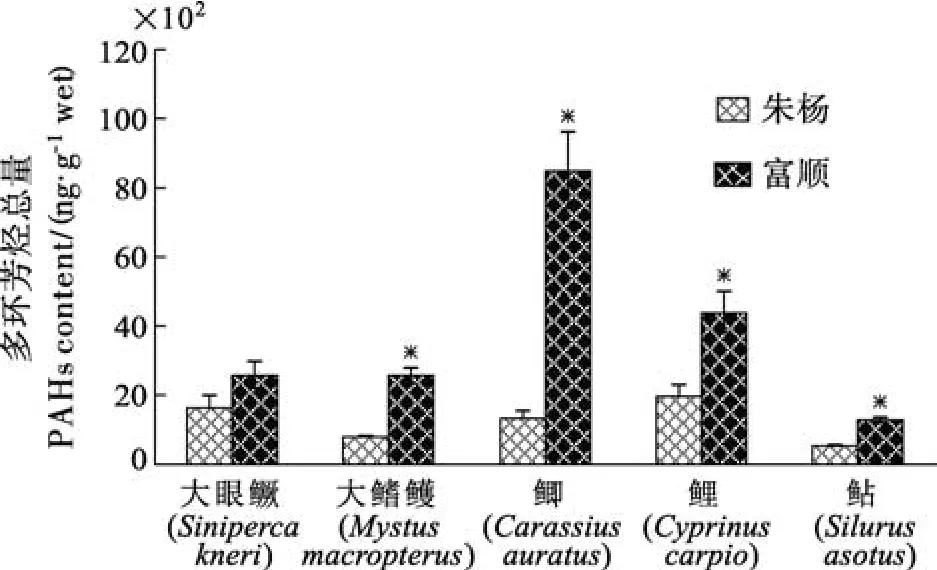
图1 朱杨和富顺5种鱼类体内多环芳烃总含量的比较Fig.1 Contents of PAHs in the five species from the Zhuyang section and the Fushun section
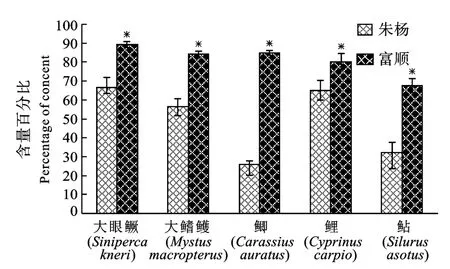
图2 朱杨和富顺5种鱼类体内高分子量多环芳烃含量百分比的比较Fig.2 Percentage of high molecular weight PAHs in the five fish species from the Zhuyang section and the Fushun section
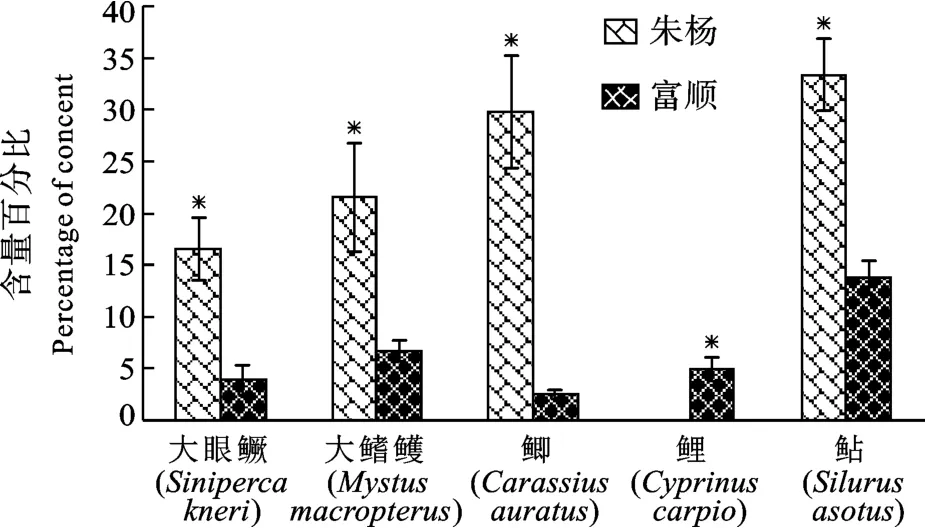
图3 朱杨和富顺5种鱼类体内中分子量多环芳烃含量百分比的比较Fig.3 Percentage of medium molecular weight PAHs in the five fish species from the Zhuyang section and the Fushun section
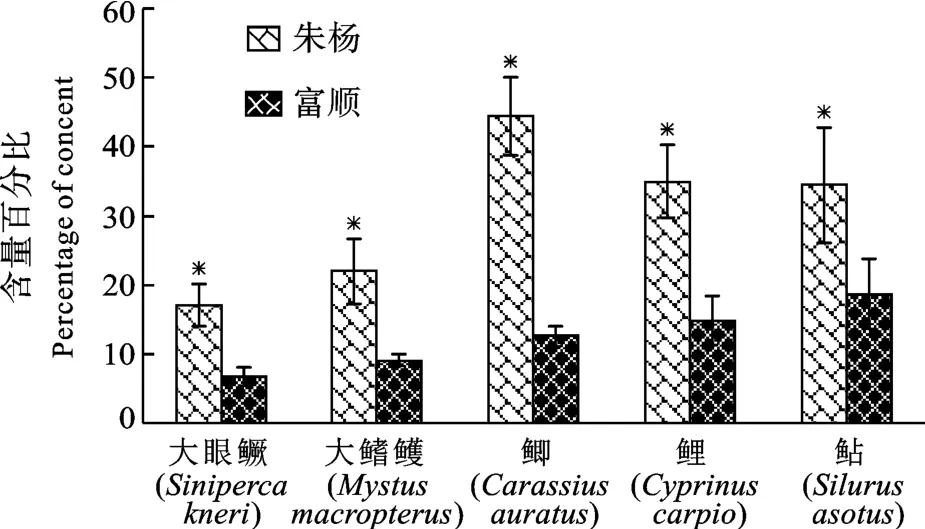
图4 朱杨和富顺5种鱼类体内低分子量多环芳烃含量百分比的比较Fig.4 Percentage of low molecular weight PAHs in the five fish species from the Zhuyang section and the Fushun section
已有研究发现, 水环境中的多环芳烃通过鱼体的鳃、皮肤或食物进入鱼体中, 对鱼体产生毒理效应[2,11]。当鱼体内多环芳烃含量达到一定水平时, 其生长[11]、繁殖[25]和存活[26]等将呈现异常反应, 由于多环芳烃具有遗传毒性, 还会对鱼类种群动态产生影响[12]。Pal, et al.[27]在对鲤(Cyprinus carpio)研究中发现, 每克干体重的∑PAHs含量达1730 ng/g的鲤,其肝脏和肾脏出现细胞坏死等大量组织病理学变化。Palanikumar, et al.[28]发现, 对于体内的蒽含量达每克干体重为820 ng/g的遮目鱼(Chanos chanos),多环芳烃会造成其体内的脂质过氧化程度显著增高和相关神经酶类活性显著降低, 形成神经毒性, 并显著降低其存活率。本研究发现, 长江朱杨江段和沱江富顺江段的鱼体内均不同程度的富集了多环芳烃并且含量较高。按本研究对朱杨江段和富顺江段鱼体含水量的检测结果(表1和表2)推算, 两个采样点10种鱼体内的∑PAHs含量均超过了上述鱼类体内的∑PAHs含量。由此可以推测, 这两个江段的鱼类均受到了多环芳烃的污染, 而且所受到的多环芳烃污染可能对鱼体会造成生长率降低、死亡率增高等一系列毒理学影响。天然河流中的污染物是以长时间暴露和多种类的方式存在, 生活于其中的鱼类所受到的生态毒理学影响是各种污染物交互作用的综合结果[29]。因而鱼体内的多环芳烃对于鱼体造成影响的具体效应需进一步研究予以检验。
3.2 长江上游干流与其支流沱江水体受多环芳烃污染的差异
鱼体中的多环芳烃含量与水环境中的多环芳烃含量密切相关[13], 并随着水环境多环芳烃浓度的增高而增高[14]。比较本研究两个采样点均收集到的大眼鳜、大鳍鳠、鲫、鲤和鲇等5种鱼类样本的测定结果可以发现, 富顺5种鱼类体内∑PAHs均分别高于朱杨同种鱼类∑PAHs。由此可以认为, 沱江富顺段水体受多环芳烃污染程度较长江朱杨江段更为严重。
在鱼体内多环芳烃组成上, 富顺江段鱼类体内高分子量多环芳烃的相对比例较高, 而朱杨江段鱼类体内富集的中分子量多环芳烃和低分子量多环芳烃的比例较高。由此可以认为, 沱江富顺段水体中的污染以高分子量多环芳烃为主, 长江朱杨江段水体中的污染以中低分子量多环芳烃为主。通常认为,不同分子量多环芳烃的相对丰度可以反映多环芳烃的来源, 中低分子量多环芳烃主要来源于石油类污染, 例如石油类的泄漏和低温燃烧等; 高分子量多环芳烃主要来源于化石燃料的高温燃烧, 例如焦化和火力发电等[30,31]。在工业污水排放较多的水域水体中高分子量多环芳烃组成比例也较高[32]。由此可以推测, 长江朱杨段水体多环芳烃污染的主要来源是航船运输造成的燃油泄漏, 而沱江富顺段水体多环芳烃污染的主要来源是工业污水的排放。现有研究对于长江中上游重庆主城的水体中多环芳烃的含量进行了调查[33,34], 发现该江段水体中低分子量的多环芳烃所占比例较高, 主要原因是航船运输造成的燃油泄漏和生活污水排放, 这一点与上述的推论相符。目前, 尚未见有关沱江水体多环芳烃含量、分布及来源的报道。沱江流域内有大中城市, 大、中型工厂多达千余座, 沿岸生活垃圾、生活污水和工业废水的排放均会对江水产生一定的污染[17,18],富顺样点位于沱江中下游主河道上, 上游产生的污水均有可能排放入江而流经此处。这是否为造成沱江富顺江段水体多环芳烃总量和高分子量多环芳烃含量比例较高的原因, 有待对该江段水环境进一步研究予以验证。
4 结论
综上所述, 长江朱杨江段和沱江富顺江段的鱼类均不同程度的受到了多环芳烃的污染, 沱江富顺江段多环芳烃的污染程度高于长江朱杨江段, 而这两个地点多环芳烃的组成差异可能是由于两个江段多环芳烃污染源的不同造成的。
致谢:
实验师明道富、研究生邓冬富、曾乐意、彭涛、闫常春参加了部分实验工作, 特致谢忱。
[1] Freeman D J, Cattell F C R.Woodbunring as a source of atmospheric polycyclic aromatic hydorcarbons [J].Environmental Science and Technology, 1990, 24(10): 1581—1585
[2] Aas E, Baussant T, Balk L, et al.PAH metabolites in bile, cytochrome P4501A and DNA adducts as environmental risk parameters for chronic oil exposure: a laboratory experiment with Atlantic cod [J].Aquatic Toxicology, 2000, 51(2): 241—258
[3] Mastral A M, Callén M S.A review on polycyclic aromatic hydrocarbon (PAH) emissions from energy generation [J].Environmental Science and Technology, 2000, 34(15): 3051—3057
[4] Khalili N R, Scheff P A, Holsen T M.PAH source fingerprints for coke ovens, diesel and gasoline engines, highway tunnels, and wood combustion emissions [J].Atmospheric Environment, 1995, 29(4): 533—542
[5] EPA.Quality criteria for water.EPA 440/5-86-001 [S].US Environmental Protection Agency, Washington DC.1987
[6] Agency for Toxic Substances and Disease Registry (ATSDR).Toxicological profile for Polyaromatic Hydrocarbons - Update [R].Atlanta: U.S.Department of Health and Human Services, Toxicology Information Branch.1995, 458
[7] Kong K Y, Cheung K C, Wong C K C, et al.The residual dynamic of polycyclic aromatic hydrocarbons and organochlorine pesticides in fishponds of the Pearl River delta, South China [J].Water Research, 2005, 39(9): 1831—1843
[8] Liang Y, Tse M F, Young L, et al.Distribution patterns of polycyclic aromatic hydrocarbons (PAHs) in the sediments and fish at Mai Po Marshes Nature Reserve, Hong Kong [J].Water Research, 2007, 41(6): 1303—1311
[9] Xu F L, Wu W J, Wang J J, et al.Residual levels and health risk of polycyclic aromatic hydrocarbons in freshwater fishes from Lake Small Bai-Yang-Dian, Northern China [J].Ecological Modelling, 2011, 222(2): 275—286
[10] Van der Oost R, Beyer J, Vermeulen N P E.Fish bioaccumulation and biomarkers in environmental risk assessment: a review [J].Environmental Toxicology and Pharmacology, 2003, 13: 57—149
[11] Kim S G, Park D K, Jang S W, et al.Effects of dietary benzo[a]pyrene on growth and hematological parameters in Juvenile Rockfish, Sebastes schlegeli (Hilgendorf) [J].Ecotoxicology and Environment Safety, 2008, 81(5): 470—474
[12] Wahidulla S, Rajamanickam Y R.Detection of DNA damage in fish Oreochromis mossambicus induced by co-exposure to phenanthrene and nitrite by SI-MS/MS [J].Environmental Science & Pollution Research, 2009, 17(2): 441—452
[13] Milinkovitch T, Kanan R, Thomas-Guyon H, Floch S L, et al.Effects of dispersed oil exposure on the bioaccumulation of polycyclic aromatic hydrocarbons and the mortality of juvenile Liza ramada [J].Science of the Total Environment, 2011, 409(9): 1643—1650
[14] Yin Y, Jia H.X., Sun Y Y, et al.Bioaccumulation and ROS generation in liver of Carassius auratus exposed to phenanthrene [J].Comparative Biochemistry and Physiology, Part C, 2007, 145(20): 288—293
[15] Haasch M L, Lech J J, Prince R, et al.Caged and wild fish: Induction of hepatic cytochrome P-450 (CYP1A1) as an environmental biomonitor[J].Environmental Toxicology and Chemistry, 1993, 12(5): 885—895
[16] Ariese F, Kok S J, Verkaik M, et al.Synchronous fluorescence spectrometry of fish bile: A rapid screening method for the biomonitoring of PAH exposure [J].Aquatic Toxicology, 1993, 26(3): 273—286
[17] Cao L J, Ye L L, Zhao L, et al.Research on the water quality in wet season of the Tuo River in main urban zone of Neijiang [J].Journal of Neijiang Normal University, 2008, 23(1): 263—266 [曹六俊, 叶丽丽, 赵蕾, 等.内江市主城区沱江丰水期水质调查研究.内江师范学院院报, 2008, 23(1): 263—266]
[18] Xiao J J, Li X D, Wang H L, et al.Evaluation of water quality in Tuojiang River and analysis on its variation trend [J].China Water & Wastewater, 2010, 22(26): 119—121 [肖玖金, 李旭东, 王红磊, 等.沱江水质现状评价与变化趋势分析.中国给水排水, 2010, 26(22): 119—120]
[19] Fu C Z, Wu J H, Chen J K, et al.Freshwater fish biodiversity in the Yangtze River basin of China: patterns, threats and conservation [J].Biodiversity and Conservation, 2003, 12(8): 1649—1685
[20] Liu S P, Duan X B, Chen D Q, et al.Studies on status of fishery resources in the middle reach of the Yangtze River [J].Acta Hydrobiologica Sinca, 2005, 29(6): 708—711 [刘绍平,段辛斌, 陈大庆, 等.长江中游渔业资源现状研究.水生生物学报, 2005, 29(6): 708—711]
[21] Guo Z S, Luo C H, Zhang W D, et al.The analysis of the persistent organic pollution in the Three Gorges Region in Chongqing [J].Environmental Monitoring in China, 2006, 22(4): 45—48 [郭志顺, 罗财红, 张卫东, 等.三峡库区重庆段水中持久性有机污染物污染状况分析.中国环境监测, 2006, 22(4): 45—48]
[22] Zhang Q, Guo Z S, Zhou X.Research on the pollution of persistent organ pollutants in fish in Chongqing section of the Three Gorges Reservoir [J].Sichuan Environmental, 2007, 26(2): 14—16 [张芹, 郭志顺, 周谐.三峡库区重庆段鲶鱼和鲤鱼体内持久性有机污染物分析.四川环境, 2007, 26(2): 14—16]
[23] Wu X M.Research of analysis method compare for polycyclic aromatic hydrocarbons (PAHs) in food [D].Thesis for Master of Engineering.Zhejiang Gongshang University, Hangzhou.2008 [吴雪美.食品中多环芳烃物质分析方法比较研究.硕士学位论文, 浙江工业大学, 浙江.2008]
[24] Liguori L, Heggstad K, Hove H T, et al.An automated extraction approach for isolation of 24 polyaromatic hydrocarbons (PAHs) from various marine matrixes [J].Analytica Chimica Acta, 2006, (573—574): 181—188
[25] Monteverdi G H, DiGiulio R T.Vitellogenin-associated maternal transfer of exogenous and endogenous ligands in the estuarine fish, Fundulus heteroclitus [J].Marine Environment Research, 2000, 50: 191—199
[26] Collier T K, Varanasi U.Hepatic activities of xenobiotic metabolizing enzymes and biliary levels of xenobiotics in English sole (Parophrys vetulus) exposed to environmental contaminants [J].Archives of Environment Contamination and Toxicology, 1991, 20(4): 462—473
[27] Pal S, Kokushi E, Cheikyula J O, et al.Histopathological effects and EROD induction in common carp exposed to dietary heavy oil [J].Ecotoxicology and Environmental Safety, 2011, 74(3): 307—314
[28] Palanikumar L, Kumaraguru A K, Ramakritinan C M, et al.Biochemical response of anthracene and benzo[a]pyrene in milkfish Chanos chanos [J].Ecotoxicology and Environmental Safety, 2012, 75: 187—197
[29] Fonseca V F, Franca S, Serafim A, et al.Multi-biomarker responses to estuarine habitat contamination in three fish species: Dicentrarchus labrax, Solea senegalensis and Pomatoschistus microps [J].Aquatic Toxicology, 2011, 102: 216—227
[30] Mai B X, Fu J M, Sheng G Y, et al.Chlorinated and polycyclic aromatic hydrocarbons in riverine and estuarine sediments from Pearl River Delta, China [J].Environmental Pollution, 2002, 117(3): 457—474
[31] Bihari N, Fafandel M, Piškur V.Polycyclic Aromatic Hydrocarbons and Ecotoxicological Characterization of Seawater, Sediment, and Mussel Mytilus galloprovincialis from the Gulf of Rijeka, the Adriatic Sea, Croatia [J].Archives of Environment Contamination and Toxicology, 2007, 52(3): 379—387
[32] Cai Q Y, Mo C H, Wu Q T, et al.Bioremediation of polycyclic aromatic hydrocarbons (PAHs) contaminated sewage sludge by different composting processes [J].Journal of Hazardous Materials, 2007, 142: 535—542
[33] Liang Y.Pollution and risk assessment of polycyclic aromatic hydrocarbons of the Yangtze River and Jialing River in Chongqing [D].Chongqing University, Chongqing.2009 [梁艳.长江嘉陵江重庆段多环芳烃污染状况及风险评价.硕士学位论文, 重庆大学, 重庆.2009]
[34] Xu Y X.Study of organic pollution and migration of typical organic pollutants in the upstream of the Yangtze River in Chongqing, China [D].Thesis for Master of Science.Southwest University, Chongqing.2010 [许艳秋.长江中上游重庆主城区水体有机污染概况及典型有机污染物的环境迁移行为初探.硕士学位论文, 西南大学, 重庆.2010]
POLYCYCLIC AROMATIC HYDROCARBONS IN FISH FROM THE ZHUYANG SECTION OF THE YANGTZE RIVER AND THE FUSHUN SECTION OF THE TUO RIVER, CHINA
WANG Mi, YAN Yu-Lian, LI Jian, YUE Nan-Nan, LUO Qi-Yong and XIE Xiao-Jun
(Institute of Hydrobiology and Water Environment, School of Life Science, Southwest University, Chongqing 400715, China)
From September to November 2010, the samples of 9 species were collected from the Zhuyang section of the Yangtze River, includingPelteobagrus vachelli,Rhinogobio cylindricus,Cyprinus carpio,Carassius auratus,Siniperca kneri,Coreius heterodon,Coreius guichenoti,Mystus macropterus, andSilurus asotus, and the samples of 6 fish species were collected from the Fushun section of the Tuo River, includingCarassius auratus,Pelteobagrus fulvidraco,Cyprinus carpio, Siniperca kneri, Mystus macropterus, and Silurus asotus.The sample size for each fish species ranged from 6 to 11, totaling of 192.The concentration 16 polycyclic aromatic hydrocarbons (PAHs) in each sample were measured by accelerated solvent extraction and gas chromatography.A variety of PAHs were detected in these fish samples.Of the 9 species of fish collected from the Zhuyang section,P.vachellihad the highest total content of PAHs (∑PAHs) [(2803.78±215.37) ng/g], andS.asotushad the lowest ∑PAHs [(515.86±38.80) ng/g].Of the 6 species of fish collected from the Fushun section, C.auratus had the highest ∑PAHs [(8498.57±1128.22) ng/g], and S.asotus had the lowest∑PAHs [(1295.05±69.69) ng/g].Five species of fish were collected from both the Zhuyang section and the Fushun section.Au from the Fushun section showed higher ∑PAHs than their respective counterparts from the Zhuyang section S.kneri.The fishes from the Fushun section contained a higher percentage of high-molecular-weight PAHs (HMW-PAHs), while those from the Zhuyang section contained higher percentages of low-molecular-weight PAHs (LMW-PAHs) and medium-molecular-weight PAHs (MMW-PAHs).Our results suggest that the fish from the Zhuyang section and those from the Fushun section were all contaminated by PAHs.In addition, the fish from the Fushun section contain a higher percentage of HMW-PAHs but lower percentages of MMW-PAHs and LMW-PAHs, as compared with those from the Zhuyang section.This difference may be caused by the difference in pollution source of PAHs between these two river sections.
Water pollution; Polycyclic aromatic hydrocarbons; Fish; Yangtze River; Tuo River
X171.5
A
1000-3207(2013)02-0358-09
10.7541/2013.27
2012-09-12;
2012-12-24
中国长江三峡集团公司资助(CT-11-08-01); 重庆市自然科学基金资助项目(cstc2012jjA20017)资助
王汨(1984—), 女, 山东青岛人; 博士研究生; 主要从事鱼类生理生态学研究。E-mail: mier_246@163.com
谢小军, E-mail: xjxie@swu.edu.cn
