KK-42对凡纳滨对虾物质储备相关酶类基因表达的影响
2013-04-19夏西超杨洪宁黔冀吕黎吕艳杰
夏西超杨 洪宁黔冀吕 黎吕艳杰
(1.河南师范大学生命科学学院, 新乡 453007; 2.南阳医学高等专科学校基础医学院, 南阳 473061)
KK-42对凡纳滨对虾物质储备相关酶类基因表达的影响
夏西超1,2杨 洪1宁黔冀1吕 黎1吕艳杰1
(1.河南师范大学生命科学学院, 新乡 453007; 2.南阳医学高等专科学校基础医学院, 南阳 473061)
甲壳动物生长发育总是与蜕皮联系在一起的[1]。为了完成蜕皮, 顺利实现生长, 甲壳动物在蜕皮间期进行快速大量取食, 临近蜕皮前取食逐渐减少, 直至蜕皮时停止, 待蜕皮后动物具备了坚硬外壳, 又开始缓慢取食[2−3]。基于对甲壳动物幼体物质储备的研究, Anger和Dawirs提出不可恢复点(Point of no return, PNR)和饱和储存点(Point of reserve saturation, PRS)两个学说, 阐述了物质储备与蜕皮之间的关系: PNR指在蜕皮过程中, 若物质储备未到达极限点, 即使再补充饵料也无法使动物顺利发育进入下一个蜕皮周期; PRS指蜕皮前动物物质储备如果充足, 此时有无饵料供应, 动物都可以顺利进入蜕皮周期, 完成正常发育过程[4]。由此可见, 足够的营养储备是启动甲壳动物蜕皮的前提, 并为顺利度过蜕皮后脆弱阶段提供能量。该过程涉及多种酶的参与, 如肝胰腺中的胰蛋白酶、组织蛋白酶L、α-淀粉酶和α-葡萄糖苷酶等[5]。
咪唑类物质KK-42通常被视为是保幼激素的拮抗物,对昆虫的研究表明, 该类物质作用机理复杂, 其中包括影响几丁质酶的表达、干扰(或抑制)保幼激素的合成来改变昆虫的生长速率[6—8]。我们前期研究首次发现, KK-42能够促进凡纳滨对虾的生长[9]。鉴于有机物储备在凡纳滨对虾等甲壳动物生长中的作用, 我们选取了几种影响有机物储备的重要酶类, 首次从转录水平定量分析了KK-42对这些酶表达的影响, 为阐明KK-42作用的分子机理积累资料。
1 材料与方法
1.1 南美白对虾的处理
凡纳滨对虾养殖于巩义市黄河生态渔业产业园。在面积2664 m2(4亩)、水深1.5 m的池塘中, 架设2个面积60 m2、深1.5 m的网箱, 从池塘中采集健康幼虾(体长3.5—5.0 cm)800头, 随机分成2组, 其中一组用1.95×10−4mol/L的KK-42(烟台大学应用化学系提供, 纯度≥95%)溶液浸泡处理1min[7], 取出, 空气中静置数秒, 立刻投入到网箱中, 按正常方式养殖; 对照组用不含KK-42的溶液处理, 方法同上。KK-42处理后0、1、2、3、4、5、6、7、8d, 将动物冷冻麻醉, 解剖出肝胰腺, 液氮速冻,−80℃保存。
1.2 mRNA水平的定量测定
RNA提取用RNAiso Plus (TaKaRa)提取凡纳滨对虾肝胰腺总RNA, 总RNA的完整性和纯度用凝胶电泳检测, RNA的浓度根据A260进行定量。
cDNA第一链的合成按照PrimeScriptTMRT试剂盒(TaKaRa)操作说明合成cDNA第一链。10 μL反应体系: 5×PrimScriptTMBuffer 2 μL, PrimeScriptTMRT Enzyme Mix I 0.5 μL, Oligo dT Primer (50 mol/L) 0.5 μL, Random 6 mers (100 mol/L) 0.5 μL, 总RNA 100 ng。反应条件: 37℃, 15min, 85℃, 5s。
PCR引物设计根据目的基因和内参基因β-actin保守区域设计引物, 引物由上海生工公司合成(表1)。
实时荧光定量PCR 20 μL体系中包括: SYRB Premix ExTaqTM(TaKaRa) 10 μL, PCR上下游引物(10 mol/L)各0.4 μL, cDNA模板2 μL, ROX Reference Dye (TaKaRa) 0.4 μL, dH2O 6.8 μL。反应条件: 95℃ 30s, 1 cycle; 95℃ 5s, 60℃ 34s, 40 cycles。测定相关酶基因表达的样本数为9头/组/时间点, 重复3次。结果采用2−ΔΔct法进行分析, 实验所得数据采用unpairedt-test统计分析(P<0.05)。
2 结果
2.1 KK-42对胰蛋白酶、血蓝蛋白和组织蛋白酶L表达的诱导
实验观察期间, 对照组肝胰腺中胰蛋白酶 mRNA水平相对稳定(图1)。KK-42处理后1—6天, 胰蛋白酶mRNA水平升高42.6%以上, 尤其在第3至第6天达79.9%以上(P<0.01)(图1), 第7至第8天虽有升高, 但与对照组相比无统计学意义。
在对照组中, 肝胰腺组织蛋白酶L的基因表达水平相比血蓝蛋白呈明显的波动性变化(图2、图3)。KK-42处理能显著诱导血蓝蛋白和组织蛋白酶L 的转录, 前者mRNA水平在第1、第2、第3、第4、第6和第7天分别提高96.3%、106.2%、382.6%、116.2%、150.0%和202.1%(P<0.01)(图2); 后者在第4和第7 天升高幅度相对较小, 但也在51.9%以上(图3)。
2.2 KK-42对肝胰腺α-淀粉酶和α-葡萄糖苷酶表达的抑制
在对照组中, 肝胰腺α-淀粉酶和α-葡萄糖苷酶mRNA水平相对稳定(图4、图5)。KK-42处理可显著抑制上述两种酶mRNA的转录, 其中, α-淀粉酶在第1至第7天降幅51.9%以上, 第8天与对照组无显著性差异(图4); 在实验观察期间, α-葡萄糖苷酶的下调幅度均在57.2%以上(图5)。
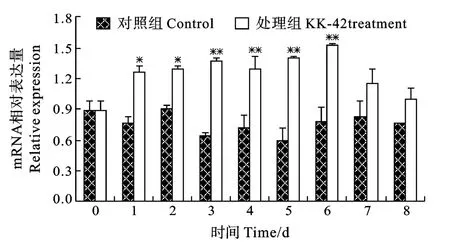
图1 KK-42对凡纳滨对虾肝胰腺蛋白酶基因表达的诱导Fig.1 The time-course induction of KK-42 on hepatopancreas trypsin mRNA expression in Litopenaeus vannamei

图2 KK-42对凡纳滨对虾肝胰腺组织蛋白酶L基因表达的诱导Fig.2 The time-course inducation of KK-42 on hepatopancreas cathep sin L mRNA expression in Litopenaeus vannamei
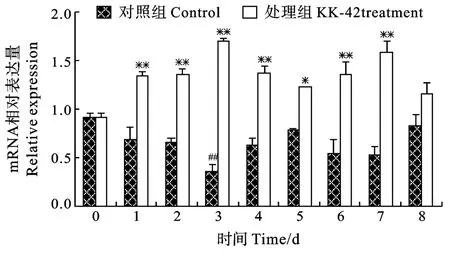
图3 KK-42对凡纳滨对虾肝胰腺血蓝蛋白基因表达的诱导Fig.3 The inducation of KK-42 on hepatopancreas hemocyanin mRNA expression in Litopenaeus vannamei
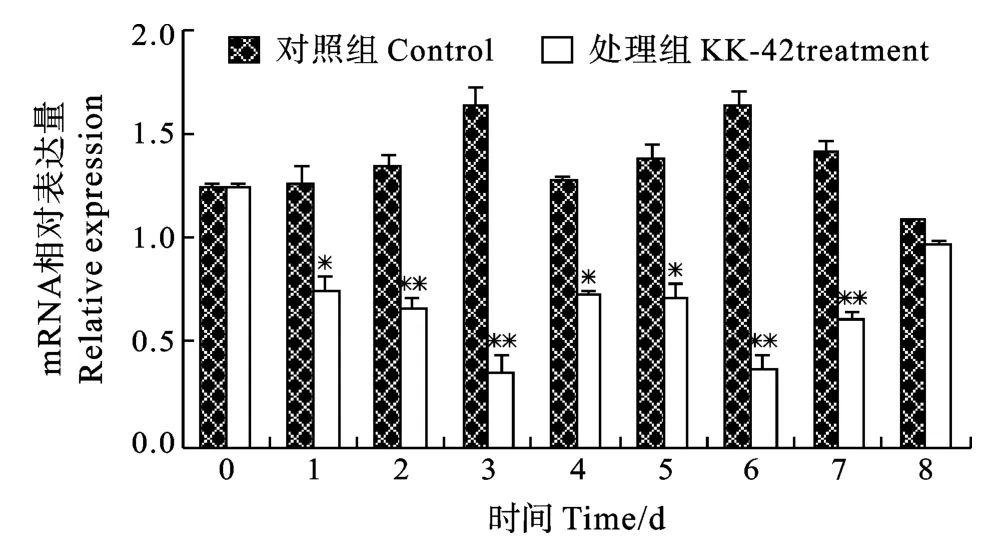
图4 KK-42对凡纳滨对虾肝胰腺α-淀粉酶基因表达的抑制Fig.4 The time-course inhibition of KK-42 on hepatopancreas α-amylase mRNA expression in Litopenaeus vannamei
2.3 KK-42对肝胰腺几丁质酶和N-乙酰基-β-D-葡萄糖苷酶表达的上调
在对照组中, 几丁质酶mRNA水平呈明显波动性变化(图6), 而N-乙酰基-β-D-葡萄糖苷酶基因表达水平与第0天比变化不大(图7)。KK-42处理后, 几丁质酶mRNA水平显著升高, 尤其在第1至第4天分别达到317.1%、627.0%、201.3%和474.3%(P<0.01)(图6); N-乙酰基-β-D-葡萄糖苷酶mRNA含量在第1至第6天升高135.5%以上(P<0.01), 之后与对照组相比无统计学意义上的变化(图7)。

图5 KK-42对凡纳滨对虾肝胰腺α-葡萄糖苷酶基因表达的下调Fig.5 The time-course down-regulation of KK-42 on hepatopancreas α-glucosidase mRNA expression in Litopenaeus vannamei
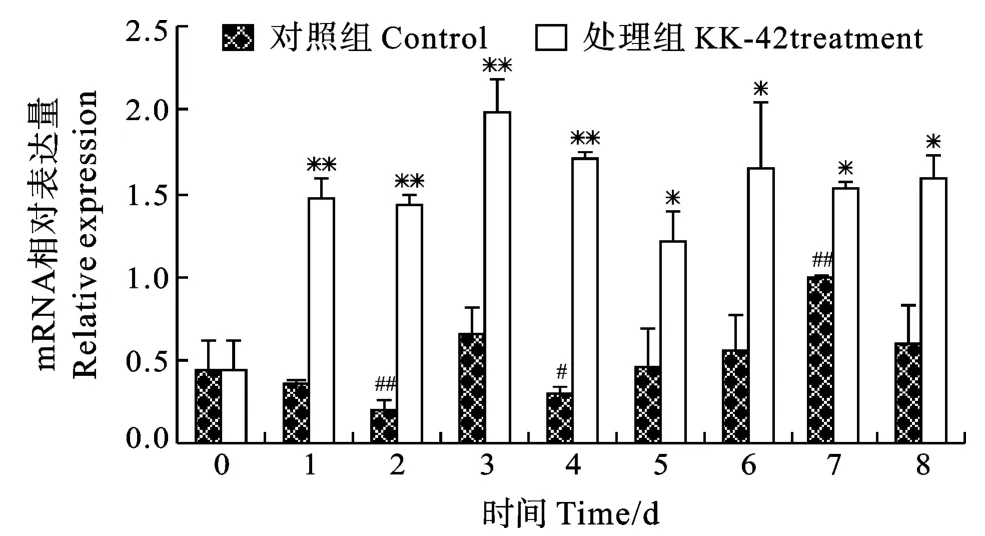
图6 KK-42对凡纳滨对虾肝胰腺几丁质酶基因表达的上调Fig.6 The up-regulation of KK-42 on hepatopancreas chitinase mRNA expression in Litopenaeus vannamei
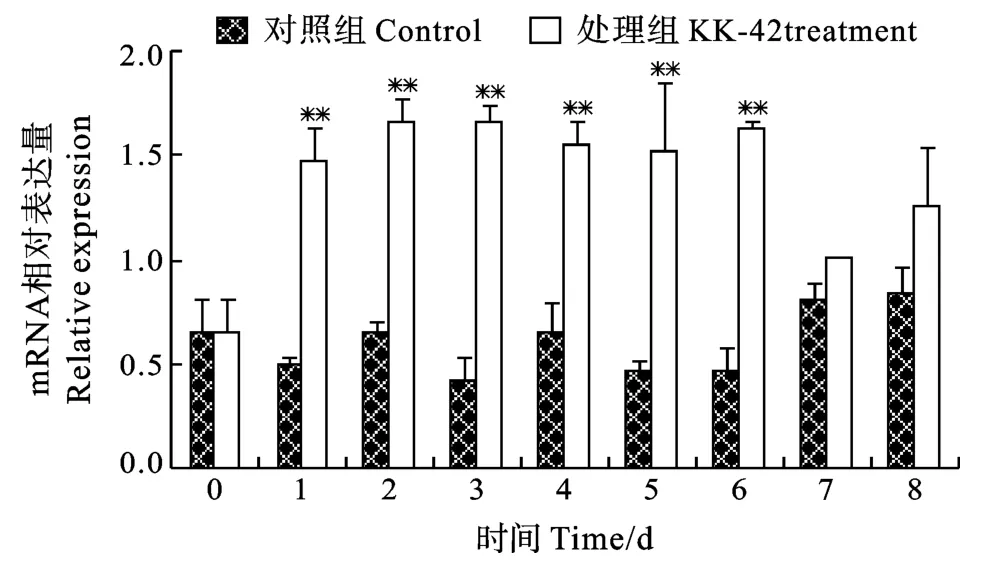
图7 KK-42对凡纳滨对虾肝胰腺N-乙酰基-β-D-葡萄糖苷酶基因表达的上调Fig.7 The up-regulation of KK-42 on hepatopancreas N-acetyl-β-D-glucosaminidase mRNA expression in Litopenaeus vannamei
3 讨论
充足的物质储备对启动甲壳动物蜕皮、促进其生长具有重要作用。我们推测, KK-42的作用机制可能包含在凡纳滨对虾幼虾物质储备的某些环节中, 据此本论文首先在转录水平上分析了与动物蜕皮、生长密切相关的几种酶的表达变化。
在8d的实验观察期间, 对照组胰蛋白酶的表达量相对稳定(图1), 表明凡纳滨对虾生长过程需要不断从食物中摄取蛋白, 进行分解、吸收和利用。对虾饵料组分中,粗蛋白的比例高达50%以上, 肝胰腺胰蛋白酶在食物消化过程中起重要作用[10], 与其较高的表达水平相一致。KK-42处理之后, 胰蛋白酶表达量显著升高(图1), 这应该有助于机体对蛋白质的消化和储备。研究发现, 在无食物可取的情况下, 凡纳滨对虾肝胰腺胰蛋白酶活性会下降40%—60%, mRNA水平降低30%, 动物蜕皮被推迟[11];蜕皮前胰蛋白酶mRNA水平和酶活性都显著提高, 加速物质储备并达到饱和点, 为蜕皮奠定物质基础[11,12]; 处理后第7至第8天, KK-42对胰蛋白酶的诱导效应逐渐减弱, 可能是机体对蛋白质的储备已达到饱和点。与对照组相比, 处理组肝胰腺组织蛋白酶L mRNA水平明显升高(图2), 这可能提高了动物对蛋白质的转化能力, 有助于动物的生长和蜕皮。据报道, 蜕皮前凡纳滨对虾肝胰腺组织蛋白酶L表达水平明显升高[13—15]; Chan,et al.采用RNAi技术沉默凡纳滨对虾甲基转移酶基因的表达, 可抑制动物蜕皮、甚至死亡, 组织蛋白酶L表达也相应降低[13]。KK-42能够显著上调肝胰腺血蓝蛋白基因的表达(图3), 这可能与动物取食增加、需氧量上升以及渗透压调控有关。研究发现, 在低氧环境中该蛋白水平降低, 相应地动物取食减少, 生长发育推迟[13]; 而在蜕皮前, 血蓝蛋白合成增加, Cu2+和Zn2+浓度随之增加, 导致动物体内渗透压升高, 随后吸水膨胀, 促使蜕皮[16—18]。
α-淀粉酶和α-葡萄糖苷酶主要是分解食物中的淀粉,形成D-葡萄糖, 参与维持动物正常的生理功能[19]。在对照组中, α-淀粉酶、α-葡萄糖苷酶的表达量较高, 但变化幅度不大(图4、图5), 提示凡纳滨对虾幼虾对淀粉类食物的利用相对稳定。在KK42处理后, 二者表达均受到不同程度的抑制, 这可能是动物加大了对蛋白质的利用, 从而减少了淀粉的摄入以及D-葡萄糖的消耗。如前所述, 在同样条件下, 胰蛋白酶、组织蛋白酶L和血蓝蛋白表达增加, 进一步反映了凡纳滨对虾幼虾在生长发育过程中对蛋白质和糖类的利用是不平行的[20]。研究表明, 如果动物对淀粉的分解过快, 会导致可溶性单糖水平过高, 可溶性单糖较之氨基酸更易于被动物吸收, 不利于蛋白质的利用和储备[19]。
已经证明, 昆虫、甲壳动物体内几丁质酶和N-乙酰-β-D-葡萄糖苷酶的转录受蜕皮激素的调控[21—23]。在相同的实验条件下, 我们发现在8d的实验期间, 凡纳滨对虾血淋巴20羟蜕皮酮滴度呈逐渐上升的趋势(结果未示),与这两种酶基因表达水平的变化不一致。蜕皮激素化学结构形式多样, 20羟蜕皮酮仅是其中的一种。我们推测不同动物的几丁质酶和N-乙酰-β-D-葡萄糖苷酶转录的调控可能以某种结构的蜕皮激素为主。KK-42处理可提高20羟蜕皮酮滴度(结果未示), 与KK-42对几丁质酶和N-乙酰-β-D-葡萄糖苷酶上调表达结果一致(图6、图7), 它们的上调表达, 有助于动物新表皮的合成, 为蜕皮提供物质储备, 与KK-42的促生长作用相一致。
[1] Dall W, Hill B J, Rothlisberg P C, et al.Moulting and Growth [M].In: Blaxter J H S Southward A J (Eds.), The Biology of the Penaeidae.Advances in Marine Biology, 1990, 213—250
[2] Phlippen M K, Webster S G, Chung J S, et al.Ecdysis of decapod crustaceans is associated with a dramatic release of crustacean cardioactive peptide into the haemolymph [J].Journal of Expermental Zoology, 2000, 203: 521—536
[3] Cuzon G, Rosas C, Gaxiola G, et al.Utilization of Carbohydrates by Shrimp [M].In: Cruz-Suarez L E, Ricque-Marie D, Tapia-Salazar M A, et al.(Eds.), Avances en Nutricion Acuicola V.Memorias del V Simposium de Nutricion Acufcola.19—22 Noviembre, 2000.Merida, Yucatan.2000, 328—339
[4] Anger K.The Biology of Decapod Crustacean Larvae [M].Lisse: Swets & Zeitlinger.2001, 420
[5] Arturo S P, Fernando G C, Adriana M A, et al.Usage of energy reserves in crustaceans during starvation: Status and future directions [J].Insect Biochemistry and Molecular Biology, 2006, 36: 241—249
[6] Asano S.Anti-juvenile hormone activity of imidazole Compound (KK-42) and its diminution by metroprene in the 4thinstar silkworm Bombyx mori [J].Applied Entomology and Zoology, 1986, 21: 63—69
[7] Wu J M, Wu Z D, Xu J L, et al.The effect of trimolter inducer KK-42 on the endocrine system in the silkworm Bombyx mori [J].Acta Entomologica Sinica, 1991, 34: 278—283
[8] Hirai M, Kamimura M, Kikuchi K, et al.cDNA cloning and characterization of Bombyx mori juvenile hormone esterase: an inducible gene by the imidazole insect growth regulator KK-42 [J].Insect Biochemistry and Molecular Biology, 2002, 32: 627—635
[9] Ning Q J, Fu S G, Xu X J, et al.A new and practical application of JH antagonist KK-42 to promoting growth of shrimp Penaeus schmitti [J].Aquaculture, 2007, 270, 422—426
[10] Kureshy N, Davis D A.Metabolic Requirements for Protein by Pacific White Shrimp, Litopenaeus vannamei [M].In: Cruz-Suarez L E, Ricque-Marie, D, Tapia-Salazar M A, et al.(Eds.), Avances en Nutricion Acufcola V.Memorias del V Simposium de Nutricion Acuicola.19—22 Noviembre, 2000.Merida, Yucatan.2000, 18: 161—180
[11] Juan S H, Julio C M.Activity of trypsin from Litopenaeus vannamei [J].Aquaculture, 2009, 290: 190—195
[12] Klein B, Le Moullac G, Sellos D, et al.Molecular cloning and sequencing of trypsin cDNAs from Penaeus vannamei (Crustacea, Decapoda): use in assessing gene expression during the molt cycle [J].Biochemistry and Cell Biology, 1996, 28: 551—563
[13] Hui H L, Tobe S S, Chan S M, et al.Characterization of the putative farnesoic acid O-methyltransferase (LvFAMeT) cDNA from white shrimp, Litopenaeus vannamei: Evidence for its role in molting [J].Peptides, 2008, 29: 252—260
[14] Le B C, Van W A, Sellos D, et al.Cloning and expression of cathepsin L-like proteinases in the hepatopancreas of the shrimp Penaeus vannamei during the intermolt cycle [J].Journal of Comparative Physiology, 1996, 166: 310—318
[15] Sara L, Jun Z, Jing L, et al.RNA interference targeting cathepsin L and Z-like cysteine proteases of Onchocerca volvulus confirmed their essential function during L3 molting [J].Molecular & Biochemical Parasitology, 2004, 138: 165—170
[16] Hea J M.The effects of hypoxia on hemocyanin regulation in Cancer magister: Possible role of Hypoxia-Inducible Factor-1 [J].Journal of Experimental Marine Biology and Ecology, 2010, 386: 77—85
[17] Engel D W, Brouwer M, Mercaldo A R, et al.Effects of molting and environmental factors on trace metal body-burdens and hemocyanin concentrations in the American lobster, Homarus americanus [J].Comparative Biochemistry and Physiology, 1999, 124: 345—349
[18] Sang G K, Byung W J, Ha H K, et al.Hemocyanin-derived phenoloxidase activity with broad temperature stability extending into the cold environment in hemocytes of the hair crab.Erimacrus isenbeckii [J].Comparative Biochemistry and Physiology, 2011, 24: 1325—1341
[19] Gerard C, Gabriela G, Toma G, et al.Factorial effects of salinity, dietary carbohydrate and moult cycle on digestive carbohydrases and hexokinases in Litopenaeus vannamei [J].Comparative Biochemistry and Physiology, 2005, 140: 29—39
[20] Douglas S E, Mandla S, Gallant J W, et al.Molecular analysis of the amylase gene and its expression during development in the winter flounder Pleuronectes americanus [J].Aquaculture, 2000, 190: 247—260
[21] Enmin Z, Milton F.Patterns of N-acetyl-β-glucosaminidase isoenzymes in the epidermis and hepatopancreas and induction of N-acetyl-β-glucosaminidase activity by 20-hydroxyecdysone in the fiddler crab, Uca pugilator [J].Journal of Experimental Marine Biology and Ecology, 2006, 339: 30—36
[22] Yan L M, Enmin Z.Impacts of molt-inhibiting organochlorine compounds on epidermal ecdysteroid signaling in the fiddler crab, Uca pugilator, in vitro [J].Comparative Biochemistry and Physiology, 2009, 150: 436—441
[23] Daizo K, Takushi F, Hidehiro F, et al.Effects of 20-hydroxyecdysone and KK-42 on chitinase and β-N-acetylglucosaminidase during the larval-pupal transformation of Bombyx mori [J].Insect Biochemistry, 1991, 21(3): 277—284
THE EFFECT OF KK-42 ON THE EXPRESSION OF NUTRITIONAL STORAGE-ASSOCIATED ENZYMES IN THE SHRIMP LITOPENAEUS VANNAMEI
XIA Xi-Chao1,2, YANG Hong1, NING Qian-Ji1, LÜ Li1and LÜ Yan-Jie1
(1.College of Life Sciences, Henan Normal University, Xinxiang 453002, China; 2.Basic Medical College, Nanyang Medical University, Nanyang 473061, China)
KK-42; 凡纳滨对虾; 物质储备相关酶; 基因表达
KK-42;Litopenaeus vannamei; Nutritional storage-associated enzymes; Gene expression
Q459
A
1000-3207(2013)02-0388-05
10.7541/2013.32
2011-09-22;
2012-12-17
国家自然科学基金项目(30940008); 高等学校博士学科点专项科研基金(20094104110003); 河南省高校科技创新人才支持计划(2009HASTIT022)资助
夏西超(1977—), 男, 河南南阳人; 博士; 主要从事甲壳动物激素调控研究。E-mail: xiaxichao8336@163.388om
宁黔冀, Tel: 0373-3326340; E-mail: ningqianji1964@163.com
