饲料蛋白质水平与投喂频率对大黄鱼生长、体组成及蛋白质代谢的影响
2013-11-05孙瑞健张文兵麦康森
孙瑞健 张文兵 徐 玮 麦康森
(中国海洋大学水产学院, 农业部水产动物营养与饲料重点实验室,海水养殖教育部重点实验室, 青岛 266003)
投喂频率是水产养殖管理中重要的一环。研究表明, 适宜的投喂频率可以提高鱼类的生长速度,降低饲料的损失, 从而提高饲料转化率, 进而提高养殖经济效益[1,2]。在人工饲养条件下, 不合理的投喂频率往往导致鱼类生长速度下降, 规格分化严重[3]。因此, 确定合理的投喂频率对研究鱼类摄食和生长有着重要的意义。
蛋白质作为鱼类配合饲料中最重要的营养物质,不仅能够提供鱼体合成蛋白质的氨基酸, 还能提供鱼体生长代谢所需的能量等[4]。饲料中合适的蛋白质水平可以促进鱼类生长, 特别是对于肉食性鱼类,需要更高的蛋白质水平来维持生长[5]。饲料中较低的蛋白质含量会导致鱼体生长减缓甚至停滞; 而过高的蛋白质含量也会导致多余的蛋白质以氨氮等形式排到水环境中, 不但造成了以昂贵的方式提供能量, 还对养殖环境造成污染[6—10]。
大黄鱼(Pseudosciaena crocea R.)属鲈形目、石首鱼科、黄鱼属, 俗称黄鱼、大黄花, 属近海暖温、集群洄游性鱼类, 是我国主要的海水养殖名贵经济鱼类。目前在大黄鱼的养殖实践中, 大多还是依靠投喂冰鲜杂鱼, 配合饲料的普及率不高[11]。而冰鲜杂鱼质量参差不齐, 并且自身携带病原体, 容易引发鱼体疾病, 再加上海洋中杂鱼数量的锐减, 高效环保的大黄鱼配合饲料的研发和普及将成为必然。目前大黄鱼配合饲料中的蛋白质适宜需要量仅有Duan, et al.[12]的报道, 0.57 g的大黄鱼所需饲料蛋白水平在47%以上。此外, 在大黄鱼的养殖过程中, 养殖户一般采用2次/d的饱食投喂以获得最大的生长速度和产量。但在高温季节, 普遍选择 1次/d的投喂方式以降低疾病风险。另外, 配合饲料和人力成本的不断增加, 也迫使养殖户更多地采用 1次/d的低频率投喂模式, 以降低养殖成本。Li, et al.[13]研究证实, 以1次/d投喂时, 24%、28%、32%、36%蛋白质饲料对鲶鱼生长的影响不显著; 而以1次/2d投喂时, 高蛋白质组鲶鱼生长明显高于 24%蛋白质组,这表明在不同投喂频率下, 鱼体所需要的饲料蛋白质水平可能会发生变化。在低投喂频率下(1次/d),大黄鱼饲料的蛋白质水平是否应该相应的调整, 目前尚未见相关报道。因此, 本文旨在通过研究饲料蛋白质水平与投喂频率之间的交互作用对大黄鱼幼鱼生长、体组成及蛋白质代谢的影响, 以确定不同投喂频率下大黄鱼饲料的合适蛋白质水平, 寻找一种高效可行的大黄鱼投喂策略和饲料配方。
1 材料与方法
1.1 实验饲料
以鱼粉和豆粕为主要蛋白源, 鱼油和卵磷脂为主要脂肪源, 小麦粉为主要糖源, 配制成蛋白质水平分别为 40%、45%和 50%的 3种等脂饲料, 试验配方及成分分析值(表1)。
在饲料制作过程中, 所有原料粉碎后过320 µm筛网, 各原料混合均匀, 然后加入适量的水揉匀,经 F(II)-26 型双螺杆挤条机(华南理工大学, 广州)加工制成硬颗粒饲料(2.5 mm×3.0 mm) , 55℃烘饲料水分至10%以下, 用塑料袋包装, 保存于−15℃备用。

表1 实验饲料配方及营养组成(%干物质)Tab. 1 Formulation and proximate composition of experimental diets (% dry matter)
1.2 实验设计和养殖管理
采用 3×2双因素实验设计, 实验饲料采用上述1.1中配制的3种蛋白质梯度的配合饲料, 投喂频率设定为2次/d(5: 00, 17: 00)和1次/d(5: 00), 每个处理设置3个重复。
实验于浙江省宁波市象山县西沪港进行。正式实验前, 大黄鱼放于海水网箱(3.0 m×3.0 m×3.0 m)中暂养, 并以商业饲料饱食投喂, 使之逐渐适应配合饲料。暂养2周后, 对实验鱼饥饿24h, 挑选出体格健壮、规格一致的大黄鱼幼鱼随机分组。实验在近海浮式海水网箱进行, 网箱规格为1 m×1 m×1.5 m。实验鱼初重(13.64±0.18) g, 每网箱放养50尾。整个实验周期均采用饱食投喂。实验期间海水水温为26.5—30.5℃, 盐度为 29‰—33‰, 溶解氧含量在7 mg/L以上。
1.3 样品收集与分析
8周生长实验结束后, 实验鱼饥饿24h后, 以丁香酚(1∶10000)麻醉, 然后计数, 并称重。每处理组取 6尾鱼, 称重后以无菌注射器自尾静脉取血; 然后量体长, 计算肥满度; 解剖得到肝脏和内脏, 分别称重, 用于计算肝脏指数和内脏指数。另取 5尾鱼置于−20℃冰箱中保存, 用于常规成分分析。
饲料原料、饲料和鱼体常规成分测定采用AOAC(1993)的方法。水分测定在105℃烘箱中烘至恒重, 粗蛋白质采用半微量凯氏定氮法(总氮×6.25),粗脂肪采用索氏抽提法(乙醚为溶剂), 灰分是在马福炉中(550℃)灼烧12h后测定。
血清和肝脏中的谷草转氨酶(AST)、谷丙转氨酶(ALT)均采用南京建成生物工程研究所试剂盒测定,组织匀浆液中蛋白质浓度测定采用考马斯亮蓝染色法。
1.4 计算及统计方法


其中, Wt、W0分别为实验大黄鱼的终末体重和初始体重, WL, WV分别为肝脏湿重, 内脏湿重; t为实验天数; N0和Nt分别为实验开始和结束时网箱中鱼的尾数; Dd是摄食干重(g); L是鱼的体长(cm)。
采用 SPSS17.0对所得数据进行双因素方差分析(Two-way ANOVA), 当差异显著时(P<0.05), 采用 Tukey检验进行多重比较; 当两个因素有交互作用时, 则固定一个因素, 对另一个因素进行 Tukey多重比较。
2 结果
2.1 饲料蛋白质水平和投喂频率对大黄鱼生长和饲料转化率的影响
如表 2所示, 经过 8 周的生长试验, 饲料蛋白质水平和投喂频率对大黄鱼幼鱼的存活率(90.00%—94.00%之间)影响不显著(P>0.05), 但均显著影响大黄鱼的增重率(WGR)、特定生长率(SGR)和饲料转化率(FCR)(P<0.05); 饲料蛋白质水平和投喂频率对大黄鱼WGR、SGR、FCR的交互作用显著(P<0.05)。
如图1所示, 在40%和45%蛋白质组, 2次/d投喂组的大黄鱼幼鱼 SGR显著高于 1次/d投喂组(P<0.05), 而在50%蛋白质组, 2次/d投喂组的SGR与1次/d投喂组的差异不显著(P>0.05)。在每个饲料蛋白质水平下, 2次/d投喂组的 FCR均显著高于 1次/d投喂组(P<0.05)。在2次/d投喂组, 随着饲料蛋白质水平的提高, SGR呈现先升高又下降的趋势,45%蛋白质组 SGR显著高于 40%(P<0.05), 但二者均与 50%蛋白质组的差异不显著性(P>0.05)。而 1次/d投喂时, SGR随着饲料蛋白质水平的提高而显著增加(P<0.05), 在50%蛋白质组达到最大值, 并显著高于40%和 45%蛋白质组(P<0.05)。在 2次/d投喂组, 饲料蛋白质水平对 FCR的影响不显著(P>0.05), 而在1次/d投喂组, 50%蛋白质组FCR显著高于 40%蛋白质组(P<0.05), 但与 45%蛋白质组的差异不显著(P>0.05)。
2.2 饲料蛋白质水平和投喂频率对大黄鱼体组成的影响
表 3显示, 饲料蛋白质水平和投喂频率对大黄鱼的灰分含量的影响均不显著(P>0.05)。投喂频率对大黄鱼鱼体的水分、粗脂肪含量的影响显著(P<0.05), 而对鱼体粗蛋白质含量的影响不显著(P>0.05)。2 次/d投喂组大黄鱼鱼体水分含量显著低于而粗脂肪含量显著高于 1次/d投喂组(P<0.05)。饲料蛋白质水平对大黄鱼鱼体水分、粗蛋白质及粗脂肪含量的影响均显著(P<0.05)。饲料蛋白质水平和投喂频率对大黄鱼体成分无交互作用。在2次/d和1次/d投喂组,随着饲料蛋白质水平的提高, 粗蛋白质含量和水分含量均呈现上升趋势, 且 50%蛋白质组均显著高于 40%蛋白质组(P<0.05), 但与45%蛋白质组的差异不显著(P>0.05), 而水分含量在各个蛋白质水平组的差异均不显著(P>0.05)。随着饲料蛋白质水平的提高, 粗脂肪均呈现下降趋势,50%蛋白质组鱼体粗脂肪含量均显著低于 40%蛋白质组(P<0.05), 但与 45%蛋白质组的差异不显著(P>0.05)。

表2 饲料蛋白质水平和投喂频率对大黄鱼幼鱼增重率、特定生长率、饲料转化率和存活率的影响Tab. 2 Weight gain rate (WGR), specific growth rate (SGR), feed conversion ratio (FCR) and survival of juvenile large yellow croakers fed with the experimental diets with different dietary protein levels and feeding frequencies
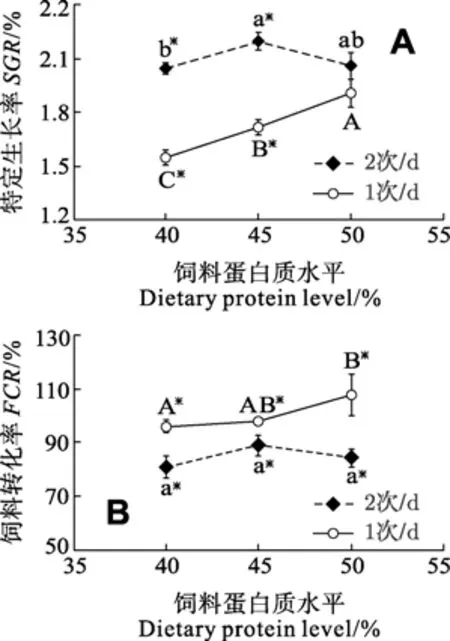
图1 饲料蛋白质水平和投喂频率对大黄鱼特定生长率(SGR)和饲料转化率(FCR)的影响Fig. 1 Effects of dietary protein level and feeding frequency on the specific growth rate (SGR) and feed conversion ratio (FCR) of juvenile large yellow croaker
2.3 饲料蛋白质水平和投喂频率对大黄鱼肝脏指数、内脏指数及肥满度的影响
由表 4可以得出, 投喂频率对大黄鱼肥满度(CF)的影响显著(P<0.05), 但对肝脏指数(HSI)、内脏指数(VSI)的影响均不显著(P>0.05)。饲料蛋白质水平对大黄鱼CF、HSI、VSI的影响均不显著(P>0.05)。饲料蛋白质水平和投喂频率对大黄鱼CF、HSI、VSI交互作用均不显著(P>0.05)。
2.4 饲料蛋白质水平和投喂频率对大黄鱼血清和肝脏中谷丙转氨酶及谷草转氨酶活力的影响
由表 5可知, 饲料蛋白质水平和投喂频率对大黄鱼血清中的谷丙转氨酶(ALT)和谷草转氨酶(AST)活力的影响不显著(P>0.05), 两者也无交互作用。饲料蛋白质水平显著影响大黄鱼肝脏ALT和AST的活性(P<0.05), 在 2次/d投喂组, 50%蛋白质组的ALT和AST均显著高于40%蛋白质组(P<0.05), 45%蛋白质组 ALT显著高于 40%蛋白质组(P<0.05), 而45%蛋白质组 AST与 40%蛋白质组的产业不显著(P>0.05)。在1次/d投喂组, 随着饲料蛋白质水平的提高, 肝脏 ALT和 AST活性均显著增加(P<0.05),
50%蛋白质组的 ALT和 AST活性均显著高于 40%蛋白质组(P<0.05)。投喂频率对肝脏ALT和AST活性的影响不显著, 饲料蛋白质水平和投喂频率对大黄鱼血清中的ALT、AST无交互作用(P>0.05)。

表3 饲料蛋白质水平和投喂频率对大黄鱼幼鱼体成分的影响Tab. 3 Body composition of juvenile large yellow croakers fed with the experimental diets with different dietary protein levels and feeding frequencies

表4 饲料蛋白质水平和投喂频率对大黄鱼肝脏指数(HSI)、内脏指数(VSI)和肥满度(CF)的影响Tab. 4 Hepatosomatic (HSI), viscerosomatic (VSI) index and condition factor (CF) of juvenile large yellow croakes fed with the experimental diets with different dietary protein levels and feeding frequencies

表5 饲料蛋白质水平和投喂频率对大黄鱼幼鱼血清、肝脏中谷丙转氨酶(ALT)和谷草转氨酶(AST)活力的影响Tab. 5 Activities of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in serum and liver of juvenile large yellow croakers fed with the experimental diets with different dietary protein levels and feeding frequencies
3 讨论
有研究指出[14,15], 投喂频率的适当提高, 可以使鱼类摄食量增加, 从而达到提高生长速度的效果。在本研究中, 投喂频率对大黄鱼幼鱼增重率、特定生长率和饲料转化率均有显著影响。除50%蛋白质组外, 2次/d投喂组大黄鱼的特定生长率均显著高于 1次/d投喂组, 但是饲料转化率均显著低于 1次/d投喂组。巨石斑鱼(Epinephlus tauvina)[16]、虹鳟(Salmo gairdnerii)[17]、大吻鲈(Dicentrarchus labrax)[18]等的研究均表明饲料转化率随投喂频率的增加而下降, 并认为消化机能减弱, 活动耗能增多可能是饲料转化率下降的主要原因。Liu和 Liao[19]推测在高投喂频率时, 由于两次投喂间隔缩短, 使得食物更快地通过消化道部分, 从而导致消化能力降低。
在本研究中, 在 2次/d投喂组, 蛋白质水平对饲料转化率影响不显著, 但 45%蛋白质组的特定生长率显著高于 40%蛋白质组, 与 50%蛋白质组影响不显著。这说明在本实验条件下, 2次/d投喂时饲料中添加 45%的蛋白质已经满足了大黄鱼的最大生长,添加过高的蛋白质(50%)并未对其生长产生更好的促进作用。许多研究表明, 当鱼体摄入过高的饲料蛋白质后, 过量的蛋白质会通过脱氨基作用, 造成本来用于生长的能量的降低, 由于饲料中的蛋白质用于代谢鱼体吸收的过量氨基酸而导致鱼体生长保持不变甚至下降[20]。而在1次/d投喂时, 50%蛋白质组大黄鱼幼鱼的特定生长率显著高于40%和45%蛋白质组, 50%蛋白质组饲料转化率显著高于 40%蛋白质组。由此得出, 在低投喂频率投喂时, 为达到大黄鱼幼鱼最大的生长速度和饲料转化率, 饲料蛋白质含量应该适当提高至 50%。由此推断, 大黄鱼在不同的投喂频率下, 对饲料中的蛋白质代谢利用效率有所不同, 满足鱼体最快生长所需最适饲料蛋白质含量不同, 这与Li和Lovell[21], Li[12]的研究结果一致。
在本研究中随着投喂频率的增加, 大黄鱼水分含量降低而粗脂肪含量提高, 这与在黑鲷(Sparus macrocephalus)[22]、极地嘉鱼(Salvelinus alpinus)[22]和褐鳟(Salmo trutta)[24]中的研究结果一致。养殖鱼类的体成分由内源因子和外源因子共同决定, 鱼体蛋白质和灰分含量大部分与鱼类的生长阶段(内源)有关, 而体脂肪含量主要依靠外源因子, 比如饲料组成、投喂模式等[25]。普遍的观点认为, 投喂频率的增加, 使鱼类提高了饲料的摄入量, 过量的部分会转化为脂肪而蓄积, 从而导致鱼体脂肪水平上升,鱼体水分含量下降[26]。已有的研究表明, 随着饲料中蛋白质水平的升高, 鱼体蛋白质和水分含量会逐渐升高, 而体脂肪含量会逐渐降低[27—29]。本研究结果与之相一致, 在两种投喂频率下, 随着饲料蛋白质水平的提高, 大黄鱼幼鱼体蛋白质含量均增加,而脂肪含量均有下降趋势。然而另外一些研究者发现, 随着饲料中蛋白质水平的提高, 鱼体蛋白质水平并没有太大的变化[30,31]。这些结果的差异可能受到鱼种类、规格、饲料或者环境等的影响[25]。
在鱼类上, 肝脏被视为脂肪和糖原沉积的主要场所[32], 肝脏指数和内脏指数一般作为肝脏或者内脏中脂肪或者糖原蓄积的表观指标。在本研究中,饲料蛋白质水平的变化对大黄鱼肝脏指数和内脏指数的影响不显著。这表明, 不同的饲料蛋白质水平对大黄鱼肝脏和内脏质量影响不大, 这与乌颊鱼(Sparus aurata)[9]和银无须(Puntius gonionotus)[28]上的研究一致。在本研究中, 虽然投喂频率显著影响了大黄鱼鱼体粗脂肪含量, 但未对大黄鱼肝脏指数和内脏指数造成显著影响, 推测可能是高投喂频率组脂肪含量的增加量不足以引起脂肪在肝脏或者内脏的沉积。肥满度是一个衡量鱼体能量储备水平的粗略指标, 肥满度的变化可能预示着鱼体营养状态的改变。在本研究中, 饲料蛋白质水平未对大黄鱼肥满度产生显著影响, 类似结果在银无须(Puntius gonionotus)[28]等鱼类上有发现; 而2次/d投喂组的肥满度显著高于1次/d投喂组。这与Barakat,et al.[33]的研究结果一致。这可能是由于在高投喂频率下, 大黄鱼幼鱼可以摄入更多的饲料, 过量的部分会转化为脂肪而蓄积, 使得鱼体的能量储备水平更高些, 表现为肥满度更大。
ALT和 AST是动物体内氨基酸代谢中重要的酶类, 在正常情况下血清中的转氨酶活性较低, 当动物体受到各种营养不良或者胁迫作用, 尤其是肝脏受损时, 往往导致血清中ALT和AST含量升高[34,35]。在本研究中血清AST和ALT并未受到投喂频率和蛋白质水平的显著影响, 表明各处理组鱼健康状况良好。ALT和AST主要是在肝脏组织中负责将特定氨基酸的一个氨基转移到另外一个氨基酸上, 进行氨基酸的代谢。饲料中蛋白质水平或者蛋白质/碳水化合物比例的升高往往导致肝脏转氨酶水平升高[36],说明饲料中过量的氨基酸导致氨基酸分解增加, 从而作为葡萄糖异生作用的底物而转化为能量[37]。在本实验中, 随着饲料蛋白质水平的提高, 肝脏中ALT和AST含量均有上升趋势, 在两种投喂模式下,50%蛋白质组的ALT、AST均显著高于40%蛋白质组。这表明, 饲料中蛋白质水平的提高, 肝脏的氨基酸代谢活动有所增强, 机体可以适应饲料的不同蛋白质水平。这与Melo[38]和Ballantyne, et al.[39]的研究结果一致。
综上所述, 大黄鱼的饲料蛋白质水平应随着投喂频率的变化而做出适当调整。考虑到饲料成本和养殖效益, 在 2次/d投喂时, 建议使用蛋白质含量45%左右的饲料; 而在1次/d投喂时, 推荐使用50%蛋白质左右的饲料。在本实验条件下, 尽管在1次/d投喂时, 大黄鱼有更高的饲料转化率, 但是会导致更低的净产量并延缓大黄鱼上市时间, 养殖户可以根据实际情况, 在短期(低于 8周)内采用 50%左右蛋白质含量的配合饲料。
