PDGF调控子宫内膜异位症在位内膜间质细胞中cofilin-1基因的表达及意义
2013-04-18穆庆许艳丽陈鹏王丹波
穆庆,许艳丽,陈鹏,王丹波
(中国医科大学附属盛京医院,辽宁沈阳 110004)
子宫内膜异位症(内异症)是妇科常见病及难治病,其发病机制研究一直是妇科的临床研究热点之一。近年来,“在位内膜决定论”受到关注,即内异症患者在位子宫内膜的基因异常是内异症发生的重要原因,但在位内膜的特异性靶基因尚未揭晓。本课题组前期研究发现,cofilin-1基因(CFL1)是内异症在位内膜差异表达基因之一[1],并证明在位内膜CFL1高表达,促进异位内膜细胞黏附、增殖及新血管生成,发生内异症[2-3],但其作用机制尚待进一步证明。血小板源性生长因子(platelet derived growth factor,PDGF)已被证实在内异症在位内膜的增殖中起重要作用,本研究将探讨CFL1与PDGF在内异症中的调控关系。
1 材料与方法
1.1 组织收集和细胞培养
选择中国医科大学附属盛京医院高期别卵巢内异症行子宫全切术患者12例(37~49岁),样本采集经中国医科大学伦理委员会批准并获得患者的知情同意。所有患者在术前6个月未接受GnRH类药物、激素类药物及抗炎药物治疗。根据既往月经周期及组织学检查确定为分泌期标本。术中即时获得在位子宫内膜组织处理及ESC培养方法与既往相关研究[2]相同。经单层培养的ESC在第3代起可以达到99%的纯度,第3代细胞将用于后续试验。
1.2 PDGF 实验
单层培养的ESC在第2代铺满培养瓶底后传代为第3代按6孔板每孔105个细胞数接种,培养48 h后,培养液换成无血清的DMEM/F12孵育24 h。在12例 ESC 细胞中加入10 ng·ml-1PDGF(R&D Systems,Minneapolis,MN,USA)分别作用 3、6、12 h。另外,在12 例 ESC 细胞中分别加入 1.0、10、100 ng·ml-1的PDGF作用6 h,以PBS代替PDGF作为0浓度组。
1.3 实时荧光定量PCR
使用 Trizol试剂(TaKaRa,Otsu,Shiga,Japan)从来自于各组相同数量的细胞中提取RNA,按试剂盒说明书要求的标准无酶操作进行。按SYBR®PrimeScriptTMRT-PCR 试剂盒 (TaKaRa,Otsu,Shiga,Japan)的逆转录说明书要求进行逆转录。CFL1引物序列为:5'-TGCCTGAGTGAGGACAAG-3'(正义链),5'-GACAAAGGTGGCGTAGGG-3'(反义链)。内参照磷酸甘油醛脱氢酶(GAPDH),引物序列为:5'-GCACCG TCAAGGCTGAGAAC-3'(正义链),5'-ATGGTGGTGAA GACCCAGT-3'(反义链)。在 LightCycler Real Time PCR扩增仪(ABI公司)上按照SYBR®PrimeScriptTMRT-PCR试剂盒(TaKaRa公司)的使用说明书进行PCR反应。PCR循环参数为:95℃ 15 s,60℃ 1 min,共45 个循环。CFL1 mRNA 水平以2-△△CT[4]方法计算,同时为保证mRNA水平不受细胞数量影响,反转录按照20 μl体系进行,总RNA定量为1 000 ng,并且所有标本均同一批次反转录。
1.4 统计学处理
2 结 果
镜下观察PDGF处理前后ESC形态学无明显改变。10 ng·ml-1PDGF 分别作用 ESC 0、3、6、12 h,ESC中CFL1 mRNA的水平随着刺激时间的延长显著上调,各组CFL1 mRNA表达相对水平分别为1.09±0.13、1.61±0.24、2.31±0.30和 3.61±0.60,与 0 h组比较,6 h和12 h组表达增高有统计学意义(P<0.05)。见图1。
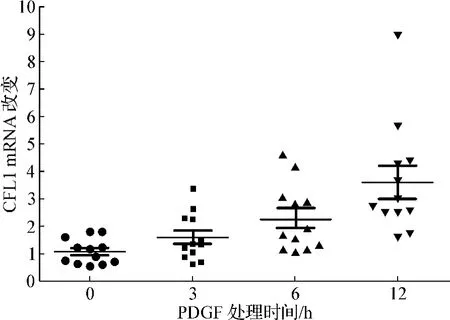
图1 PDGF处理后ESC时间依赖性CFL1 mRNA表达Fig 1 CFL1 mRNA expression of ESC treated with PDGF in a time-dependent manner
以1、10、100 ng·ml-1PDGF 分别作用 ESC 6 h 与未进行PDGF处理(PBS代替PDGF)的ESC比较,随着处理剂量的增加CFL1 mRNA的水平也显著上调,各组CFL1 mRNA表达相对水平分别为1.78±0.36、2.43±0.41和3.87±0.84,与未处理组(1.09±0.13)相比较,差异均有统计学意义(P<0.05)。见图2。
3 讨 论
子宫内膜异位症的发生与异位内膜细胞较强的黏附、增殖及新血管生成等生物学功能密切相关。“在位内膜决定论”是近年来子宫内膜异位症发生机制的热点理论[5],已证实内异症患者在位内膜细胞黏附、增殖及新血管生成的相关细胞因子表达异常,其中PDGF是重要候选基因之一。PDGF是活化的巨噬细胞的特征性分泌产物,是成纤维细胞和血管形成前体细胞有效的促有丝分裂剂[6-7]。PDGF对多种肿瘤细胞增殖血管形成有重要作用[8-9],同时内异症在位内膜间质细胞增殖也呈现了明显的剂量依赖性。此外,PDGF是内异症异位病变血管形成过程的关键部分[10]。因此,PDGF可能是与内异症发病机制相关的关键因素。

图2 PDGF处理后ESC浓度依赖性CFL1 mRNA表达Fig 2 CFL1 mRNA expression of ESC treated with PDGF in dose-depentdent manner
CFL1是普遍表达的细胞骨架蛋白,属于肌动蛋白解聚因子家族,在促进肌动蛋白解聚/聚合过程和肌动蛋白片段的迅速转换中具有重要角色[11]。肌动蛋白细胞骨架的重组对肿瘤进展、细胞动力、细胞黏附、细胞侵袭和血管形成均十分关键[12]。CFL1的基本功能与内异症的生物学特点高度一致,同时本研究组前期对内异症在位内膜上调基因筛查发现,CFL1是在位内膜上调候选基因之一[1],经过全面验证,CFL1过度表达在内异症在位内膜细胞的黏附、增殖及血管生成中起重要作用[2-3]。因此,CFL1在内异症中的作用机制研究成为本课题组进一步研究重点,而PDGF与CFL1的调控关系值得关注。本实验结果显示,ESC中CFL1 mRNA的表达随着PDGF作用时间延长而增加,随PDGF浓度增高而增加。因此,PDGF可能是CFL1表达的强诱导剂,PDGF对于内异症发生、发展的影响可能与CFL1相关。肌动蛋白动力学与细胞增殖直接相关[13],并且增殖起源于肌动蛋白的重组[14],CFL1 正是肌动蛋白解聚因子家族成员,因此CFL1直接促进细胞的增殖。研究显示,PDGF介导的细胞增殖与RhoA-ROCK信号途径相关[15]。CFL1是RhoA-ROCK信号途径的下游信号分子。可以推测,PDGF对于内异症在位内膜细胞增殖调控可能通过RhoA-ROCK信号途径对CFL1的调控实现。CFL1表达的改变可能对PDGF诱导的ESC增殖十分必要,具体机制有待进一步研究。Hu等[16]研究发现,PDGF激活PI3K通路可促进肌动蛋白重组,定向细胞运动,刺激细胞生长,并抑制细胞凋亡。研究发现,猪肾小管上皮细胞[17]中PI3K通路的激活可以使SSH1活化,进一步通过使CFL1去磷酸化而具有活性。因此,进一步研究子宫内异症患者PDGF调控CFL1的具体信号通路,有助于通过阻断某一通路,达到靶基因治疗内异症的目的。
总之,本实验结果提示,在内异症在位内膜间质细胞中,PDGF可能是CFL1基因表达的强诱导剂,而且与作用时间、浓度均有关系,但具体通路有待进一步验证。
[1]CHEN Q,ZHANG C Y,CHEN Y H,et al.Identification of endometriosis-related genes by representational difference analysis of c DNA [J].Aust N Z J Obstet Gynaecol,2012,52(2):140-145.
[2]XU Y L,WANG D B,LIU Q F,et al.Silencing of cofilin-1 gene attenuates biological behaviors of stromal cells in eutopic endometriawith endometriosis[J].Human Reproduction,2010,25(10):2480-2488.
[3]许艳丽,王丹波.子宫内膜异位症患者在位内膜中cofilin-1蛋白表达水平与其种植能力的关系[J].中华妇产科杂志,2010,45(4):252-255.
[4]BURGER H,FOEKENS J A,LOOK M P,et al.RNA expression of breast cancer resistan ce protein,lung resistan ce-related protein,multidrug resistan ce-associated proteins 1 and 2,and multidrug resistan ce gene 1 in breast cancer:correlation with chemotherapeutic response[J].Clin Cancer Res,2003,9(2):827-836.
[5]郎景和.子宫内膜异位症研究的新里程[J].中华妇产科杂志,2005,40(1):3-4.
[6]ROSS R,RAINES E W,BOWEN-POPE D F.The biology of platelet-derived growth factor[J].Cell,1986,46:155.
[7]徐惠,官阳,杨木兰,等.PDGF及PDGFR在大鼠肾间质纤维化过程中的作用[J].中国现代医学杂志,2007,17(19):2354-2358.
[8]李俊生,汤文浩.PDGF受体酪氨酸激酶抑制剂在胰腺癌中是否有作用?[J].东南大学学报:医学版,2006,25(2):77-82.
[9]沈令广,黄庆功,李俭银,等.血小板源性生长因子B在非小细胞肺癌中的表达及其与微血管密度的关系[J].中国现代医学杂志,2011,21(16):1841-1844.
[10]LASCHKE M W,ELITZSCH A,VOLLMAR B,et al.Combined inhibition ofvascular endothelialgrowth factor(VEGF),fibroblast growth factor and platelet-derived growth factor,but not inhibition of VEGF alone,effectively suppresses angiogenesis and vessel maturation in endometriotic lesions[J].Human Reproduction,2006,21(1):262-268.
[11]CHEN H,BERNSTEIN B W,BAMBURG J R.Regulating actin-filament dynamics in vivo[J].Trends Biochem Sci,2000,25(1):19-23.
[12]HOTULAINEN P,PAUNOLA E,VARTIAINEN M K,et al.Actin-depolymerizing factor and cofilin-1 play overlapping roles in promoting rapid F-actin depolymerization in ma mmalian no nmuscle cells[J].Mol Biol Cell,2005,16(2):649-664.
[13]dos REMEDIOS C G,CHHABRA D,KEKIC M,et al.Actin binding proteins:Regulation of cytoskeletal microfilaments[J].Physiol Rev,2003,83(2):433-473.
[14]SUBRAMANIAM V,INCENT I R,OTHY S.Upregulation and ephosphorylation of cofilin:modulation by CD44 variant soform in human colon cancer cells [J].Exp Mol Pathol,2005,79(3):187-193.
[15]ZOHRABIAN V M,FORZANI B,CHAU Z,et al.Rho/ROCK and MAPK Signaling Pathways Are Involved in Glioblastoma Cell Migration and Proliferation[J].Anticancer Res,2009,29(1):119-124.
[16]HU Q,KLIPPEL A,MUSLIN A J,et al.Ras-dependent induction of cellular responses by constitutively active phosphatidylinositol-3 kinase[J].Science,1995,268(5207):100-102.
[17] ISHIBASHI F.High glucos e increases phosphocofilin via phosphorylation of LIM kinase due to Rho/Rho kinase activation in cultured pig proximal tubular epithelial cells[J].Diabetes Res Clin Pract,2008,80(1):24-33.
