初发系统性红斑狼疮患者调节性T细胞和Th17细胞的检测及意义
2013-04-18马纪林刘小贤汪卫郑红霞蔡龙施华萍周红娟于健宁
马纪林 刘小贤 汪卫 郑红霞 蔡龙 施华萍 周红娟 于健宁
●论 著
初发系统性红斑狼疮患者调节性T细胞和Th17细胞的检测及意义
马纪林 刘小贤 汪卫 郑红霞 蔡龙 施华萍 周红娟 于健宁
目的 观察初发系统性红斑狼疮(SLE)患者外周血调节性T细胞(Treg)和Th17细胞的变化,探讨其临床意义。方法 检测15例初发SLE患者(活动组11例,非活动组5例)及10例健康对照者(对照组)的外周血CD4+CD25highTreg、Th17细胞占CD4+的比例,分析两种细胞的比率与疾病活动指数(SLEDAI)的相关性。结果 初发SLE患者外周血CD4+CD25highTreg和Th17细胞的比例与对照组相比,差异无统计学意义(P>0.05),与SLEDAI无相关性(均P>0.05)。CD4+CD25highT细胞与Th17细胞的比率在活动组患者下降尤为明显(P<0.05),且与SLEDAI呈明显的负相关(P<0.05)。 结论 初发的活动性SLE患者外周血Treg与Th17细胞的比率明显下降,并与疾病活动密切相关,两群细胞的失衡可能在SLE发病机制中起重要的作用。
红斑狼疮 系统性 调节性T细胞 Th17细胞
系统性红斑狼疮(systemic lupus erythematosus,SLE)是具体病因尚未明确的一种常见的自身免疫性疾病,临床特征为抗原-抗体的免疫复合物沉积于器官引起多种临床表现。免疫系统紊乱在SLE发病中占主导地位。调节性T细胞(regulaory T cells,Treg)和Th17细胞是新近发现的两群CD4+T细胞亚群,其中Treg具有免疫抑制和免疫无能的特征,可“主动”地抑制免疫反应[1]。Th17细胞为促炎症细胞,通过分泌IL-17A和IL-17F,引起组织的免疫炎症[2-3]。两群细胞间的失衡导致自身免疫病的发生[4]。我们在前期研究中发现Treg与Th17的失衡在活动性SLE中明显降低,并与疾病明显相关,但在初发SLE患者中的作用尚不明确[5]。本研究采用流式细胞仪检测初发SLE患者外周血CD4+CD25high-Treg和Th17细胞占CD4+细胞的比例,分析两者的比率与疾病活动的相关性以及Treg与Th17细胞的免疫失衡在初发SLE发病机制中的作用。
1 对象和方法
1.1 对象 我院风湿免疫肾脏科2008-09—2011-12住院或门诊收治未经治疗的初发SLE患者15例,男1例,女14例,年龄22~38岁。诊断均符合1997年美国风湿病学会制定的SLE诊断标准。采用SLE疾病活动指数(SLEDAI)将其分组(SLEDAI≈6分为活动组,<6分为非活动组),其中活动组10例,SLEDAI为(14.70±5.12)分,非活动组5例,SLEDAI为(2.60±1.14)分,两组评分比较,差异有统计学意义(P<0.01)。选择同时期体检的健康者10例为对照组,男1例,女9例,年龄20~37岁。两组性别、年龄差异均无统计学意义(均P>0.05)。本研究遵循伦理学标准,并得到本单位医学伦理委员会批准,所有受试者均签署知情同意书。
1.2 方法
1.2.1 CD4+CD25highT细胞的培养与标记 取肝素抗凝全血3ml,分别加入20μl的PE标记的鼠抗人CD4单抗和异硫氰酸荧光素(FITC)标记的鼠抗人CD25单抗,并设立同型对照管。混匀后避光15min,再加入1ml红细胞裂解液,37℃孵育10min,离心弃去上清液,PBS洗涤3次。
1.2.2 Th17细胞的培养与标记 空腹抽取初发SLE患者和健康对照组静脉血,肝素抗凝,调整细胞浓度为1× 106个/ml,接种至24孔培养板,每孔加入的50ng/ml佛波酯和750ng/ml的离子霉素,孵育1h后加入10μg/ml莫能霉素,在37℃,5%CO2细胞培养箱孵育4h后收集细胞,取500μl细胞于流式专用试管中,分为测定管和同型对照管,加入20μl的PE标记的鼠抗人CD4单抗,4℃避光孵育30min,PBS洗涤2次,固定液室温避光固定反应20min后离心弃去上清液,PBS洗涤2次。加入破膜剂进行细胞打孔,离心弃去上清液后进行细胞因子染色。测定管加入0.5μl FITC标记的IL-17A,对照管加入同型对照,4℃避光孵育30min。藻红素(PE)标记的鼠抗人CD4,FITC标记的鼠抗人CD25及同型对照均购自美国BD公司,FITC标记的鼠抗人的IL-17A及同型对照购自美国eBioscience公司。佛波酯、离子霉素和莫能霉素均购自美国Sigma-Aldrich公司,RPMI 1640购自美国Gibco公司。
1.2.3 流式细胞仪检测 Epics XL-MCL型流式细胞分析仪(Beckman-Coulter公司),按常规操作进行,EXPO32软件分析结果,根据正向散射光和侧向散射光以淋巴细胞群设门,分别测定SLE患者和健康对照组CD4+CD25highT细胞和Th17细胞占CD4+T细胞的比例,其中CD4+CD25highT细胞定义为2倍于CD4+CD25+T细胞的平均荧光强度的细胞(图1)。
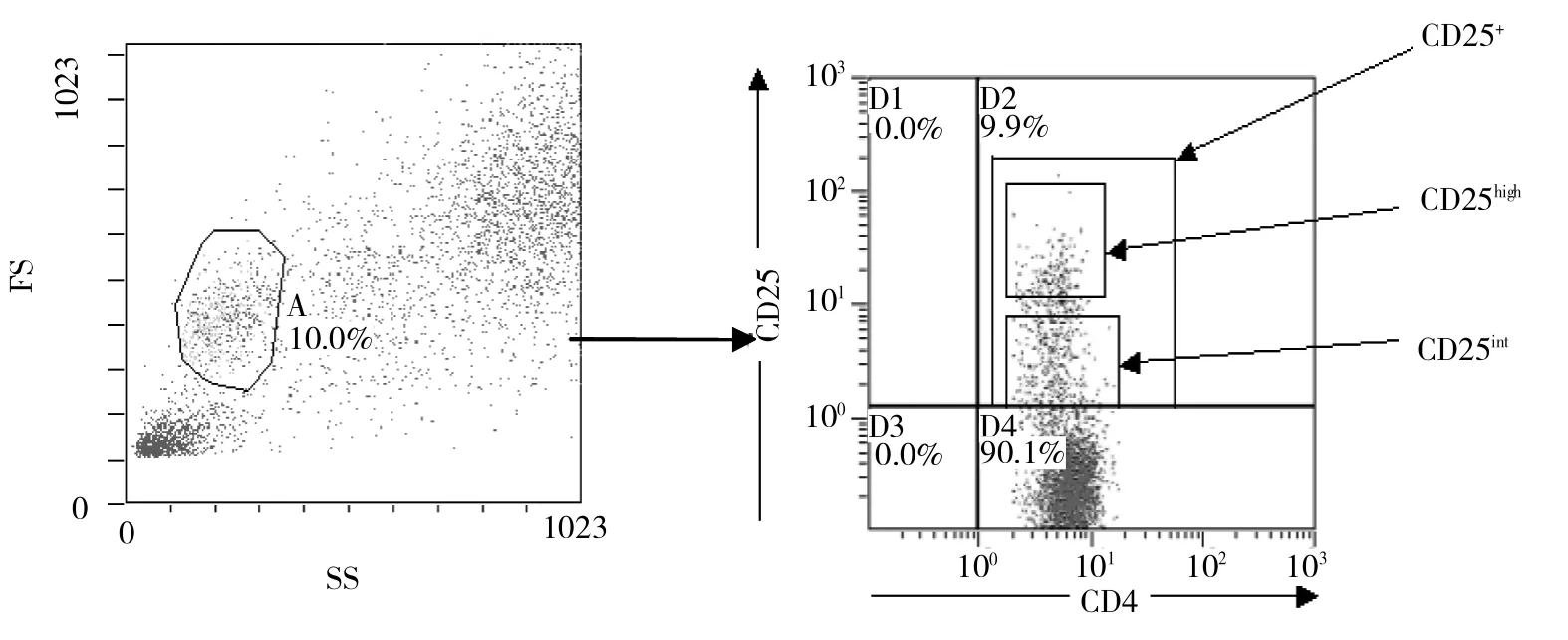
图1 流式检测CD4+CD25highT细胞的设门
1.3 统计学处理 采用SigmaStat3.5统计软件。计量资料以表示,多组间比较采用单因素方差分析(AVONA),两组间比较采用t检验,变量间的相关关系采用Pearson相关分析。
2 结果
初发SLE患者及对照组外周血CD4+CD25highTreg细胞与Th17细胞的比率及与疾病的相关性 见表1。
由表1可见,初发SLE组和对照组外周血CD4+CD25highTreg细胞的比例比较,差异无统计学意义(P>0.05)。其中在初发SLE患者中,活动组和非活动组外周血CD4+CD25highTreg细胞的比例比较,差异无统计学意义(P>0.05)。活动组和非活动组SLE与对照组比较,差异也无统计学意义(P>0.05)。初发SLE患者外周血CD4+CD25highT细胞的比例与SLEDAI无相关性(r=-0.403,P>0.05,图2A)。

表1 初发SLE组与对照组的Treg和Th17细胞的比例及两者的比率
初发SLE组和对照组外周血Th17细胞的比例比较,差异无统计学意义(P>0.05)。其中在初发SLE患者中,活动组、非活动组外周血Th17细胞的比例比较,差异无统计学意义(P>0.05),活动组、非活动组与对照组比较,差异也无统计学意义(P>0.05)。初发SLE患者外周血Th17细胞的比例与SLEDAI无相关性(r= 0.471,P>0.05,图2B)。

图2 CD4+CD25highT细胞(A)和Th17细胞(B)与SLEDAI的相关性分析
初发SLE组和对照组外周血CD4+CD25highTreg细胞与Th17细胞的比较,差异无统计学意义(P>0.05)。其中在初发SLE患者中,活动组、非活动组外周血CD4+CD25highTreg细胞与Th17细胞的比率比较,差异无统计学意义(P>0.05),与对照组比较,差异无统计学意义(P>0.05)。初发SLE患者CD4+CD25highTreg细胞与Th17细胞的比率与SLEDAI呈负相关性(r=-0.527,P<0.05,图3)。
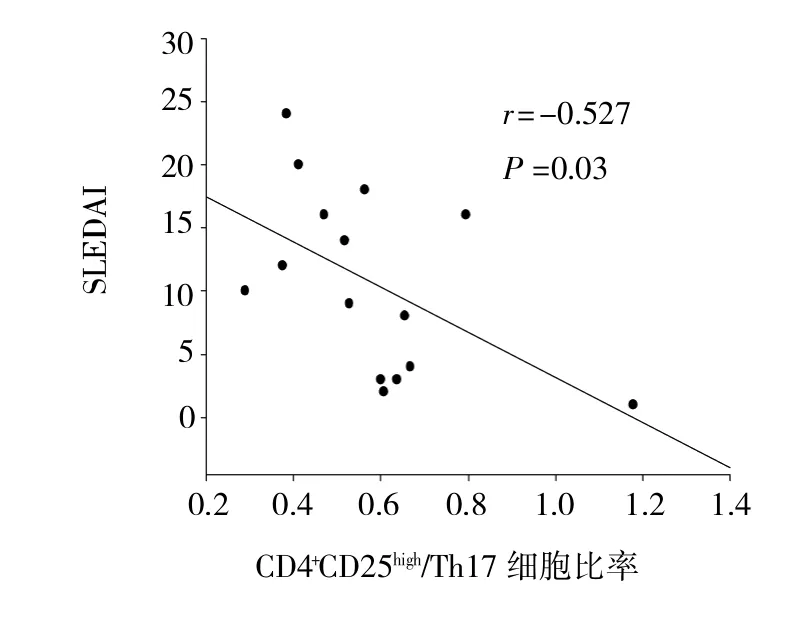
图3 CD4+CD25high/Th17细胞比率与SLEDAI的相关性分析
3 讨论
本研究发现Treg与Th17细胞的比率在初发的活动期SLE患者中下降明显,并与SLEDAI呈密切相关,但未发现Treg和Th17细胞占CD4+T细胞的比例在初发SLE的异常及与疾病活动无相关性,揭示Treg与Th17细胞之间的免疫失衡在初发SLE组发病中起到一定的作用。
SLE是一种常见的自身免疫性疾病,累及多个器官导致一系列的临床表现,其发病机制主要是免疫耐受的失衡,机体产生大量的自身抗体,导致抗原抗体复合物形成。免疫系统的稳定需要免疫耐受来维持,免疫耐受可分为中枢性和外周性免疫耐受。Treg是一群能够“主动”地抑制自身反应性T细胞的免疫反应,抑制细胞的活化和细胞因子的分泌[1],是维持外周免疫耐受的最重要机制。1995年,Sakaguchi等[6]首次定义高表达IL-2受体α链(CD25)的CD4+T细胞为Treg,其在体外通过细胞间的直接接触发挥免疫抑制作用,在体内可能还通过细胞因子发挥其功能,随着研究的不断深入,发现多箭头转录因子Foxp3是小鼠Treg的标记物和功能调节基因[7],然而,在人活化的T细胞中也能短暂表达Foxp3[8],说明其不是人Treg的特异标记物,目前仍认为CD4+CD25highT细胞是人较特异的标记物[9],因此本研究选择此群细胞来定义Treg。Th17细胞是一群促炎症细胞,能分泌IL-17A、IL-17F及IL-21,导致组织的炎症反应。在体外由TGF-β和IL-6诱导产生Th17细胞,其中维甲酸孤儿核受体RORγt是Th17细胞分化的重要因子[2-3]。Treg和Th17细胞在自身免疫性疾病中的作用越来越受到重视,如类风湿关节炎,多发性硬化等。
本研究发现初发SLE组Treg占CD4+T细胞的比例并不降低,与SLEDAI无相关性。已有大量的研究发现在活动性SLE患者外周血Treg的数目减少[9-10],但有少数研究发现其比例是正常的[11],相反的,也有研究发现活动性SLE患者的Treg是上升的[12]。以上结果说明Treg在SLE中的作用不尽一致,可能与Treg的标记物选择有关。接着我们分析初发SLE患者外周血Th17细胞的比例,同样也未发现有临床意义。Wong等[14]发现SLE患者Th17细胞在活动期明显增加,并与SLEDAI呈正相关。最近的研究发现Th17细胞在SLE中有一定的作用,但是确切机制尚不明确[15]。
本研究中的重要发现是初发的活动性SLE患者存在Treg和Th17细胞的比率明显下降,与疾病活动呈明显的负相关。Yang等[16]也发现活动性SLE患者存在Th17细胞的扩增,且伴随Treg的下降,我们的前期研究[17]发现经治疗后临床缓解的活动性SLE患者的SLEDAI明显下降,伴随Treg和Th17细胞的失衡被逆转。以上结果表明Treg与Th17细胞的免疫失衡是初发活动性SLE的临床特征和参与其发生和发展。Treg和Th17细胞的分化存在相互制约,例如IL-6联合TGF-β能诱导Th17细胞的分化,而IL-6抑制Treg的体外抑制功能。同样,IL-2是Treg诱导的必需细胞因子,也是维持Treg功能的重要因素,相反IL-2能抑制Th17细胞的分化[21]。因此,我们认为初发SLE患者存在异常的免疫环境导致Treg和Th17细胞的失衡。
综上所述,我们发现初发活动性SLE患者存在Treg与Th17细胞的比率降低,可辅助作为判断疾病活动的指标。两群细胞间的免疫失衡参与初发SLE的发生和发展。本研究的结果提示我们可以通过调控Treg和Th17细胞的平衡来治疗SLE等自身免疫性疾病。
[1]Sakaguchi S.Naturally arising Foxp3-expressing CD25+CD4+regulatory T cells in immunological tolerance to self and non-self [J].Nat Immunol,2005,6(4):345-352.
[2]Harrington L E,Hatton R D,Mangan P R,et al.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J].Nat Immunol,2005,6 (11):1123-1132.
[3]Park H,Li X O,Yang S H,et al.A distinct lineage of CD4+T cells regulates tissue inflammation by producing interleukin 17[J].Nat Immunol,2005,6(11):1133-1141.
[4]Bettelli E,Carrier Y,Gao W,et al.Reciprocal developmental pathways for the generation of pathogenic effector Th17 and regulatory T cells[J].Nature,2006,441(7090):235-238.
[5]Ma J,Yu J,Tao X,et al.The imbalance between regulatory and IL-17-secreting CD4+T cells in lupus patients[J].Clin Rheumatol, 2010,29(11):1251-1258.
[6]Sakaguchi S,Sakaguchi N,Asano M,et al.Immunological self-tolerance maintained by activated T cells expression IL-2 receptor α-chains(CD25):breakdown of single mechanism of self-tolerance causes various autoimmune disease[J].J Immunol,1995, 155(3):1151-1164.
[7]Fontenot J D,Gavin M A,Rudensky A Y.FOXP3 programs the development and function of CD4+CD25+regulatory T cells[J].Nat Immunol,2003,4(4):330-336.
[8]Tran D Q,Ramsey H,Shevach E M.Induction of FOXP3 expression in naive human CD4+FOXP3 T cells by T-cell receptor stimulation is transforming growth factor-beta dependent but does not confer a regulatory phenotype[J].Blood,2007,110(8):2983-2990.
[9]Baecher-Allan C,Brown J A,Freeman G J,et al.CD4+CD25highregulatory cells in human peripheral blood[J].J Immunol,2001, 167(3):1245-1253.
[10]Valencia X,Yarboro C,Illei G,et al.Deficient CD4+CD25highT regulatory cell function in patients with active systemic lupus erythematosus[J].J Immunol,2007,178(4):2579-2588.
[11]Mellor-Pita S,Citores M J,Castejon R,et al.Decrease of regulatory T cells in patients with systemic lupus erythematosus[J].Ann Rheum Dis,2006,65(4):553-554.
[12]Alvarado-Sánchez B,Hernández-Castro B,Portales-Pérez D,et al.Regulatory T cells in patients with systemic lupus erythematosus[J].J Autoimmun,2006,27(2):110-118.
[13]Bonelli M,von Dalwigk K,Savitskaya A,et al.Foxp3 expression in CD4+T cells of patients with systemic lupus erythematosus (SLE):A comparative phenotypic analysis[J].Ann Rheum Dis, 2008,67(5):664-671.
[14]Monk C R,Spachidou M,Rovis F,et al.MRL/Mp CD4+CD25-T cells show reduced sensitivity to suppression by CD4+CD25+regulatory T cells in vitro.A novel defect of T Cell regulation in systemic lupus erythematosus[J].Arthritis Rheum,2005,52(4): 1180-1184.
[15]Wong C K,Lit L C,Tam L S,et al.Hyperproduction of IL-23 and IL-17 in patients with systemic lupus erythematosus:implications for Th17-mediated inflammation in autoimmunity[J].Clin Immunol,2008,127(3):385-393.
[16]Kang H K,Liu M,Datta S K.Low-dose peptide tolerance therapy of lupus generates plasmacytoid dendritic cells that cause expansion of autoantigen-specific regulatory T cells and contraction of inflammatory Th17 cells[J].J Immunol,2007,178(12): 7849-7858.
[17]Yang J,Chu Y,Yang X,et al.Th17 and natural Treg cell population dynamics in systemic lupus erythematosus[J].Arthritis Rheum,2009,60(5):1472-1483.
[18]Ma J,Yu J,Tao X,et al.The imbalance between regulatory and IL-17-secreting CD4+T cells in lupus patients[J].Clin Rheumatol,2010,29(11):1251-1258.
[19]Tackey E,Lipsky PE,Illei GG.Rationale for interleukin-6blockade in systemic lupus erythematosus[J].Lupus,2004,13(5):339-343.
[20]Wan S,Xia C,Morel L.IL-6 produced by dendritic cells from lupus-prone mice inhibits CD4+CD25+T cell regulatory functions[J].J Immunol,2007,178(1):271-279.
[21]Zheng S G,Wang J,Wang P,et al.IL-2 is essential for TGF-β to convert nave CD4+CD25-cells to CD25+Foxp3+regulatory T cells and for expansion of these cells[J].J Immunol,2007,178 (4):2018-2027.
[22]Laurence A,Tato C M,Davidson T S,et al.Interleukin-2 signaling via STAT5 constrains T helper 17 cell generation[J].Immunity,2007,26(3):371-381.
[23]Yang J,Yang X,Zou H,et al.Recovery of the immune balance between Th17 and regulatory T cells as a treatment for systemic lupus erythematosus[J].Rheumatology,2011,50(8):1366-1372.
Clinical significance of regulatory T cells and Th17 cells in the patients with new-onset systemic lupus erythematosus
Objective To determine the ratio of CD25 and IL-17A cells in peripheral CD4+T cells of new-onset patients with systemic lupus erythematosus(SLE)and to assess their clinical significance.Methods Fifteen new-onset patients with systemic lupus erythematosus,including 10 active cases and 5 inactive cases,and 10 healthy individuals were enrolled in the study.The ratio of CD25 and IL-17A cells in peripheral CD4+T cells was analyzed by flow cytometry.Disease activity was assessed by systemic lupus erythematosus activity index(SLEDAI).Results There was no significant difference in frequency of CD4+CD25highT cells and Th17 cells between SLE patients and normal controls(P>0.05).The frequency of CD4+CD25highT cells and Th17 cells was not correlated with SLEDAI scores of patients(P>0.05).The ratio of CD4+CD25highT cells and Th17 cells in active SLE patients was significantly lower than that in inactive patients and healthy controls (P<0.05)and it was negatively correlated with SLEDAI scores(P<0.05).Conclusion The results indicate that the imbalance of Treg cells and Th17 cells may be involved in the pathogenesis of SLE.
Lupus erythematosus Systemic Regulatory T cells Th17 cells


2012-08-01)
(本文编辑:杨丽)
国家自然科学基金(81274161,81001307),浙江省自然科学基金(Y2090918);浙江省医药卫生科学研究基金计划项目(2012RCA046,2011KYA137,2007A162);杭州市科技发展计划项目(20080333Q28,20110733Q15,20110833B26)
310003 杭州市红十字会医院风湿免疫肾脏科
马纪林,E-mail:majilin080808@gmail.com
