miR-139-3p在胃癌组织中的表达及其对细胞增殖和凋亡的作用
2013-04-18陈乐高姚海波关天培叶再元陶厚权
陈乐高 姚海波 关天培 叶再元 陶厚权
●论 著
miR-139-3p在胃癌组织中的表达及其对细胞增殖和凋亡的作用
陈乐高 姚海波 关天培 叶再元 陶厚权
目的 研究miR-139-3p在胃癌组织和癌旁组织中的表达水平及其对AGS和SGC-7901胃癌细胞株的增殖和凋亡的作用。 方法 采用qRT-PCR检测38例患者胃癌组织与癌旁组织中miR-139-3p的表达情况,并分析miR-139-3p的表达与胃癌临床病理特征之间的关系;利用miR-139-3p抑制剂下调胃癌细胞株中miR-139-3p的表达,MTT法检测对AGS和SGC-7901细胞增殖的影响,流式细胞仪检测细胞凋亡情况。 结果 miR-139-3p在胃癌组织中表达高于癌旁组织(P<0.01),其表达增高与肿瘤大小和部位相关(均P<0.05);下调miR-139-3p的表达能够抑制胃癌细胞的增殖、促进细胞凋亡(均P<0.05)。 结论miR-139-3p在胃癌组织中表达增高,可能参与胃癌的发生、发展过程。
miR-139-3p 胃癌 AGS细胞 SGC-7901细胞 细胞增殖 细胞凋亡
miR-139-3p Gastric cancerAGS cellSGC-7901 cellCell proliferation Cell apoptosis
胃癌是一种常见的消化道恶性肿瘤,在我国发病率和病死率都非常高[1]。近年来研究发现microRNA(miR NA),作为一种非编码的内源性RNA,在肿瘤的发生、发展中起着重要作用[2]。已有实验证明,异常表达的miRNA,如miR-101、miR-199a等在胃癌的发生、发展中起到重要作用[3-4]。在前期研究利用microRNA芯片筛选出胃癌中异常表达的miRNA,其中miR-139-3p异常表达增高。本研究采用实时定量PCR(qRT-PCR)检测胃癌组织与癌旁组织中miR-139-3p的表达情况;分析其表达量与胃癌临床病理特性之间的关系;通过miR-139-3p抑制剂下调胃癌细胞株AGS、SGC-7901中的miR-139-3p的表达,进一步分析miR-139-3p对胃癌细胞增殖和凋亡的作用,为进一步研究其在胃癌中的分子生物学机制和发现新的治疗靶点提供依据。
1 资料和方法
1.1 一般资料 收集浙江省人民医院2011-02—06收治的38例新鲜胃癌手术切除标本及癌旁组织(距肿瘤组织5cm以上)。所有病例均经病理确诊,且术前未接受过放化疗。其中男26例,女12例,年龄34~86岁,中位年龄57岁。肿瘤组织根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)胃癌TNM分期(2010年第7版)进行病理分期。
1.2 材料 胃癌细胞株AGS和SGC-7901购自于上海细胞库;TRIzol试剂购自美国Invitrogen公司;One Step PrimeScript miRNA cDNA Synthesis Kit、SYBR Premix Ex TaqTMII定量PCR试剂盒购自TAKARA公司;Anti-hsa-miR-139-3p miScript miRNA Inhibitor试剂(MIN0004552)和 miScript Inhibitor Negative Control试剂(1027271)购自于美国QIAGEN公司;GAVA Nexin V Reagent凋亡试剂盒购自德国Millipore公司。
1.3 胃癌组织及癌旁组织中miR-139-3p的检测
1.3.1 总RNA提取和反转录 按RNA提取试剂盒说明书提取总RNA。利用miRNA cDNA Synthesis Kit进行逆转录反应,反应体系:2×miRNA Reaction Buffer Mix 10μl,0.1%PBS 2μl,miRNA PrimeScrip RT Enzyme Mix 2μl,Total RNA 1μl RNase Free dH2O 5μl;反应条件:37℃60min,85℃5s。
1.3.2 Real-time PCR miR-139-3p的正向特异性引物序列为:GGAGACGCGGCCCTGTTGGAGT,内参U6B的正向特异性引物序列为:ACGCAAATTCGTGAAGCGTT;反向引物为逆转录试剂盒中提供的通用引物。PCR反应体系:SYBR Premix 10μl,Rox 0.4μl,正反向引物各0.5μl,模板1 μl,dH2O 7.6μl;反应条件:94℃4min,1个循环;94℃5s,55℃20s,72℃20s,40个循环;熔解曲线程序:95℃1min,55℃30s,95℃30s,1个循环。
1.4 胃癌细胞株中miR-139-3p抑制剂的转染 取对数生长期AGS和7901细胞接种于6孔板中(细胞浓度2×105个/孔)。按转染试剂盒要求,将miR-139-3p抑制剂Anti-hsa-miR-139-3p miScript miRNA Inhibitor作用于细胞,作为实验组;将miScript Inhibitor Negative Control作用于细胞,作为对照组。转染24h后,利用qRT-PCR检测转染效果及进行细胞实验。
1.5 MTT检测增殖率 收集上述实验组和对照组细胞,调整细胞浓度为1×105个/ml。将200μl细胞悬液接种于96孔板中,置于37℃、5%CO2饱和湿度培养箱内。分别在培养24、48、72h后,每孔加入20μl MTT液(5mg/ml),继续培养4h后取出培养板。吸净上清液,每孔加入150μl DMSO,振荡15min。以630nm为参考波长,570nm为测定波长,用多功能酶标仪(Infinite M200)测定每孔的吸光度(A)。相对增殖率(%)=实验组(A570nm-A630nm)/对照组(A570nm-A630nm)× 100%。
1.6 流式细胞仪检测凋亡 取上述实验组和对照组细胞,用0.25%胰酶消化后,PBS洗涤2次,离心去除PBS,加入200μl凋亡试剂染色,混匀,避光放置30min,再次混匀,吸100μl细胞混合液至96孔板中,加入100μl培养基后上机检测。
1.7 统计学处理 采用SPSS18.0统计软件,计量资料均以表示,配对计量资料采用配对样本t检验;等级资料采用χ2或Fisher确切概率检验。
2 结果
2.1 miR-139-3p在胃癌组织中表达增高 胃癌组织中miR-139-3p的相对表达量(1.36×10-4±4.01×10-5),高于癌旁正常组织(7.87×10-5±2.81×10-5)。两者比较具有统计学意义(P<0.05),见图1。
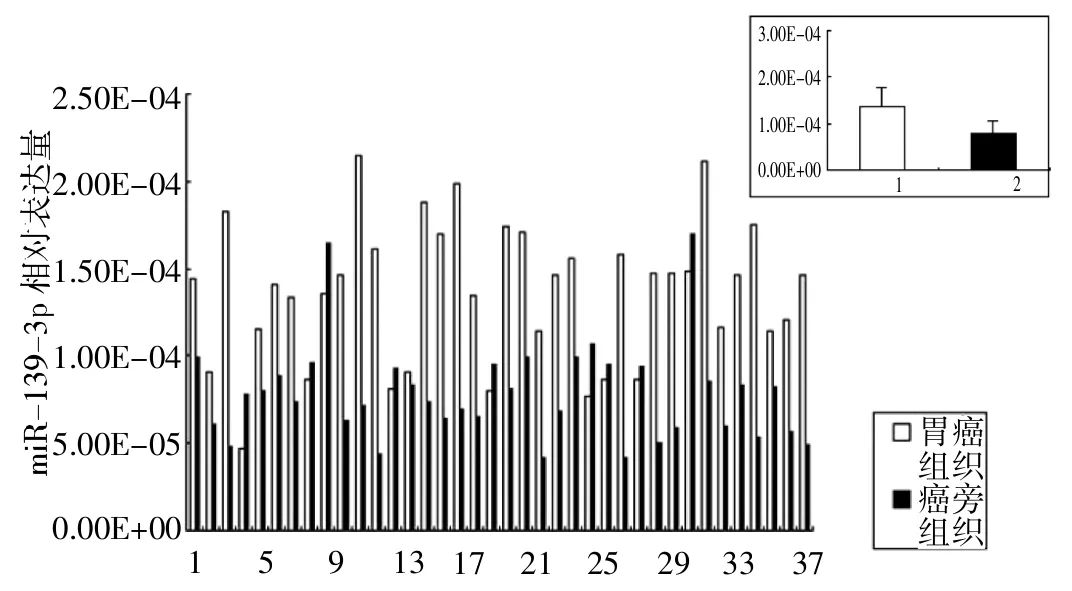
图1 miR-139-3p在胃癌及癌旁组织中表达
2.2 miR-139-3p的表达与临床病理特征的关系 miR-139-3p的表达增高与胃癌患者的肿瘤部位、直径相关(P<0.05),而与患者性别、年龄、分化程度、TNM分期等无关(均P>0.05),见表1。
2.3 抑制剂对miR-139-3p表达的影响 qRT-PCR的检测结果表明实验组的miR-139-3p表达量明显低于对照组(P<0.05)。提示miR-139-3p抑制剂能够抑制胃癌细胞中miR-139-3p的表达,见图2。
2.4 下调miR-139-3p对胃癌细胞增殖的影响 MTT实验结果表明,下调miR-139-3p的表达能够抑制胃癌细胞的增殖。培养24、48、72h后,实验组AGS细胞相对增殖率分别为95.3%±2.18%、87.5%±2.04%、83.8%± 3.59%(均P<0.05);实验组SGC-7019细胞相对增殖率分别为92.1%±4.22%、85.3%±1.76%、74.7%±3.39%(均P<0.05)。提示下调miR-139-3p对胃癌细胞的增殖有明显的抑制作用,见图3。
2.5 下调miR-139-3p的表达对胃癌细胞凋亡的作用 下调miR-139-3p的表达后,AGS细胞的早期凋亡比例从7.03%±1.02%增加到16.83%±2.21%,具有统计学差异(P<0.01),而SGC-7901细胞的早期凋亡比例增加无统计学差异(7.60%±2.05%vs 8.13%±0.77%,P>0.05),见图4。

表1 miR-139-3p的表达与胃癌患者临床病理特征的关系

图2 抑制剂下调miR-139-3p在胃癌细胞中的表达

图3 MTT法检测下调miR-139-3p后胃癌细胞增殖情况
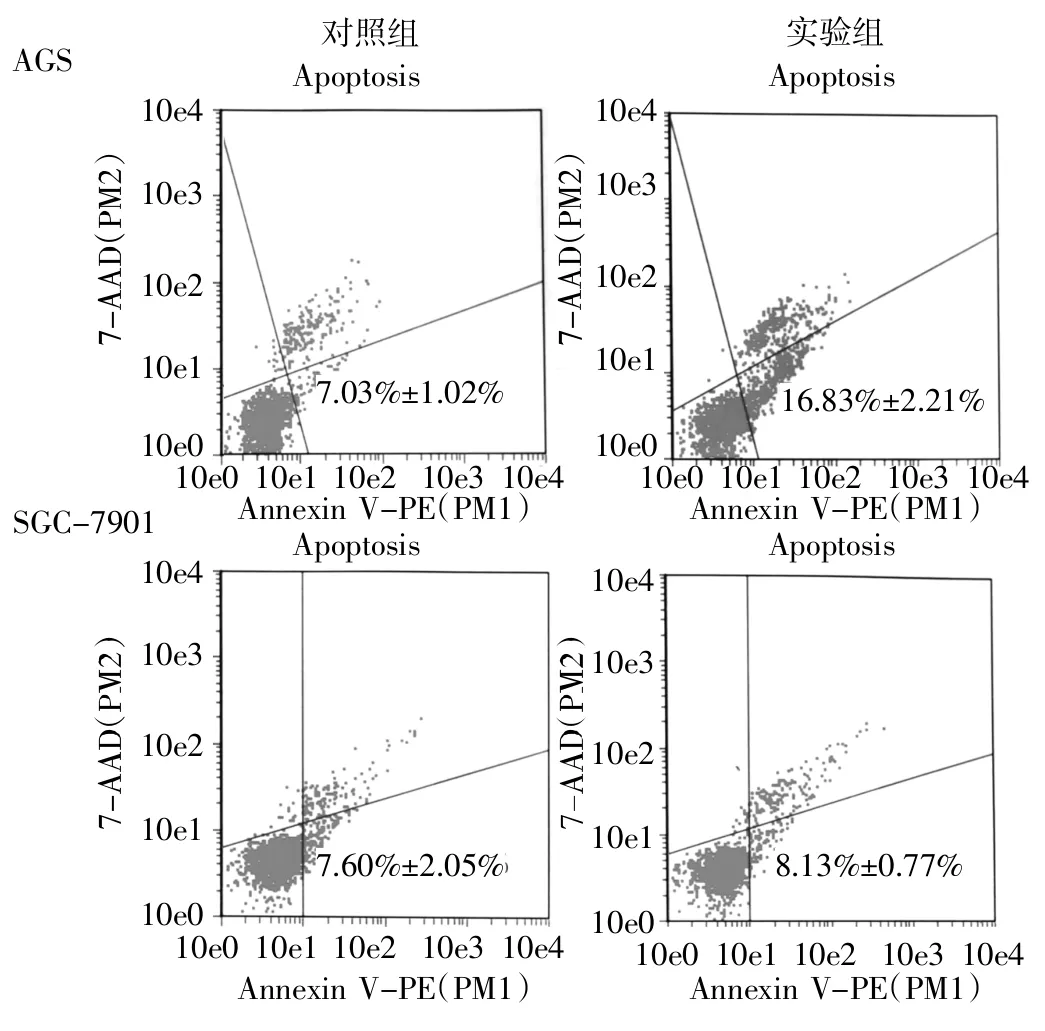
图4 流式细胞仪检测下调miR-139-3p后胃癌细胞凋亡情况
3 讨论
miRNAs是一类由18~23个核苷酸构成的单链非编码RNA分子,其本身不编码蛋白质,但是可以通过与靶基因mRNA的3′端非编码区(3′-untranslational region,UTR)结合,抑制mRNA的翻译或降解翻译产物导致靶基因的转录后沉默,从而参与靶基因功能的调节。miRNA参与生命过程中一系列的重要进程,包括早期发育、细胞增殖、分化和凋亡等[2]。近年来研究发现[5],miRNA还与肿瘤的发生、发展有着密切关系。有研究表明,大约50%的人类miRNA基因位于染色体的易碎片段和肿瘤相关区域,而肿瘤的发生常常与这些基因的扩增或丢失密切相关。miRNA表达失调的现象普遍存在于肺癌、前列腺癌、乳腺癌、肝癌、胰腺癌、结肠癌等多种肿瘤中,并且不同肿瘤其miRNA表达谱也有很大差异[6-11]。miRNA具有类癌基因或类抑癌基因的功能,类癌基因样miRNA在肿瘤中表达增高或类抑癌基因样miRNA的表达降低能下调抑癌基因的活性,促进肿瘤细胞增殖、侵袭、转移或耐药等,在肿瘤的发生、发展中起着重要作用[12]。
近来大量研究表明,胃癌是一种多基因疾病,其发生、发展是一个多步骤参与、多种相关基因失活导致的结果。miRNA可以作为癌基因或抑癌基因在胃癌中发挥促癌或抑癌作用。Xia等[13]研究表明,miR-124能够与SPHK1基因的3′-UTR结合来抑制该基因表达,从而抑制胃癌细胞的增殖。Zhang等[14]报道,miR-181a能够促进胃癌细胞7901增殖、克隆形成、侵袭和迁移,抑制细胞凋亡,而且进一步原位杂交和荧光素酶报告基因结果显示抑癌基因KLF6的表达被其抑制。Liu等[15]研究发现,miR-221在胃癌组织中高表达,且与淋巴结转移、浸润深度和淋巴远处转移相关,Cox比例风险回归模型提示高表达miR-221可能是胃癌预后的一个危险因子。Zhang等[16]用实时定量PCR证实miR-21在人胃癌组织及细胞株中显著过表达,在人胃癌细胞株AGS中,miR-21的高表达能显著增强细胞增殖和侵袭能力,而敲除miR-21导致细胞凋亡显著增加,增殖、侵袭和迁移能力明显下降,进一步研究证实RECK(一种已知的胃癌抑制基因)是miR-21的靶点,即miRNA先通过下调RECK,然后导致胃癌发生。本研究表明miR-139-3p在胃癌组织中表达量高于癌旁组织,且miR-139-3p的表达增高与肿瘤大小、部位相关,当miR-139-3p被下调后,胃癌细胞株AGS和SGC-7901的增殖被抑制,且AGS细胞凋亡比例增加。
miR-139-3p的异常表达在其他恶性肿瘤中也有报道。Schmitz等[17]发现,miR-139-3p在恶性肾上腺皮质瘤中表达量增加了7.49倍,提示miR-139-3p可作为一个恶性肾上腺皮质瘤的诊断因子。Shen等[18]报道发现,miR-139-3p高表达与结肠癌肝转移正相关,提示其可能参与了结肠癌的远处转移。然而阳圣等[19]利用miRNA芯片检测发现胃癌中miR-139-3p表达下调,这与本实验结果相反,可能与实验的样本数量及实验方法不同有关。
综上所述,本研究发现miR-139-3p在胃癌组织中表达升高,且与胃癌的肿瘤大小、部位相关。下调miR-139-3p可抑制胃癌细胞的增殖,促进胃癌细胞凋亡。推测miR-139-3p可能参与了胃癌发生、发展,其具体机制尚需进一步研究。
[1]Ling Y.Incidence and mortality of gastric cancer in China[J]. World J Gastroenterol,2006,12(1):17-20.
[2]Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[3]Wang H J,Ruan H J,He X J,et al.MicroRNA-101 is down-regulated in gastric cancer and involved in cell migration and invasion[J].Eur J Cancer,2012,46(12):2295-2303.
[4]Zhang Y,Fan K J,Sun Q,et al.Functional screening for miRNAs targeting Smad4 identified miR-199a as a negative regulator of TGF-β signalling pathway[J].Nucleic Acids Res,2012,40(18): 9286-9297.
[5]Calin G A,Sevignani C,Dumitru C D,et al.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J].Proc Nat Acad Sci USA,2004,101(9): 2999-3004.
[6]Landi M T,Zhao Y,Rotunno M,et al.MicroRNA expression differentiates histology and predicts survival of lung cancer[J].Clin Cancer Res,2010,16:430-441.
[7]Tong A W,Fulgham P,Jay C,et al.MicroRNA profile analysis of human prostate cancers[J].Cancer Gene Ther,2009,16:206-216.
[8]Yan L X,Huang X F,Shao Q,et al.MicroRNA miR-21 overexpression in human breast cancer is associated with advanced clinical stage,lymph node metastasis and patient poor prognosis [J].RNA,2008,14:2348-2360.
[9]Varnholt H,Drebber U,Schulze F,et al.MicroRNA gene expression profile of hepatitis C virus-associated hepatocellular carcinoma[J].Hepatology,2008,47:1223-1232.
[10]Lee E J,Gusev Y,Jiang J,et al.Expression profiling identifies microRNA signature in pancreatic cancer[J].Int J Cancer,2007, 120:1046-1054.
[11]Bandres E,Cubedo E,Agirre X,et al.Identification by Real-time PCR of 13 mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues[J].Mol Cancer,2006, 5:29.
[12]Lin T,Dong W,Huang J,et al.MicroRNA-143 as a tumor suppressor for bladder cancer[J].J Urol,2009,181:1372-1380.
[13]Xia J,Wu Z,Yu C,et al.miR-124 inhibits cell proliferation in gastric cancer through down-regulation of SPHK1[J].J Pathol, 2012,227(4):470-480.
[14]Zhang X,Nie Y,Du Y,et al.MicroRNA-181a promotes gastric cancer by negatively regulating tumor suppressor KLF6[J].Tumour Biol,2012,33(5):1589-1597.
[15]Liu K,Li G,Fan C,et al.Increased Expression of MicroRNA-221 in gastric cancer and its clinical significance[J].J Int Med Res,2012,40(2):467-474.
[16]Zhang Z,Li Z,Gao C,et al.miR-21 plays a pivotal role in gastric cancer pathogenesis and progression[J].Lab Invest,2008, 88(12):1358-1366.
[17]Schmitz K J,Helwig J,Bertram S,et al.Differential expression of microRNA-675,microRNA-139-3p and microRNA-335 in benign and malignant adrenocortical tumours[J].J Clin Pathol, 2011,64(6):529-535.
[18]Shen K,Liang Q,Xu K,et al.MiR-139 inhibits invasion and metastasis of colorectal cancer by targeting the type I insulin-like growth factor receptor[J].Biochem Pharmacol,2012, 84(3):320-330.
[19]阳圣,张雯,杨燕青,等.胃癌组织miRNA差异表达的初步分析[J].上海交通大学学报:医学版,2010,30(11):1317-1323.

2012-09-04)
(本文编辑:胥昀)
国家自然科学基金(81071991)
325000 温州医学院第一临床医学院 (陈乐高、姚海波、关天培、叶再元,陈乐高系硕士研究生);浙江省人民医院胃肠外科(叶再元、陶厚权)
叶再元,E-mail:zaiyuanye@163.com
【 Abstract】 ObjectiveTo investigate the effect of miR-139-3p on proliferation and apoptosis in gastric cancer. Methods The expression of miR-139-3p in gastric cancer and pericancerous tissues was examined by Real-time PCR.The correlation between miR-139-3p expression and clinicopathologic features of gastric cancer was analyzed.The cultured gastric cancer AGS and SGC-7901 cells were treated with miR-139-3p Inhibitor;the cell proliferation was detected by MTT assay and apoptosis was analyzed by flow cytometry. Results The expression of miR-139-3p increased in gastric cancer compared with pericancerous tissues(P<0.05).Expression of miR-139-3p was associated with tumor size(P<0.05)and location(P<0.05). Down-regulation of miR-139-3p inhibited proliferation and promoted apoptosis of gastric cancer AGS and SGC-7901 cells. Conclusion miR-139-3p is up-regulated in gastric cancer,which might be involved in the development of gastric cancer.
