青天葵中鼠李柠檬素在大鼠体内的药代动力学研究
2013-04-17蔡周权袁浩宇龙恩武
蔡周权,袁浩宇,龙恩武
(1.四川省科学城医院药剂科,四川 绵阳 621900;2.核工业四一六医院药剂科,四川 成都 610051;3.四川省人民医院药学部,四川 成都 610072)
青天葵是我国传统出口中药,主要产于广东、广西、云南、四川等地[1]。青天葵清热解毒、清肺止咳效果显著,现代药理研究证实其具有抗病毒、抗肿瘤及免疫增强作用,是一种药理作用显著、临床疗效确切的特产药材[2-3]。目前,青天葵的公开报道不多,其研究多在资源、性状、栽培、成分分析上,尚未见其体内过程的报道。鼠李柠檬素是青天葵中重要的黄酮类化合物[4],也是质量控制中常用的重要指标之一[5]。本研究中以青天葵中鼠李柠檬素为指标,建立了血药浓度测定方法,并对大鼠口服后的体内情况进行研究,为全面评价青天葵质量、制剂开发及临床应用等奠定药代动力学基础。现报道如下。
1 仪器与试药
LC-2010C HT型高效液相色谱仪(日本岛津),紫外检测器、泵及柱温箱;BS210S型电子天平(德国赛多利斯);TGL-16型台式离心机(上海安亭科学仪器厂);YHK-Ⅱ型液体快速混合器(江西医疗器械厂)。鼠李柠檬素对照品(自制,经 UV,IR,MS,NMR确证结构,纯度大于98%);青天葵提取物(自制,鼠李柠檬素纯度大于85%);甲醇、乙腈为色谱纯(美国Fisher公司);水为重蒸水;其余试剂均为分析纯。健康SD大鼠(体重250~300 g,雌雄各半),购自四川大学实验动物中心,试验前适应性喂养1周。
2 方法与结果
2.1 溶液制备
取鼠李柠檬素对照品约25 mg,精密称定,置25 mL棕色容量瓶中,用甲醇溶解稀释并定容,摇匀即得浓度为1 000 μg/mL的贮备液,4℃冷藏保存。取青天葵提取物适量,置25 mL容量瓶中,重蒸水超声溶解,使鼠李柠檬素质量浓度为7.5 g/L,作为大鼠灌胃液。
2.2 血浆样品预处理
精密量取血浆样品 100 μL,加入甲醇 20 μL,10%三氯乙酸溶液100 μL 沉淀蛋白,旋涡混匀 3 min,1.2×104r/min离心 5 min,精密量取上清液20 μL直接进样分析。
2.3 色谱条件与系统适用性试验
色谱柱:Hypersil C18柱(250 mm ×4.6 mm,5 μm),加保护柱;流动相:甲醇-乙腈-0.2%磷酸水溶液(30∶35∶35);检测波长:366 nm;柱温:35 ℃;流速:1 mL/min;进样量:20 μL。在上述色谱条件下,测得空白血浆、空白血浆加鼠李柠檬素对照品及大鼠灌胃后2 h血浆样品,色谱图见图1。可见,鼠李柠檬素保留时间约为14.5 min,血浆中内源性物质不干扰鼠李柠檬素的分离测定。
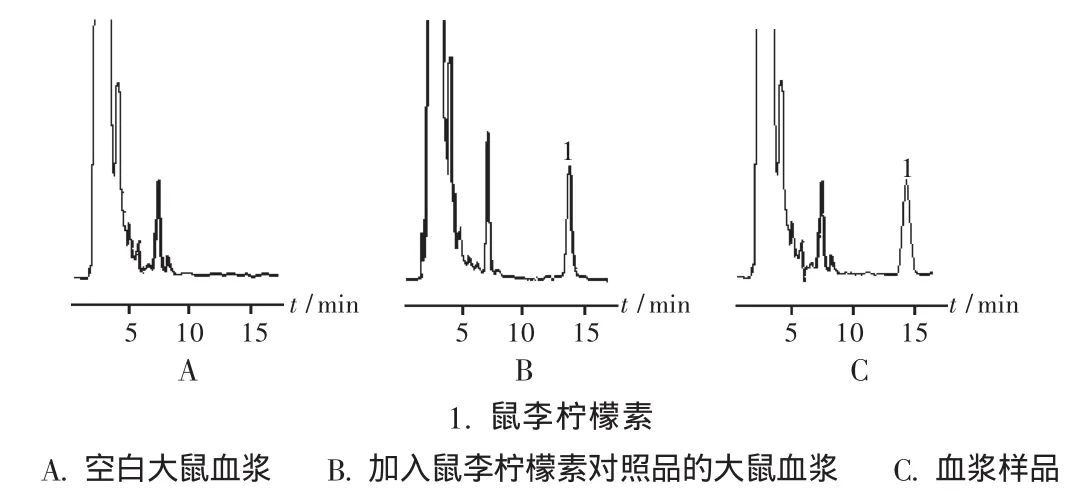
图1 高效液相色谱图
2.4 方法学考察
标准曲线制备:精密吸取鼠李柠檬素贮备液适量,分别用甲醇稀释成系列质量浓度的工作溶液,各取20 μL加入100 μL空白血浆中,使血浆质量浓度分别为 0.05,0.10,0.25,0.50,1.00,2.50,5.00,10.00 μg/mL,按 2.2 项下方法测定,记录色谱图和峰面积。以药物峰面积(A)为纵坐标血浆中药物浓度(C,μg/mL)为横坐标,进行加权回归,得标准曲线方程 A=1.26 × 103C-8.98 ×102(r=0.999 3,权重为 1/C2)。质量浓度在0.05~10.00 μg/mL范围内,药物峰面积与质量浓度线性关系良好。检测限为10 ng/mL。
方法回收率试验:精密量取鼠李柠檬素工作溶液,各取20 μL加入100 μL空白大鼠血浆中,得低、中、高3个已知质量浓度样品,按标准曲线方法计算回收率,结果见表1。
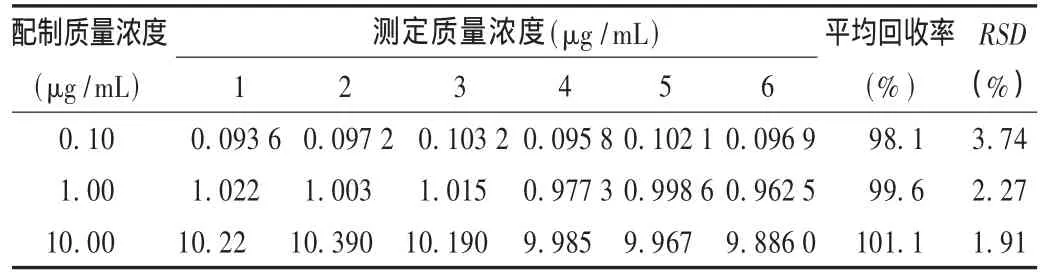
表1 回收率试验结果(n=6)
提取回收率试验:精密量取鼠李柠檬素工作溶液,各取20 μL加入100 μL空白大鼠血浆,配制低、中、高3个已知质量浓度样品,按标准曲线方法操作,记录峰面积;另以水代替空白血浆,将低、中、高3个已知质量浓度样品按标准曲线方法操作,记录峰面积。以前后2种处理测定得到的峰面积之比计算提取回收率,结果见表2。
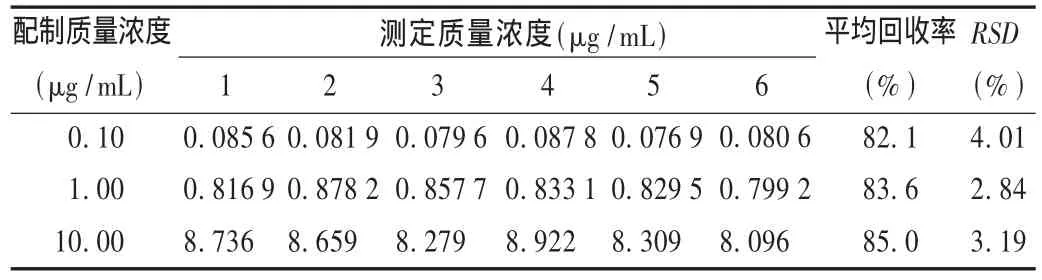
表2 提取回收率试验结果(n=6)
精密度试验:按方法回收率试验项下方法,测定鼠李柠檬素0.10,1.00,10.00 μg/mL 3 个已知质量浓度样品,以 1 d 内 5 次测定结果计算日内精密度,1周内3 d测定结果计算日间精密度。结果表明,日内相对标准差分别为 3.95%,4.33%,3.36%,日间相对标准差分别为 10.58%,9.89%,7.55%。
稳定性试验:配制低、中、高(0.10,1.00,10.00 μg/mL)3 个质量浓度血浆样品数份,按2.2项下方法操作,分别于室温下放置0,1,2,4 h后测定,考察样品在室温条件下的稳定性;放置于-20℃ 冰箱中反复冻融3次,考察冻融对药物稳定性的影响;在-20℃冰箱中冷冻15 d后,考察药物冷冻放置的稳定性。结果的RSD值均小于10%,表明血浆样品在室温下放置4 h、反复冻融3次、-20℃冰箱中冷冻保存15 d后稳定性均良好,满足样品分析检测要求。
2.5 动物试验
SD大鼠8只,雌雄各半,试验前禁食12 h,全程不禁水;按120 mg/kg灌胃给予青天葵供试液,于给药前及给药后0.25,0.5,0.75,1,1.5,2,4,6,8,12,24 h 时尾静脉断尾取血约 0.3 mL,离心分离血浆,置-20℃冰箱中保存待测。血药浓度-时间曲线见图2。用DAS 2.1.1版药代动力学软件进行处理,计算药代动力学参数。结果鼠李柠檬素在大鼠体内过程符合二室模型,药代动力学参数见表3。
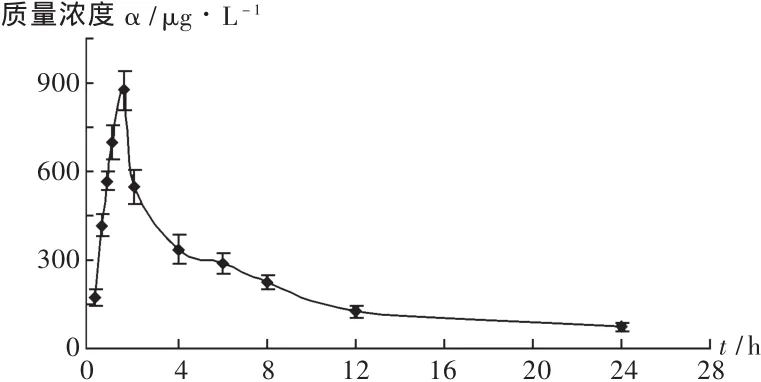
图2 鼠李柠檬素血药浓度-时间曲线(n=8)

表3 灌胃给予青天葵后鼠李柠檬素的药代动力学参数(n=8)
3 讨论
鼠李柠檬素是青天葵中主要的黄酮类成分之一,也是表征其质量的重要成分。研究结果显示,大鼠单剂量灌胃给予120 mg/kg青天葵提取物后,鼠李柠檬素体内处置符合二室模型,约1.5 h达峰,吸收较为迅速;消除半衰期为(8.993±2.568)h,消除较慢;中心室分布容积为(196.122±26.983)L/kg,体内分布广泛。
青天葵药用价值高,野生资源较紧缺,而对其药学的研究多集中在资源、生物学、成分分析及疗效上[6],缺乏物质基础的体内情况报道。本研究以其中代表性成分鼠李柠檬素为指标,初步考察了大鼠口服后的体内运行过程,为青天葵药材的全面质量控制提供生物药剂学指标与方法,也为将来的口服制剂剂型设计、处方筛选、工艺优化和质量评价奠定了基础。
[1]梅全喜.青天葵的资源、栽培与鉴别研究进展[J].中国药房,2008,19(18):1 426-1 428.
[2]邱 莉,徐灵源,廖建华,等.青天葵植物化学成分和药理活性研究进展[J].时珍国医国药,2011,22(9):2 258-2 260.
[3]梅全喜.青天葵的化学成分、药理作用与临床应用研究进展[J].中华中医药学刊,2008,26(10):2 239-2 241.
[4]张 丽,赵钟祥,林朝展,等.青天葵化学成分的研究[J].中药新药与临床药理,2012,23(4):453-455,479.
[5]周燕园,甄汉深,袁叶飞,等.HPLC法测定青天葵中鼠李柠檬素和鼠李秦素[J].中草药,2009,40(7):1 152-1 154.
[6]黄 松,陶 艳,蒋东旭,等.青天葵的药学研究概况[J].时珍国医国药,2007,18(10):2 453-2 454.
