马铃薯块茎休眠解除过程的形态学观察与鉴定
2013-04-13文义凯刘柏林卢蔚雯张宁司怀军王蒂
文义凯,刘柏林,,卢蔚雯,张宁,司怀军,*,王蒂
(1.甘肃农业大学生命科学技术学院,甘肃兰州730070;2.甘肃省干旱生境作物学省部共建国家重点实验室培育基地,甘肃省作物遗传改良与种质创新重点实验室,甘肃农业大学,甘肃兰州730070)
栽培生理
马铃薯块茎休眠解除过程的形态学观察与鉴定
文义凯1,刘柏林1,2,卢蔚雯1,张宁1,司怀军1,2*,王蒂2
(1.甘肃农业大学生命科学技术学院,甘肃兰州730070;2.甘肃省干旱生境作物学省部共建国家重点实验室培育基地,甘肃省作物遗传改良与种质创新重点实验室,甘肃农业大学,甘肃兰州730070)
利用石蜡切片分析了室温储存条件下马铃薯栽培品种‘Favorita’块茎休眠解除过程中的形态组织学变化,并对块茎中的淀粉和蛋白质含量的变化作了研究。结果显示,马铃薯块茎在休眠期芽眼分生组织细胞停止分裂,伴随着休眠的解除,芽眼分生组织细胞开始分裂且分裂速度越来越快,芽原基最终形成一个完整的芽,伴随此过程,观察到芽原基周围部分细胞程序性死亡最终发育形成环纹、螺纹导管的现象;马铃薯块茎从休眠解除到芽的萌发过程中淀粉含量则出现下降且淀粉颗粒逐渐由规则卵圆形变为较小的不规则状,在靠近芽原基的分化部位蛋白质含量有明显上升趋势。室温储存60 d的块茎被认为完全解除休眠。
马铃薯;块茎;休眠;组织学;细胞学
马铃薯(Solanum tuberosum L.)是世界第四大粮食作物,又是重要的蔬菜作物和食品及工业加工原料[1]。马铃薯块茎的休眠与发芽对于马铃薯的种植栽培以及生产加工极为重要[2]。马铃薯种植栽培中,块茎的休眠程度对其出苗率、整齐度和产量均有影响,生产加工上块茎的休眠程度影响着马铃薯的运输储藏以及商品质量和应用价值[3,4]。由于对马铃薯块茎休眠机理了解的欠缺,人工调控技术发展缓慢[5],严重制约了马铃薯种薯生产的发展和块茎作为工业加工原料的充分利用。因此,对马铃薯块茎休眠与发芽的研究显得越来越迫切。研究马铃薯块茎休眠机理,对马铃薯栽培和储藏保鲜等方面也具有很重要的意义[6]。休眠与发芽是马铃薯块茎生长发育过程中的一个阶段,马铃薯块茎成熟收获至发芽的过程中,芽眼分生组织发生一系列的形态改变。确定块茎可见芽萌发前的形态变化,对于鉴定块茎休眠解除所需时间具有重要意义。本试验对马铃薯块茎在休眠解除过程中的形态组织学变化以及淀粉和蛋白质含量变化进行了研究,利用显微技术来判断块茎休眠解除所需要的具体时间。为进一步研究休眠的内部机理,探索工业化控制马铃薯块茎休眠的技术,提供科学的理论依据。
1 材料与方法
1.1 试验材料
1.1.1 材料来源
马铃薯栽培品种‘Favorita’试管苗由甘肃省作物遗传改良与种质创新重点实验室提供。
1.1.2 材料的固定与保存
马铃薯微型薯由甘肃省渭源县田源泽马铃薯良种专业合作社生产。试管苗于2011年7月移栽至温度(22±2)℃、相对湿度60%~70%温室培养,2011年10月收获大小均匀、成熟度一致、重量(3±0.5)g的薯块,室温放置15 d后于黑暗(20±2)℃条件下进行储藏试验,每隔5 d,取形态一致的微型薯3个,采用单面刀片纵切带有芽眼的块茎,置于FAA固定液中固定保存。该处理步骤一直持续到种薯的芽长至5 cm为止。
1.2 试验方法
1.2.1 脱水、透明、浸蜡和包埋
(1)脱水:将用FAA固定液固定好的材料分别在30%、50%、70%、83%、95%和100%各级酒精中进行处理,各自处理2 h,以使材料脱去水分变硬而容易与石蜡更好的融合。
(2)透明:透明剂为二甲苯,先用1/2二甲苯进行过渡处理2 h,再用纯二甲苯处理2 h,以除去在脱水过程浸入的酒精,利于下一步的浸蜡和包埋。
(3)浸蜡:将材料中的二甲苯倒出,留下大约3/4体积,再在石蜡:酒精为3:2的混合液体中在37℃下处理3 d。在56~60℃的恒温箱中用100%的石蜡连续处理3次,时间分别为1 h。
(4)包埋:用100%的石蜡将处理后的材料包埋于特制小盒中,以备切片。
1.2.2 切片及染色
(1)切片:将修好的蜡块用单面刀片修整好,经旋转切片机切片,切片厚度10 μm。将其固定于涂有梅氏蛋清液的载玻片上待用。
(2)脱蜡:用两组染色缸分别对切片进行脱蜡和复水。脱蜡采用1/2二甲苯和二甲苯处理5 min,然后将脱蜡后的切片经各级浓度酒精逐渐下降到水。
(3)染色:组织形态学观察采用番红-固绿二重染色。PAS法做淀粉的组织化学染色,汞-溴酚蓝法做蛋白质的组织化学染色。
(4)石蜡切片的封藏及显微照相:将完成染色的石蜡切片用加拿大树胶封藏并整理好,并在Motic745型数码显微镜下观察并照相。
2 结果与分析
2.1 形态组织学变化分析
收获后室温储藏15 d的休眠块茎(图1),由外向内的结构依次是周皮、表皮、皮层、维管束环和髓部。最外层为周皮,其下2~3层细胞体积较小,形状不规则,排列紧密而彼此镶嵌,为表皮细胞。表皮细胞中未观察到淀粉粒。皮层薄壁组织细胞和髓薄壁组织细胞体积较大,近圆形,细胞壁薄含有丰富的淀粉颗粒。维管束环3~4层细胞将皮层和髓部分开,其间的薄壁细胞不含淀粉粒。芽眼里的芽呈扁平状,分生组织没有细胞分裂的发生(图2)。储藏45 d后,块茎顶端分生组织细胞开始分裂,说明块茎休眠打破,芽眼开始萌动(图3)。顶端原始芽位于表皮层中央,细胞具有液泡,细胞核大,但核仁不明显,其下为亚顶端原始细胞,细胞略成团排列,核仁明显。肋状分生组织细胞5~6列细胞位于亚顶端原始细胞下,细胞较大且排列有序,其液泡化程度较大。周缘分生组织细胞沿顶端外形轮廓排列,细胞相对于肋状分生组织细胞为小,但同样排列有序且紧密。芽生长锥由扁平开始凸起(图3),肋状分生组织细胞由上向下呈明显的细胞下移位现象,并划分出一定的区域梯度。由上向下,细胞首先变得愈狭长,细胞核越小。15 d之后,当转到快速分裂期时,细胞渐趋矩形。随着细胞分裂的加快,细胞体积增大,分化叶原基凸起,当休眠期通过时,生长锥变成半球状,最后形成芽(图4)。在马铃薯块茎储藏60~65 d左右细胞分裂速度可能达到最大值,这时的芽开始快速生长(图5),肉眼可见芽出现,块茎休眠完全解除。在块茎休眠解除初期(储藏45 d后),皮层薄壁组织细胞在接近维管束环处的部分细胞细胞核变大,细胞质变浓(图6),随着芽原基持续分化,核仁消失,细胞伸长,分化成管状分子(图7),块茎芽形成之时,这些管状分子与旁侧毗邻管状分子相连,其壁呈环纹或螺纹加厚,形成导管(图8)。导管分子的分化以维管束环开始,伸入芽中。整个过程中未观察到筛管分化。

图1 储存15 d马铃薯块茎横切(×10)Figure 1 Tuber cross section after 15 d storage(×10)
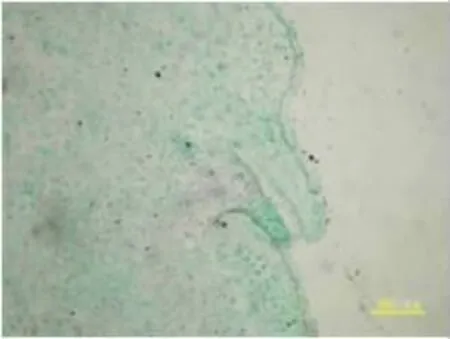
图2 储存15 d芽的变化(×10)Figure 2 Bud growth change after 15 d storage(×10)

图3 储存45 d芽的变化(×10)Figure 3 Bud growth change after 45 d storage(×10)

图4 储存60 d芽的变化(×10)Figure 4 Bud growth change after 60 d storage(×10)

图5 储存65 d芽的变化(×10)Figure 5 Bud growth change after 65 d storage(×10)

图6 储存45 d导管形态(×10)Figure 6 Tuber vessel shape after 45 d storage(×10)
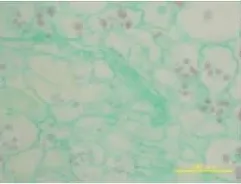
图7 储存60 d导管形态(×10)Figure 7 Tuber vessel shape after 60 d storage(×10)

图8 储存65 d导管形态(×10)Figure 8 Tuber vessel shape after 65 d storage(×10)
2.2 淀粉和蛋白质分布及其消长动态
在进入到马铃薯块茎休眠解除过程中,淀粉和蛋白质的分布和含量会发生一系列的变化。此变化特征与马铃薯块茎芽萌发的解剖特征相一致。

图9 储存15 d淀粉颗粒分布(×40)Figure 9The distribution of starch granules after 15 d storage(×40)图10 储存15 d淀粉颗粒和蛋白质分布(×40)Figure 10The distribution of starch granules and protein after 15 d storage(×40)

图11 储存45 d淀粉颗粒和蛋白质分布(×40)Figure 11The distribution of starch granules and protein after 45 d storage(×40)图12 储存45 d淀粉颗粒、蛋白质和导管分布(×40)Figure 12The distribution of starch granules,protein and vessel after 45 d storage(×40)
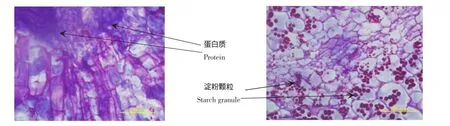
图13 储存60 d蛋白质分布(×40)Figure 13Thedistributionofproteinafter60dstorage(×40)图14 储存60 d淀粉颗粒分布(×40)Figure 14The distribution of starch granules after 60 d storage(×40)
从储藏15 d的休眠块茎中可以看到被染成紫红色的淀粉粒大小一致,呈均匀的圆形或卵圆形,在皮层和髓部的薄壁组织细胞中均匀分布着。近芽眼端的皮层薄壁组织细胞中,淀粉颗粒均匀地围绕着细胞核,含量一致。块茎中的被染成蓝色的蛋白质含量极为稀少(图9,图10)。储藏45 d的马铃薯块茎中,伴随着芽萌发的开始,近芽眼端的皮层薄壁组织细胞中,淀粉颗粒明显变少变小,形状也由圆形和卵圆形变得较为不规则,马铃薯块茎蛋白质的含量也相应的增加。在细胞核周围出现较多蓝色蛋白质,部分细胞中甚至已不存在淀粉粒,表明淀粉颗粒在不断的分解消耗。在皮层薄壁组织部分细胞脱分化形成导管分子时,其原生质中已经完全没有淀粉粒(图11,图12)。当储存至60 d时,由于在芽的萌发过程中,芽眼附近分生组织细胞分裂迅速,需要大量的核酸和蛋白质以及其它的一些营养物质,在芽眼附近这种转化趋势更加明显,淀粉分布及消长动态体现明显的极性。从髓薄壁组织细胞到皮层薄壁组织细胞淀粉粒数量由多到少,体积由大变小,形状变得不规则,呈梯度分布。接近芽和维管束的薄壁组织细胞中已不含淀粉粒(图13,图14)。
3 讨论
3.1 马铃薯块茎芽原基的分化和发育
试验结果表明,马铃薯块茎自收获之日起整个组织的细胞分裂以及物质合成等一系列生命活动并非完全停止,而是一些基因处于被抑制状态,组织的代谢水平也处于一个比较低的水平但生命活动仍在进行并非停止。当休眠开始打破芽开始萌发时,马铃薯块茎芽眼处的顶端分生组织细胞开始分裂,芽生长锥由扁平开始突起,分生组织细胞不但出现由上向下位移的位置变化,而且出现了细胞形态的变化,首先是细胞由上向下变得愈来愈狭长,之后逐渐趋于矩形,直到幼芽的形成。随着马铃薯块茎芽眼处的顶端分生组织细胞开始分裂,皮层薄壁组织细胞部分细胞经过脱分化及细胞程序性死亡过程,构成了环纹导管和螺纹导管。已知环纹导管和螺纹导管直径较小,输水能力较弱,多在器官早起生长过程中出现,本试验的观察结果恰好证实了这一点。由试验观察表明,马铃薯块茎侧芽发生后韧皮部退化、木质部发达,因此推测马铃薯块茎侧芽发生初期主要从皮层和髓部摄取水分和无机营养。
3.2 马铃薯块茎芽原基的分化和发育过程中淀粉和蛋白质的变化动态
马铃薯块茎从休眠到芽的萌发过程中,各种储藏物质发生变化,其中淀粉不断地降解成还原性糖,所以淀粉含量在休眠打破的整个过程中都在不断下降[7]。由于马铃薯块茎在休眠状态下细胞分裂停止,细胞代谢比较缓慢,蛋白质的合成也处于一个比较低的水平,所以在这个过程当中,淀粉含量基本上没什么变化,但是当休眠解除,芽开始萌发时,细胞分裂显著加快,代谢也明显加快,这时需要合成大量的核酸和蛋白质以及一些其他的大分子物质。在芽的萌发过程中,特别是在芽眼附近由于需要大量的蛋白质这种趋势尤为明显。在芽的萌发过程中,也需要大量的能量,这些能量都需要马铃薯的块茎提供,主要是靠糖类的降解来提供,结果导致淀粉因降解在块茎中的含量不断变少。试验结果显示,马铃薯块茎中的淀粉颗粒主要储藏在皮层和髓部的薄壁组织细胞中,在芽的萌发过程中,淀粉粒在靠近芽眼的部位明显减少且淀粉粒大小呈现出明显变小和形态变得不规则的趋势。马铃薯块茎在休眠解除过程中,蛋白质的分布和积累趋势与淀粉的相反。在皮层和髓部的薄壁组织细胞中积累了大量淀粉,芽原基分生组织细胞和维管束环细胞中却不含淀粉粒,而是逐渐积累了丰富的蛋白质。
[1]魏延安.世界马铃薯产业发展现状及特点[J].世界农业,2005 (3):29-32.
[2]高志勇.马铃薯转基因工程研究进展[J].贵州农业科学,2009,37 (1):18-20.
[3]张丽莉,陈伊里,连勇.马铃薯块茎休眠及休眠调控研究进展[J].中国马铃薯,2003,17(6):32-38.
[4]蒲建刚,孙林祥,裴建文,等.脱毒马铃薯微型薯原原种打破休眠试验研究初报[J].甘肃农业科技,1999(7):13-15.
[5]司怀军,张宁,王蒂.马铃薯块茎休眠和发芽的分子机理及调控策略[J].中国马铃薯,2007,21(2):104-107.
[6]王鹏.马铃薯离体块茎休眠生理研究[D].中国农科院,2001.
[7]Loon C D van.The effect of a cold shock on dormancy of potatoes[J]. Potato Research,1983,26(1):79-81.
Observation and Identification of Potato Morphological Changes during Tuber Dormancy Release
WEN Yikai1,LIU Bailin1,2,LU Weiwen1,ZHANG Ning1,SI Huaijun1,2*,WANG Di2
(1.College of Life Science and Technology,Gansu Agricultural University,Lanzhou,Gansu 730070,China; 2.Gansu Provincial Key Laboratory of Aridland Crop Science,Gansu Key Laboratory of Crop Genetics and Germplasm Enhancement,Gansu Agricultural University,Lanzhou,Gansu 730070,China)
The changes in histology,and starch and protein content of potato variety'Favorita'tuber dormancy breaking process were investigated by paraffin section methods.The results showed that tuber eye meristematic tissue cells stopped dividing in dormancy state and started dividing rapidly along with dormancy breaking.Finally,a bud was formed gradually by bud primordium.The partialprogrammed celldeath around bud primordium eventually formed annularvesseland spiralvessel.The content of starch decreased,and ovoid starch granule changed into small irregular one.The protein content increased dramatically around bud primordium during the period of tuber dormancy breaking to sprouting.It is considered that tuber dormancy break completely 60 days afterstorage atroomtemperature.
Solanum tuberosum L.;tuber;dormancy;histology;cytology
S532
A
1672-3635(2013)01-0014-05
2012-07-19
国家自然科学基金项目(30871573和31160298)。
文义凯(1984-),男,硕士,教辅,从事马铃薯遗传育种研究。
司怀军,博士,教授,主要从事马铃薯生物技术和分子生物学研究,E-mail:hjsi@gsau.edu.cn。
