来氟米特对MRL/lpr狼疮鼠疗效及单核细胞趋化蛋白-1的影响*
2013-04-11袁卫东夏云飞曹晓蕾
袁卫东 ,谭 薇 ,夏云飞,曹晓蕾
(1海门市人民医院肾内科,江苏 226100;2南通大学附属医院风湿科;3南通大学医学院)
肾脏是系统性红斑狼疮 (systemic lupus erythematosus,SLE)最常累及的器官之一。研究表明,单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)作为单核细胞特异的趋化因子在狼疮性肾炎(lupus nephritis,LN)发生发展中起到十分重要的作用。LN肾组织中MCP-1高表达是单核细胞浸润的最主要原因,且两者高度相关[1-2]。SLE患者尿MCP-1水平活动期显著高于非活动期[3]。提示MCP-1/CCL2在LN的发生发展中起到十分重要的作用[4-5]。近年来研究表明来氟米特(leflunomide,LEF)用于治疗LN效果显著,可使LN患者临床症状、体征及免疫学指标明显改善[6-7],但对其机制研究目前尚不多见。本文观察了LEF对MRL/lpr鼠的作用及其对MCP-1表达的影响,报告如下。
1 材料和方法
1.1 实验动物及分组 MRL/lpr狼疮小鼠16只,雌性,7~8 周龄,体重 20±2g,均饲养于南通大学动物实验中心SPF屏障环境。随机分为2组:LEF组(LEF,n=8)、对照组(Con,n=8)。LEF 组于 16 周予以含LEF(35mg/kg·d)的0.5%羧甲基纤维素水灌胃8周,对照组予同体积的0.5%羧甲基纤维素水灌胃8周,于第25周处死所有动物。
1.2 尿蛋白、抗ds-DNA抗体、血清肌酐测定 于10、20、24周时代谢笼留取小鼠24h尿量,考马斯亮蓝法测定尿蛋白含量。25周时测定抗ds-DNA抗体、血清肌酐,按ELISA试剂盒说明书操作。
1.3 肾脏病理检查 将部分肾组织予10%中性甲醛溶液固定、脱水、石蜡包埋、HE染色。观察肾小球数、肾小球硬化数、新月体数、是否存在肾小球血管袢内血栓形成及毛细血管袢坏死等。采用双盲法观察每张切片上100个肾小球中新月体的数量,计算新月体形成率,以评价LN的严重程度[8]。新鲜肾组织OCT包埋后,切片5μm,直接免疫荧光法检测IgG、IgM沉积。
1.4 血液、尿液MCP-1测定 PBS缓冲液洗板2次,在包被有抗MCP-1单克隆抗体的酶联板孔内分别加入标准品或1∶5稀释待检样品,每孔100μL。每孔中加入HRP结合物50μL;室温孵育2 h。洗板3次后每孔加入100μL TMB/底物溶液,避光室温孵育10 min,每孔加入100μL终止液;读取620 nm波长处A值。
1.5 Western Bolt测定肾脏组织MCP-1 新鲜肾组织OCT包埋后,切片5μm,SP法进行MCP-1免疫组化。取小鼠肾脏皮质组织100mg,充分研磨成粉末状,加入蛋白酶抑制剂、蛋白质裂解缓冲液。离心、取上清液提取抗原,并测定蛋白浓度,调整浓度后加样电泳分离蛋白并转移到硝酸纤维素膜上,加脱脂奶粉封闭,再加入抗鼠MCP-1一抗过夜,PBS冲洗15min,置于 1∶5000 二抗,室温反应 1h,PBS 冲洗后暗室显影,待胶片晾干后扫描仪扫描,分析其灰度。
1.6 逆转录多聚酶链反应 (Rt-PCR) 根据Gen-Bank提供的MCP-1、GAPDH基因序列,应用Primer 5.0软件设计引物如下:MCP-1正向引物:5'-AGAAACCAGCCAACTC-3',反向引物:5'-GCTACAGGCAGCAACT-3',片断长度 103bp。GAPDH正向引物:5'-ATCGTGGAAGGGCTAATG-3',反向引物:5'-GGATGATGTTCTGGTGGG-3',片断长度115 bp。肾脏组织研磨后Trizole法提取mRNA并用紫外分光光度计测定OD260/OD280值,计算RNA含量,使用Rt-PCR Kit进行逆转录反应,合成CDNA。进行PCR反应,总反应体系20μL。内含:10μL 2×QuantiTect SYBR Green I RT-PCR Master Mix;上游引物、下游引物(10μmol/μL)各 1μL,0.2μL Quanti-Tect RTMix;模板 1μL;6.8μL 无 RNase水。反应条件为:50℃ 20min(×1),95 ℃ 10min(×1),94 ℃ 15s →49.5℃ 20s→72℃ 30s(×45)。对反应产物进行1%琼脂糖凝胶电泳。在凝胶成像系统中拍摄照片并予灰度扫描,将目的基因MCP-1与GAPPH的灰度进行对比,所得的比值为目的基因的相对表达量。
1.7 统计学处理 采用SPSS 13.0统计软件进行统计数据处理,计量资料以表示,多个样本组间差异性比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 LEF对MRL/lpr鼠24h尿蛋白定量、抗ds-DNA抗体滴度及肌酐的影响 对照组MRL/lpr鼠从16周龄开始,尿蛋白逐渐升高。治疗4周后LEF组尿蛋白显著较对照组减少。20周时LEF组尿蛋白水平(1.73±1.32mg)低于对照组(3.9±2.34mg),两组比较差异有统计学意义 (P<0.05);24周时,LEF组尿蛋白水平(1.62±1.25mg)显著低于对照组(5.75±2.33mg),两组比较差异有统计学意义(P<0.01)。25周时,LEF组抗 ds-DNA 抗体滴度(39.19±15.77×102 IU/mL)较对照组(69.96±32.77×102 IU/mL)显著降低,两组比较差异有统计学意义(P<0.05)。25周时,血清肌酐浓度LEF组(6.95±3.37μmol/L)与对照组(11.50±2.39μmol/L)相比,差异有统计学意义(P<0.05)。
2.2 LEF对MRL/lpr鼠肾脏病理变化的影响 LEF组光镜下可见:肾小球硬化及间质纤维化程度显著减轻,系膜细胞、系膜基质轻度到中度增生、局灶性硬化、肾间质炎症细胞浸润减轻(图1)。LEF组新月体形成率(0.11±0.05)显著较对照组(0.21±0.07)降低(P<0.05)。免疫荧光结果显示:IgG、IgM 主要沉积于系膜下、上皮上、内皮下。LEF组IgG及IgM沉积显著较对照组减少(图2)。对照组小鼠肾脏光镜下可见:肾小球硬化,肾小球系膜细胞大量增殖、系膜基质增宽,新月体形成,肾间质内有大量的炎性细胞浸润。

图1 LEF治疗对MRL/lpr鼠的肾脏病理的影响(HE×300)

图2 LEF治疗对 MRL/lpr鼠的肾脏 IgG、IgM沉积的影响(300×)
2.3 LEF对 MRL/lpr鼠血清、尿液MCP-1的影响25周时LEF组血清MCP-1水平较对照组降低 (P<0.05)。24周时LEF组尿液MCP-1水平与对照组差异有统计学意义(P<0.05),见表 1。
表1 LEF对MRL/lpr小鼠血液及尿液MCP-1浓度的影响(,pg/mL)

表1 LEF对MRL/lpr小鼠血液及尿液MCP-1浓度的影响(,pg/mL)
与对照组比较,*P<0.05
血清MCP-1 尿液MCP-11099.31±391.72 342.70±165.34*对照组 8 1325.45±352.28 487.72±194.57
2.4 LEF对MRL/lpr鼠肾脏MCP-1表达的影响MCP-1主要定位于肾小球系膜区、肾间质炎性细胞浸润处肾小管细胞边缘和肾小管腔内。LEF组MCP-1表达较对照组显著减弱(图3)。
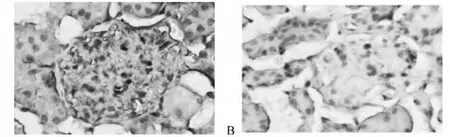
图3 LEF治疗对MRL/lpr鼠肾脏MCP-1表达的影响(SP,1200×)
2.5 LEF对MRL/lpr鼠肾脏MCP-1蛋白表达的影响 LEF组肾脏中MCP-1蛋白表达显著低于对照组,两组比较差异有统计学意义(P<0.05);LEF组MCP-1相对表达量 0.40±0.02,Con组 MCP-1相对表达量 0.79±0.15,见图 4。
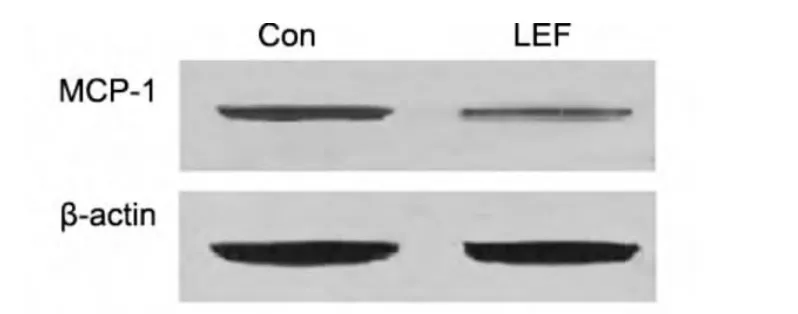
图4 LEF治疗对MRL/lpr鼠肾脏MCP-1蛋白表达的影响
3 讨 论
LEF通过可逆性抑制嘧啶核苷酸从头合成途径的限速酶,从而阻断限速嘧啶核苷酸的从头合成,进而抑制细胞内DNA及RNA的合成,抑制T、B淋巴细胞增生,减少免疫球蛋白产生,LEF还具有抑制蛋白酪氨酸激酶磷酸化的作用[9]。我们研究发现来氟米特干预后可使MRL/lpr小鼠尿蛋白减少,血清肌酐水平降低,肾组织病理改变,提示来氟米特治疗MRL/lpr小鼠LN有效,与Bartlett等[10]报道一致。
合成和分泌MCP-1的细胞有多种,其中单核细胞、巨噬细胞、内皮细胞是分泌MCP-1的主要来源,肾组织内的系膜细胞也可合成和分泌MCP-1[11]。MCP-1是一种低分子量的趋化因子,CCR2是MCP-1的受体,MCP-1与CCR2结合后可通过激活细胞内信号转导通路,从而导致细胞迁移等生物学行为的改变。体外研究发现,MCP-1能诱导单核巨噬细胞的趋化和激活,抗MCP-1抗体能抑制单核巨噬细胞的趋化与激活[12-13]。MCP-1是LN肾脏炎症细胞浸润重要信号[14],介导炎症细胞在肾炎中迁移、募集及组织的损伤[15],促进肾间质的损害及肾小球新月体形成[16]。表达MCP-1的MRL/lpr鼠肾小管中聚集有大量巨噬细胞和T细胞,而MCP-1缺陷的MRL/lpr小鼠肾小管中仅有少量T细胞、巨噬细胞,且其肾脏病变程度较轻,尿蛋白减少、生存期显著延长[5]。Zoja等[17]研究发现随着肾炎的进展,MRL/lpr鼠MCP-1mRNA的表达显著增加,与单核细胞的浸润程度呈正相关。Hitoshi等[18]研究发现抗MCP-1抗体能够减轻和延缓MRL/lpr狼疮鼠LN的发生和进展。这些结果均提示MCP-1在MRL/lpr鼠LN的形成中起到十分重要的作用。
本研究发现LEF能显著降低MRL/lpr鼠血清、尿液中MCP-1的表达,减少肾脏组织中的MCP-1的表达和炎性细胞的浸润。提示LEF可通过抑制MCP-1的表达而发挥治疗LN的作用,其机制有待进一步明确。
[1]Grandalia o G,Gesualdo L,Ranieri E,et al.Monocyte chemotactic peptide-1 expression in acute and chronic human nephritides:a pathogenetic role in interstitial monocytes recruitment[J].J Am Soc Nephrol,1996,7(6):906-913.
[2]Wada T,Yokoyama H,Su SB,et al.Monitoring urinary levels of monocyte chemotactic and activating factor reflects disease activity of lupus nephritis[J].Kidney Int,1996,49(3):761-767.
[3]Noris M,Bernasconi S,Casiraghi F,et al.Monocyte chemoattractant protein-1 is excreted in excessive amounts in the urine of patients with lupus nephritis[J].Lab Invest,1995,73(6):804-809.
[4]Lima G,Soto-Vega E,Atisha-Fregoso Y,et al.MCP-1,RANTES,and SDF-1 polymorphisms in Mexican patients with systemic lupus erythematosus[J].Hum Immunol,2007,68(12):980-985.
[5]Tesch GH,Maifert S,Schwarting A,et al.Monocyte chemoattractant protein 1-dependent leukocytic infiltrates are responsible for autoimmune disease in MRL-Fas(lpr)mice[J].J Exp Med,1999,190(12):1813-1824.
[6]Zhang FS,Nie YK,Jin XM,et al.The efficacy and safety of leflunomide therapy in lupus nephritis by repeat kidney biopsy[J].Rheumatol Int,2009,29(11):1331-1335.
[7]Wang HY,Cui TG,Hou FF,et al.Induction treatment of proliferative lupus nephritis with leflunomide combined with prednisone:a prospective multi-centre observational study[J].Lupus,2008,17(7):638-644.
[8]Gu Z,Akiyama K,Ma X,et al.Transplantation of umbilical cord mesenchymal stem cells alleviates lupus nephritis in MRL/lpr mice[J].Lupus,2010,19(13):1502-1514.
[9]Li WD,Ran GX,Teng HL,et al.Dynamic effects of leflunomide on IL-1,IL-6,and TNF-alpha activity produced from peritoneal macrophages in adjuvant arthritis rats[J].Acta Pharmacol Sin,2002,23(8):752-756.
[10]Bartlett RR,Popovic S,Raiss RX.Development of autoimmunity in MRL/lpr mice and the effects of drugs on this murine disease[J].Scand J Rheumatol Suppl,1988,75:290-299.
[11]Colotta F,Sciacca FL,Sironi M,et al.Expression of monocyte chemotactic protein-1 by monocytes and endothelial cells exposed to thrombin[J].Am J Pathol,1994,144(5):975-985.
[12]Maus U,Henning S,Wenschuh H,et al.Role of endothelial MCP-1 in monocyte adhesion to inflamed human endothelium under physiological flow[J].Am J Physiol Heart Circ Physiol,2002,283(6):H2584-H2591.
[13]Maslin CL, Kedzierska K, Webster NL, et al.Transendothelial migration of monocytes:the underlying molecular mechanisms and Consequences of HIV-1 infection[J].Curr HIV Res,2005,3(4):303-317.
[14]Zoja C,Liu XH,Donadelli R,et al.Renal expression of monocyte chemoattractant protein-1 in lupus autoimmune mice[J].J Am Soc Nephrol,1997,8(5):720-729.
[15]Adams DH,Shaw S.Leucocyte-endothelial interactions and regulation of leucocyte migration[J].Lancet,1994,343(891):831-836.
[16]Wada T,Furuichi K,Segawa-Takaeda C,et al.MIP-1alpha and MCP-1 contribute to crescents and interstitial lesions in human crescentic glomerulonephritis[J].Kidney Int,1999,56(3):995-1003.
[17]Zoja C,Corna D,Benedetti G,et al.Bindarit retards renal disease and prolongs survival in murine lupus autoimmune disease[J].Kidney Int,1998,53(3):726-734.
[18]Hasegawa H,Kohno M,Sasaki M,et al.Antagonist of monocyte chemoattractant protein 1 ameliorates the initiation and progression of lupus nephritis and renal vasculitis in MRL/lpr mice[J].Arthritis Rheum,2003,48(9):2555-2566.
