添加外源纤维水解酶对羊草体外瘤胃发酵酶活性及特性的影响
2013-04-10庄苏丁立人周建国王恬
庄苏,丁立人,周建国,王恬
(南京农业大学动物科技学院,江苏 南京210095)
在反刍动物生产中,有关外源酶制剂应用一直存在着不少争议。因为瘤胃内蛋白质水解菌能分解外源酶(如植物细胞壁水解酶类)而使之失活[1],同时瘤胃微生物能分泌蛋白酶、淀粉酶、纤维素酶等多种酶类,并且各种酶活性很高[2],因此无需额外添加外源酶制剂。但是,随着酶制剂技术的发展,人们除了重视外源酶在单胃动物生产中应用研究外也开始关注外源酶制剂在反刍动物生产中的应用研究。研究表明,某些纤维素酶、半纤维酶与蛋白酶一起培养时能保持稳定酶活,并在瘤胃内稳定生存[3];外源酶制剂能够增加瘤胃微生物在饲料颗粒上的附着并增加饲料降解率[4];Morgavi等[5]发现由长梗木霉(Trichodermalongibrachiatum)产生的酶能与瘤胃内酶一起协同地从玉米(Zeamays)青贮中释放更多的还原糖;同样外源纤维水解酶能改善动物生产性能[6,7]。即便如此,外源酶制剂在反刍动物生产应用研究还不够深入,对其作用机理认识还不够全面。就目前研究现状而言,更多研究集中在外源酶制剂如何处理粗饲料(如作为青贮饲料添加剂)上[8,9],有关外源酶制剂的处理时间、添加剂量以及外源酶对内源酶活性的影响研究相对较少,国内在这方面研究仅处于起步阶段。本试验以羊草为底物,利用体外法研究不同剂量纤维酶与木聚糖酶、不同处理时间与瘤胃液共培养对发酵液中纤维素酶与葡聚糖酶活性与发酵特性的影响,旨在为丰富外源纤维水解酶在反刍动物中的应用提供一些理论依据。
1 材料与方法
1.1 试验材料与时间
酶制剂为国产纤维素酶(40 000U/g)与木聚糖酶(42 000U/g)产品。使用时,用去离子水配制成各含10与50mg/mL纤维素酶与木聚糖酶混合酶液。发酵底物为羊草(Aneurolepidiumchinense)草粉。试验于2009年10月在南京农业大学动物科技学院反刍动物营养研究室进行。
1.2 瘤胃液采集
选取5只体况良好、体重35~40kg装有永久瘤胃瘘管的本地阉割山羊用于瘤胃液供体。试验羊圈养,适量补饲精料(玉米∶豆粕=7∶3),自由采食青干草与饮水。瘤胃液采集当日,在饲喂后2h,经瘤胃瘘管分别从5头山羊的瘤胃腹囊下部抽取含内容物的瘤胃液,放入经39℃预热并充满CO2的保温瓶中,立即返回实验室,用4层纱布分离内容物,滤液作为混合瘤胃微生物接种物,整个过程在厌氧条件下进行。
1.3 缓冲液制备
缓冲液参照Russel和Martin[10]的配方制备。将缓冲液装入广口瓶中,加入1%刃天青数滴,通CO2直至缓冲液呈无色为止,此时表示已达到厌氧条件。
1.4 接种液配制
将缓冲液预热至39℃,在厌氧条件下按缓冲液与瘤胃液为4∶1(V/V)制备接种液。制备完成后立即使用。
1.5 试验设计
试验共设6组。分组如下:24h酶处理组,分别称取2.0g羊草装入150mL发酵瓶内,然后用注射器在羊草上均匀地喷洒含酶剂量为0,10.0与50.0mg/mL酶液1mL,3组分别标记为24-0,24-10与24-50,并置于20℃培养箱中处理24h后,向瓶内注入CO2排除空气,接着向瓶内加入预热至39℃接种液50mL,整个过程伴随CO2通入以维持厌氧条件,分装完毕后迅速盖上异丁基橡胶塞密封,并以铝盖固定封口,最后置于39℃下培养。另3组为0h酶处理组:在装入2.0g羊草瓶内均匀地喷洒酶剂量为0,10.0与50.0mg/mL酶液1mL,3组分别标记为0-0,0-10与0-50,通入CO2后直接加入接种液,余下操作同24h处理组。每组设3个重复。
1.6 样本采集与处理
在4,6,8,12,24,36,48h培养时间点分别从每组中取出3个发酵瓶用气压转换仪测定产气量并计算累积产气量,同时对其他发酵瓶进行放气处理,所有操作过程均在39℃条件下进行。在0(接种后立即采样),8,24,48h培养时间点分别从每组中取出3个发酵瓶,打开瓶盖立即测定发酵液pH值,然后将发酵瓶内全部内容物倒入尼龙袋(200目,孔径0.074mm)分离发酵液与内容物。发酵液分装于3个10mL离心管中,置于-20℃冰柜中用于后期酶活性与挥发性脂肪酸(VFA,volatile fatty acid)测定。每次取样后该时间点发酵瓶弃用。
1.7 样品测定与方法
分别以浓度为20mg/mL的燕麦木聚糖(X-0627购自Sigma)、羧甲基纤维素钠(国产)与Avicel PH101(购自Fluka)溶液用于木聚糖酶、内切葡聚糖酶与外切葡聚糖酶酶活测定底物。在pH 6.0和50℃条件下反应30min测定酶活力[11]。酶活(U)定义为此测定条件下1min内释放1nmol的木糖或葡萄糖所需的酶量为1个酶活单位。
岛津GC-14B气相色谱仪测定VFA含量[12]并略作改进。
1.8 数据处理
试验数据经Excel 2003初步整理后,采用SPSS 13.0统计软件中GLM模块中Multivariate进行方差分析,检验预处理时间、酶剂量、预处理时间与酶剂量间的互作效应。对同一时间点数据采用One-way ANOVA中Duncan’s法进行多重比较,显著水平置于0.05。结果用平均数与平均标准误表示。
2 结果与分析
2.1 纤维水解酶对体外发酵液木聚糖酶活性的影响
在0h,酶量、处理时间显著影响木聚糖酶酶活(P<0.05);两者互作效应为0.092(表1)。在8h,酶量显著影响木聚糖酶活性(P<0.05);高剂量酶组酶活均显著高于其他处理组(P<0.05),而处理时间对酶活的影响不显著(P=0.127),酶量与处理时间无互作效应。在24与48h,酶量与处理时间效应、酶量与处理时间互作效应均不显著(P>0.05);但在24h,24h处理的高剂量组酶活高于无酶组与0h处理的高剂量组(P<0.05)。
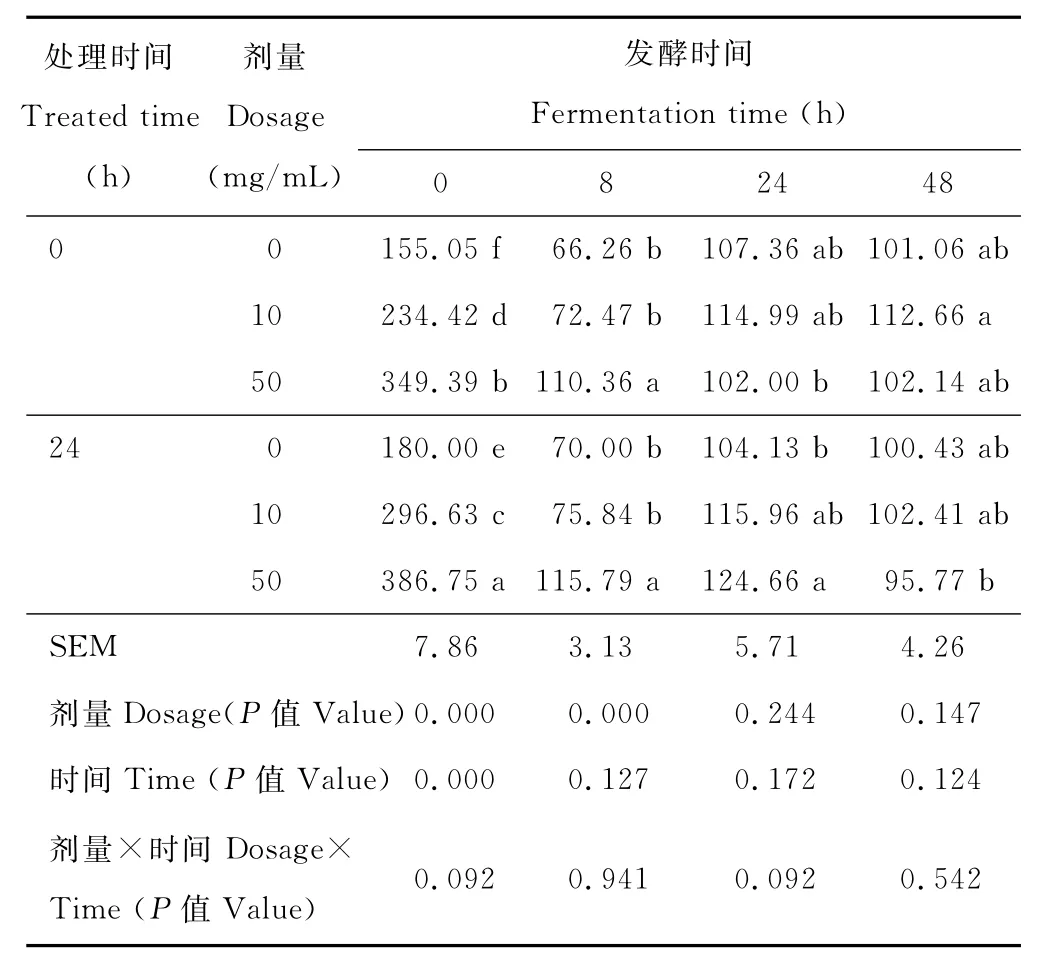
表1 纤维水解酶对体外发酵液中木聚糖酶活性的影响Table 1 Effect of the fibrolytic enzymes on xylanase activity in vitro nmol/(min·mL)
2.2 纤维水解酶对体外发酵液内切、外切葡聚糖酶活性的影响
在0与8h,酶量与处理时间均显著影响内切葡聚糖酶活性(P<0.05)(表2);其中0h时间点,两者存在互作效应(P<0.05);高剂量显著增加内切葡聚糖酶活性(P<0.05)。与0h比较,8h内切葡聚糖酶活性大幅下降,下降幅度在65.52%~73.12%。当发酵至24与48h,酶量、预处理时间效应以及两者间的互作效应均不显著(P>0.05)。
在0h,酶量、处理时间显著影响发酵液中外切葡聚糖酶活性 (P<0.05);剂量与处理时间具有一定的互作效应(P=0.06);24h酶处理组发酵液中外切葡聚糖酶活性显著高于其他各组(P<0.05)。在发酵8h,仅处理时间对酶活性产生显著影响(P<0.05)。发酵24与48h,酶量、处理时间及两者间互作效应均不显著 (P>0.05)。

表2 纤维水解酶对体外发酵液中葡聚糖酶活性的影响Table 2 Effect of the fibrolytic enzymes on glucanase activity in vitro nmol/(min·mL)
2.3 纤维水解酶对体外发酵液挥发性脂肪酸含量的影响
在0h点,发酵液中乙酸含量在22.19~22.61mmol/L(表3),酶量、处理时间效应、酶量与处理时间互作效应对乙酸含量均无显著影响(P>0.05)。当发酵至8h,外源酶具有增加乙酸含量作用的趋势(P=0.091);而处理时间效应、酶剂量与处理时间互作效应不显著(P>0.05)。在24与48h,添加酶剂量显著增加发酵液中乙酸含量(P<0.05),50mg酶处理组均显著高于无酶组(P<0.05);处理时间对乙酸产量没有影响并且酶剂量与处理时间之间没有互作效应(P>0.05)。
丙酸含量显示,在0h,酶剂量、处理时间效应、酶剂量与处理时间互作效应均不显著影响丙酸含量(P>0.05)。在8与24h,外源酶有增加发酵液中丙酸含量的趋势并有剂量效应 (P=0.055与P=0.052)。发酵48 h,各组丙酸含量无显著性差异(P>0.05)。
在8h,添加酶制剂显著提高丁酸含量 (P<0.05)。在其他各时间点,酶剂量、处理时间效应及两者的互作效应均不显著(P>0.05)。
除0h外,添加外源酶显著地增加总VFA含量(P<0.05),而处理时间效应、酶剂量与处理时间的互作效应不显著(P>0.05)。
外源酶添加量与预处理时间并不影响发酵液中戊酸与异戊酸含量 (P>0.05)。

表3 纤维素水解酶对体外发酵液中VFA含量的影响Table 3 Effect of the fibrolytic enzymes on VFA content in vitro mmol/L
2.4 纤维水解酶对体外发酵体系中pH值与产气量的影响
在发酵8与24h,酶剂量效应、酶剂量与处理时间互作效应显著影响发酵液pH值 (P<0.05)(表4)。发酵结束时,处理时间显著影响pH值(P<0.05)。产气量分析,酶量、处理时间显著影响48h累积产气量(P<0.05),但两者没有互作效应(P=0.954)。

表4 纤维素水解酶对体外发酵体系中pH值与总产气量的影响Table 4 Effect of the fibrolytic enzymes on pH value and cumulative gas production in vitro
3 讨论
3.1 外源酶制剂对体外瘤胃发酵酶活的影响
在反刍动物日粮中添加外源酶制剂能够增加饲料消化率和动物生产性能[13-15]。外源酶制剂作用机理归类为3个方面:首先,采食前外源酶预处理饲料以增加底物消化率[16];其次,在瘤胃内外源酶直接或间接与瘤胃微生物协同作用分解饲料底物[5];第三,外源酶增强后段消化道的消化能力[17]。在反刍动物应用中,外源酶无论通过何种作用途径产生效果,其关键点是外源酶能否抵抗瘤胃微生物降解。本研究发现,羊草经过0或24h混合酶处理后与瘤胃液共培养,在起始点,添加外源酶能显著增加培养液中木聚糖酶、内切葡聚糖酶和外切葡聚糖酶活性,且效果与酶添加量、处理时间相关(P<0.05)。培养至8h,添加高剂量外源酶分别提高发酵液木聚糖酶与内切葡聚糖酶活性65%与20%,结果与在生长母牛瘤胃中直接投放多糖酶分别提高瘤胃内木聚糖酶与内切葡聚酶活性67%与20%[18]以及绵羊瘤胃液中内切葡聚酶活性51%与木聚糖酶活性34%[19]结果基本一致。随着发酵时间延长(24或48h),外源酶作用效应消失。试验结果与Colombatto等[20]发现的外源酶能增加早期(前6h)体外发酵液中木聚糖酶、内切葡聚糖酶及β-D-葡聚糖苷酶活性,但不能提高48h酶活性结果一致。综合分析认为,在培养起始阶段,由于添加外源酶,培养体系中葡聚糖酶与木聚糖酶瞬间得到提高;当培养到8h,添加外源酶也能增加培养体系纤维水解酶活性,这说明本次使用的外源酶制剂在一定时间内能抵抗微生物降解并保持活性。前人试验证明木聚糖酶能够抵抗蛋白酶的水解[21],纤维水解酶不被瘤胃微生物降解失活[22-24]。因此,本试验结果与上述研究基本一致。除纤维水解酶外,外源蛋白酶也能增加瘤胃内木聚糖酶与内切葡聚糖酶活性,增加纤维素在瘤胃中降解[25]。由此可以得出,外源酶在反刍动物中应用是可行的。
3.2 外源酶制剂对体外瘤胃发酵挥发性脂肪酸含量的影响
为了获得有效的饲料消化率,在动物采食前将饲料与酶进行预处理是必要的,但并非是必须的。Lewis等[16]试验表明,外源纤维水解酶无论是采食前24h还是0h处理粗饲料,整个消化道干物质、中性洗涤纤维与酸性洗涤纤维消化率均显著提高。在采食后16h,酶处理组瘤胃液中总挥发性脂肪酸含量显著高于无酶组,但与酶处理时间关系不大。有人认为酶与饲料可形成一个稳定的酶-饲料复合体[7],改变植物纤维结构[26],继而释放更多的还原糖,有利于增加奶牛瘤胃中纤维二糖利用菌、木聚糖水解菌以及淀粉水解菌的数量[27],最终影响瘤胃发酵与产物的生成。Krzysztof和Magdalena[28]报道纤维水解酶能提高奶牛瘤胃液TVFA含量以及不同组分脂肪含量,但对乙酸丙酸比及各类型脂肪酸占总脂肪酸比例没有影响。Giraldo等[29]体外试验表明外源酶能显著增加瘤胃中VFA产量(P<0.05),其中乙酸占到增加量50%。而Giraldo等[19]研究发现直接投饲外源纤维素酶并不影响绵羊瘤胃液中TVFA量,但是显著提高丙酸的摩尔比例,降低乙酸与丙酸比(P<0.05)。综合体内试验[18,30,31]与体外试验[32]研究结果,纤维水解酶对不同类型饲料可产生不同的VFA摩尔比例,日粮特性以及外源酶的类型均能影响瘤胃发酵类型。本研究发现,外源酶添加剂量直接影响培养液中VFA生成量,显著影响24与48h发酵液中乙酸生成量及8,24与48hTVFA生成量(P<0.05),而VFA产量与酶处理时间关系不大。结果提示外源酶对乙酸的生成量影响程度远高于对丙酸与丁酸生成程度,而对戊酸与异戊酸的含量没有影响。分析原因这可能是添加外源酶后,增加前期发酵液中木聚糖酶与内切葡聚糖酶活性,有利于底物中半纤维素与纤维素的水解,从而增加了乙酸菌生长所需的底物,断而增加乙酸产量。但是能否增加培养体系中乙酸菌数量还需进一步研究。从培养液pH值变化情况可知,pH值下降与培养液中VFA含量增加同步。
除酶活性与VFA产量等指标外,产气量则是体外发酵程度的另一个重要指标。Wallace等[33]评价了2种商业纤维水解酶与瘤胃液共培养对玉米青贮与牧草青贮发酵特性的影响,结果显示,在前8h发酵期,外源酶线性地增加产气量。Tang等[34]试验表明纤维水解酶与酵母发酵物能够改善谷物秸秆的发酵过程,酵母培养物显著地增加累积产气量,纤维水解酶则倾向增加累积产气量。本试验结果也表明,添加外源酶能够显著地提高最终累积产气量,且产气量与外源酶添加剂量呈显著相关。结合酶活性与VFA产量结果分析,可以推测由于外源纤维水解酶添加增加培养液中纤维水解酶活性,从而加速底物的水解速度,继而增加培养液中还原糖生成量,这为瘤胃微生物提供更好营养源,最终结果是增加了培养体系中总VFA产量。
4 结论
用外源纤维水解酶处理羊草后与瘤胃液共培养能够显著地提高发酵早期(前8h)反应体系中木聚糖酶、内切葡聚糖酶与外切葡聚糖酶活性,提高反应体系中VFA产量以及改善瘤胃发酵特性。
[1] 刁其玉.酶制剂在反刍动物日粮中应用研究进展[J].饲料与畜牧,2010,3:15-17.
[2] 冯仰廉.反刍动物营养学[M].北京:科学出版社,2004:2-64.
[3] Hristov A N,McAllister T A,Chen K J.Stability of exogenous polysaccharide-degrading enzymes in the rumen[J].Animal Feed Science and Technology,1998,76:161-168.
[4] Yang W Z,Beauchemin K A,Rode L M.Effects of an enzyme feed additive on extent of digestion and milk production of lactating dairy cows[J].Journal of Dairy Science,1999,82(2):391-403.
[5] Morgavi D P,Beauchemin K A,Nsereko V L,etal.Synergy between ruminal fibrolytic enzymes and enzymes fromTrichodermalongibrachiatum[J].Journal of Dairy Science,2000,83(6):1310-1321.
[6] Beauchemin K A,Rode L M,Sewalt V J H.Fibrolytic enzymes increase fiber digestibility and growth rate of steers fed dry forages[J].Canada Journal of Animal Science,1995,5:641-644.
[7] Kung L J,Treacher R J,Nauman G A,etal.The effect of treating forages with fibrolytic enzymes on its nutritive value and lactation performance of dairy cows[J].Journal of Dairy Science,2000,83(1):115-122.
[8] 陈鑫珠,庄益芬,张建国,等.生物添加剂对水葫芦与甜玉米秸秆混合青贮品质影响[J].草业学报,2011,20(6):195-202.
[9] Colombatto D,Mould F L,Bhat M K,etal.Invitroevaluation of fibrolytic enzymes as additives for maize(ZeamaysL.)silage II.Effects on rate of acidification,fibre degradation during ensiling and rumen fermentation[J].Animal Feed Science and Technology,2004,111:129-143.
[10] Russel J B,Martin S A.Effects of various methane inhibitors on the fermentation of amino acids by mixed rumen microorganismsinvitro[J].Journal of Animal Science,1984,59:1329-1338.
[11] Wood T M,Bhat M K.Methods for Measuring Cellulase Activities.Methods in Enzymology[M].In:Wood W A,Kellogg S T.London,UK:Academic Press Inc.,1988:87-111.
[12] 秦为琳.应用气相色谱测定瘤胃液挥发性脂肪方法的研究改进[J].南京农学院学报,1982,4:110-116.
[13] Arriola K G,Kim S C,Staples C R,etal.Effect of fibrolytic enzyme application to low-and-concentrate diets on the performance of lactating dairy cattle[J].Journal of Dairy Science,2011,94(2):832-841.
[14] Arriola K G,Adesogan A T,Kim S C,etal.Effect of fibrolytic enzyme application to diets differing in concentrate proportion on the performance of lactating dairy cattle[J].Journal of Animal Science,2007,85(Suppl 1):304.
[15] House B P,Holden L,Varga G A.Effects of Bovazyme WPTMon microbil efficiency and metabolism in contunousculture of remen contents[J].Journal of Animal Science,2007,85(Suppl 1):301.
[16] Lewis G E,Hunt C W,Sanchez W K,etal.Effect of direct-fed fibrolytic enzymes on the digestive characteristics of a forage-based diet fed to beef steers[J].Journal of Animal Science,1996,74(12):3020-3028.
[17] Beauchemin K A,Yang W Z,Rode L M.Effects of grain source and enzymen additive on site and extent of nutrient in dairy cows[J].Journal of Dairy Science,1999,82(2):378-390.
[18] Hristov A N,McAllister T A,Cheng K J.Intraruminal supplementation with increasing levels of exogenous polysaccharidedegrading enzymes:Effects on nutrient digestion in cattle fed a barley grain diet[J].Journal of Animal Science,2000,78:477-487.
[19] Giraldo L A,Tejido M L,Ranilla M J,etal.Influence if direct-fed fibrolytic enzymes on diet digestibility and ruminal activity in sheep fed a grass hay-based diet[J].Journal of Animal Science,2008,86(7):1617-1623.
[20] Colombatto D,Mould F L,Bhat M K,etal.Influence of fibrolytic enzymes on the hydrolysis and fermentation of pure cellulose and xylan mixed ruminal microorganismsinvitro[J].Journal of Animal Science,2003,81(4):1040-1050.
[21] Fontes C M,Hall J G A,Hirst B H,etal.The resistance of cellulases and xylanases to proteolytic inactivation[J].Applied Microbiology and Biotechnology,1995,43(1):52-57.
[22] Hirstov A,McAllister T A,Cheng K J.Effect of dietary or abomasal supplementation of exogenous polysaccharide-degrading enzymes on rumen fermentation and nutrient digestibility[J].Journal of Animal Science,1998,76(12):3146-3156.
[23] Morgavia D P,Newbold C J,Beever D E,etal.Stability and stabilization of potential feed additive enzymes in rumen fluid[J].Enzyme and Microbial Technology,2000,26(2-4):171-177.
[24] Morgavi D P,Beauchemin K A,Nsserko V L,etal.Resistance of feed enzymes to proteolytic inactivation by rumen microorganisms and gastrointestinal enzymes[J].Journal of Animal Science,2001,79(6):1621-1630.
[25] Eun J S,Beauchemin K A.Effects of a proteolytic feed enzyme on intake,digestion,ruminal fermentation,and milk production[J].Journal of Dairy Science,2005,88(6):2140-2153.
[26] Nsereko V L,Morgavi D P,Rode M,etal.Effects of fungal enzyme preparations on hydrplysis and sybsequent degradation of alfalfa hay fiber by mixing rumen microorganisms in viro[J].Animal Feed Science and Technology,2000,88:153-170.
[27] Nsereko V L,Beauchemin K A,Morgavi D P,etal.Effect of a fibrolytic enzyme preparation fromTrichodermalongibrachiatumon the rumen microbial population of dairy cows[J].Canadian Journal of Microbiology,2002,48(1):14-20.
[28] Krzysztof B,Magdalena L R.Effect of adding fibrolytic enzymes to dairy cow rations on digestive activity in the rumen[J].Annals of Animal Science,2010,10(2):127-137.
[29] Giraldo L A,Tejido M L,Ranilla M J,etal.Effects of exogenous cellulase supplementation on microbial growth and ruminal fermentation of a high-forage diet in Rusitec fermenters[J].Journal of Animal Science,2007,85:1962-1970.
[30] Pinos-Rodriguez J M,Gonzalez S S,Mendoza G D,etal.Effect of exogenous fibrolytic enzyme on ruminal fermentation and digestibility of alfalfa and rye-grass hay fed to lambs[J].Journal of Animal Science,2002,80(11):3016-3020.
[31] Beauchemin K A,Colombatto D,Morgavi D P,etal.Use of exogenous fibrolytic enzymes to improve feed utilization by ruminants[J].Journal of Animal Science,2003,81(E.suppl.2):37-47.
[32] Wang Y,McAllister T A,Rode L M,etal.Effects of an exogenous enzyme preparation on microbial protein synthesis,enzyme activity and attachment to feed in the rumen simulation technique(Rusitec)[J].British Journal of Nutrition,2001,85:325-332.
[33] Wallace R J,Wallace S J A,McKain N,etal.Influence of supplementary fibrolytic enzymes on the fermentation of corn and grass silages by mixed ruminal micrioorganismsinvitro[J].Journal of Animal Science,2001,79(7):1905-1916.
[34] Tang S X,Yayo G O,Tam Z L,etal.Effects of yeast culture and fibrolytic enzyme supplementation oninvitrofermentation characteristic of low-quality cereal straws[J].Journal of Animal Science,2008,86(5):1164-1172.
