无芒隐子草SAMS1基因的克隆及干旱胁迫下的表达分析
2013-04-10孔令芳张吉宇刘志鹏王彦荣
孔令芳,张吉宇,刘志鹏,王彦荣
(兰州大学草地农业科技学院 草地农业生态系统国家重点实验室 农业部草地农业生态系统学重点开放实验室,甘肃 兰州730020)
干旱、高盐和低温是限制植物生长和农作物产量的主要逆境因子,克服干旱、高盐和低温对农业生产的制约,培育具有良好抗逆特性的作物品种,一直是各国科学家关注的焦点[1]。近年来,随着分子遗传育种的发展,利用抗逆基因对作物进行基因工程改良已成为作物育种的重要途径并且成效显著[2],而找到能够直接利用的抗性基因是对作物进行基因工程改良的关键。
S-腺苷甲硫氨酸合成酶(S-adenosyl methionine synthetase,SAMS,EC 2.5.1.6)是植物代谢中的1个关键酶,它催化L-甲硫氨酸与ATP生物合成S-腺苷甲硫氨酸(SAM)。在生物学上,SAM是生物合成乙烯[3]以及多胺[4]的前体,参与了植物的转甲基、转氨丙基和转硫反应等多种重要的生理过程[5],SAM还可以与RNA结合参与基因表达调控[6]。SAMS基因与植物对干旱、盐碱和低温的抗性密切相关,并协助植物耐受多种非生物胁迫。岳昌武等[7]研究表明甘薯(Ipomoeabatatas)SAMS基因受低温胁迫诱导表达;林凡云等[8]发现糜子(Panicum miliaceum)SAMS基因的表达涉及糜子响应干旱胁迫及干旱后复水过程,可能是糜子抗旱节水的关键基因;王士强[9]应用BSMV-VIGS技术对小麦(Triticumaestivum)的SAMS基因进行沉默导致沉默植株更易受干旱胁迫的影响,初步确定了S-腺苷甲硫氨酸合成酶基因和抗旱性的关系。化烨[10]利用耐盐基因GsSAMS,构建了由诱导性启动子rd29A和强组成型启动子E12分别调控的GsSAMS基因的植物表达载体,培育出耐盐碱转基因苜蓿(Medicagosativa)新株系。截至目前,关于SAMS基因的研究多集中在玉米(Zeamays)、小麦等农作物中,很少涉及到草类植物。
无芒隐子草(Cleistogenessongorica)是禾本科多年生旱生草本植物,是荒漠草原和荒漠的建群种和优势种[11,12],饲用价值高,抗热性、抗旱性和耐寒性强,具有作为优良的草坪草和生态草引种驯化的价值[12,13],对促进畜牧业发展和维持脆弱生态系统具有重要作用[14,15]。近年来,对无芒隐子草种子萌发、出苗和幼苗生长对土壤水分的响应及无芒隐子草不同节间部位的种子休眠对高温处理的响应等方面的研究较多[16,17],而关于无芒隐子草中的SAMS基因尚未见报道。为了揭示无芒隐子草抗旱的分子基础,本研究采用SMART技术构建了无芒隐子草在干旱胁迫下的cDNA文库,以干旱诱导胁迫的cDNA文库中获得的SAMS1基因的EST序列为基础,克隆其全长序列cDNA,并对其结构特点及其在干旱诱导过程中的表达模式等进行了初步分析,为进一步探讨Cs-SAMS1基因的利用奠定基础。
1 材料与方法
1.1 材料及处理
1.1.1 材料与主要试剂 野生无芒隐子草种质于2004年采自内蒙古阿拉善地区。采集后保存在农业部牧草与草坪草种子质量监督检验测试中心(兰州)低温种子库,2010年在兰州大学草地农业科技学院盆栽试验。
实验所用的总 RNA分离试剂盒为 RNeasy Plant Mini Kit(Qiagen)、RNase free DNAse Set(Qiagen),cDNA合成试剂 盒 为 PrimeScriptTMRT-PCR Kit(TaKaRa)、pGEM-TEasy Vector Systems (Promega)、DNA Marker,DNA凝胶回收试剂盒,DH5α感受态细胞。引物由上海生工生物工程技术服务有限公司合成,其他试剂采用国产或进口分析纯。
1.1.2 干旱胁迫处理 无芒隐子草幼苗移栽2周后,选取生长旺盛、大小一致的植株用于干旱胁迫处理,将塑料杯充分浇水后停止浇水进行自然干旱处理,干旱处理的时间从第1天到第10天植物出现严重缺水而萎蔫,第11天恢复浇水1次,第14天试验结束。在此试验期间,选取第0,4,6,8,10,11,14天,分别测定土壤含水量和叶片相对含水量,每处理10次重复;同时分别收集不同处理点单株的根、茎和叶样品,液氮速冻后保存到-80℃冰箱,用于后续研究。
1.2 方法
1.2.1 总RNA的提取及cDNA的合成 采用RNeasy Plant Mini Kit(Qiagen)试剂盒提取无芒隐子草叶和根中的总RNA,用紫外分光光度计Nanodrop进行RNA纯度测定,并通过琼脂糖凝胶电泳检验RNA完整性。参照PrimeScriptTMRT-PCR Kit(TaKaRa)使用说明,取2μL无芒隐子草的总 RNA,以 Oligo dT为引物,进行cDNA第一条链的合成。
1.2.2 无芒隐子草SAMS1基因的全长cDNA克隆 根据获得的无芒隐子草EST核心序列在NCBI上Blast,取相似性最高的全长序列,用DNAMAN 5.2.2设计引物,上游引物为P1,下游引物为P2,以从无芒隐子草扩增该基因的全长片段,预测片段长度为1 399bp。
用琼脂糖凝胶DNA回收试剂盒回收目标片段,并与pGEM-TEasy载体连接,转化感受态大肠杆菌DH5a,用蓝白斑筛选结合Sp6和T7引物菌落PCR筛选阳性克隆。用Sp6和T7引物进行双向测序(上海生工技术有限公司)。
1.2.3 半定量RT-PCR分析 利用DNAMAN 5.2.2设计CsSAMS1基因半定量RT-PCR分析引物,正向引物为P3,反向引物为P4,产物大小为450bp。以无芒隐子草GAPDH基因作为内参基因(正向引物为P5,反向引物为P6),产物大小为448bp。PCR反应体系为30μL,其中含3μL 10xDynazyme buffer,1.5μL dNTP,上下游引物各1.5μL,1μL DNA Polymerase Dynazyme,1μL First strand cDNA,20.5μL Deionized H2O。PCR循环为:94℃预变性1min,然后35个循环,每个循环94℃变性15s,60℃退火30s,72℃延伸1min,最后72℃延伸1min,4℃保存。取5μL扩增产物用1%琼脂糖凝胶电泳鉴定,鉴定后送上海生工生物工程有限公司进行测序。
1.2.4 Realtime PCR 利用DNAMAN 5.2.2设计实时定量RT-PCR分析引物,正向引物为P7,反向引物为P8,产物大小为148bp。以无芒隐子草GAPDH基因作为内参基因(正向引物为P9,反向引物为P10),产物大小为150bp。相对定量采用2-△△CT方法,△△CT=(CT目的基因-CT内参基因)实验组-(CT目的基因-CT内参基因)对照,2-△△CT表示的是实验组目的基因的表达相对于对照组的变化倍数,定量过程中设置3Biological replicants×2 Technical replicants,共6次重复[18]。
PCR反应体系为10μL,其中含5μL 2xSYBR mix,上下游引物各0.4μL,3.2μL灭菌水,1μL Template。反应程序采用两步法:95℃酶激活10min,然后40个循环,每个循环95℃变性30s,60℃退火30s,结束。
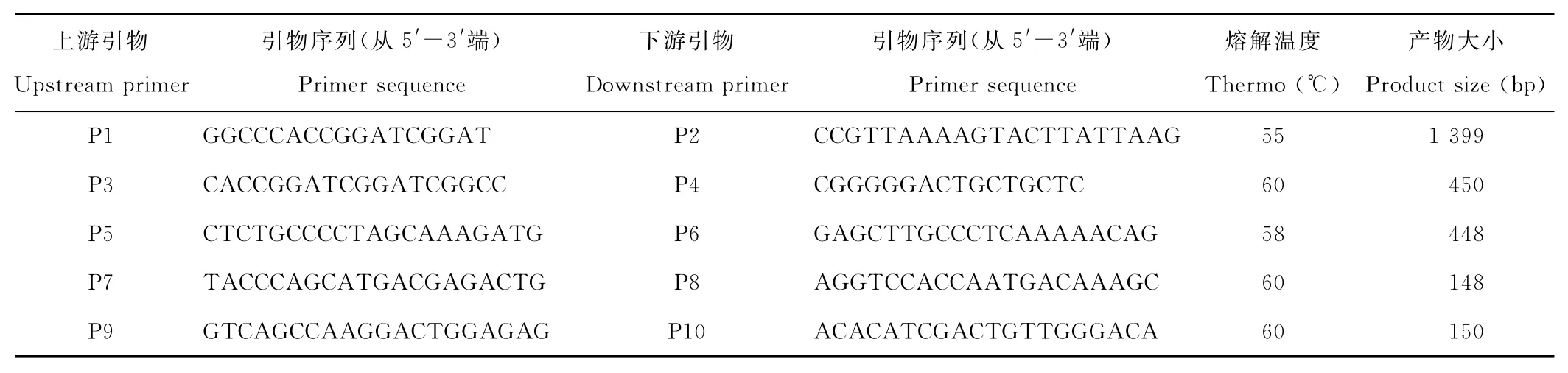
表1 实验所用的引物序列Table 1 Primer sequences was used
1.2.5 序列的生物信息学分析 通过 NCBI(http://blast.ncbi.Nlm.nih.gov/Blast.cgi)网站进行Blast检索,利用DNAMAN 6.0和Sequencher 4.9Demo生物技术软件进行序列翻译、多重比对以及同源树等分析,采用NCBI的ORF finder预测开放阅读框,NCBI的Blastp进行蛋白序列保守结构域分析。利用TMHMM 2.0 Serve(http://www.cbs.dtu.dk/services/TMHMM)和 TMpred(http://www.ch.embnet.org/Software/TMPRED)2个软件同时对该蛋白序列的跨膜区域进行分析,利用 ProtScale(http://www.expasy.ch/tools/protscale.html)网站进行该氨基酸序列的疏水性/亲水性预测。利用 NPSA(http://npsa-pbil.ibcp.fr/)中的MLRC程序在线分析蛋白质二级结构中α螺旋、无规则卷曲和延伸链等结构的预测。
2 结果与分析
2.1 SAMS1基因的全长cDNA扩增
以无芒隐子草该基因全长片段设计的上游引物P1,下游引物P2,经PCR扩增,产物由琼脂糖凝胶电泳分离后呈现一条长约1 399bp的特异性条带,与预期的片段大小一致(图1),暂命名为CsSAMS1(Genbank登陆号FJ972821)。

图1 PCR扩增产物电泳Fig.1 Ge1electrophoresis of PCR result
2.2 无芒隐子草SAMS1基因的表达模式分析
利用半定量和实时定量RT-PCR对CsSAMS1基因在干旱胁迫处理条件下的响应机构进行分析,分析所用的总RNA来自干旱胁迫8d后和未经胁迫处理的叶片和根系材料。半定量RT-PCR结果表明,干旱时CsSAMS1基因在叶中的表达量与未干旱对照基本一致而根中的表达量显著增加(图2)。

图2 CsSAMS1在未干旱及干旱胁迫下的RT-PCR结果Fig.2 The RT-PCR results of CsSAMS1under non-drought and drought stress
实时荧光定量PCR的分析结果表明,干旱时Cs-SAMS1基因在叶中的表达量没有增加,在根中的表达量明显上升,为未干旱对照的2倍,与半定量RTPCR的分析结果相符,说明CsSAMS1基因的大量表达受干旱的诱导(图3)。
2.3 CsSAMS1基因cDNA序列的生物信息学分析
ORF Finder程序在CsSAMS1cDNA序列的第68~1 258nt处发现有一连续ORF,第68~70nt处是该cDNA序列的第一个ATG密码子,其下游的+4位是G,上游-3位是A,符合典型的kozak规则[19],结合推导的氨基酸序列N端同源性比较结果,可以认定第一个ATG是该基因的起始密码子(图4)。因此克隆得到的cDNA序列含有完整的ORF,编码蛋白长397AA。
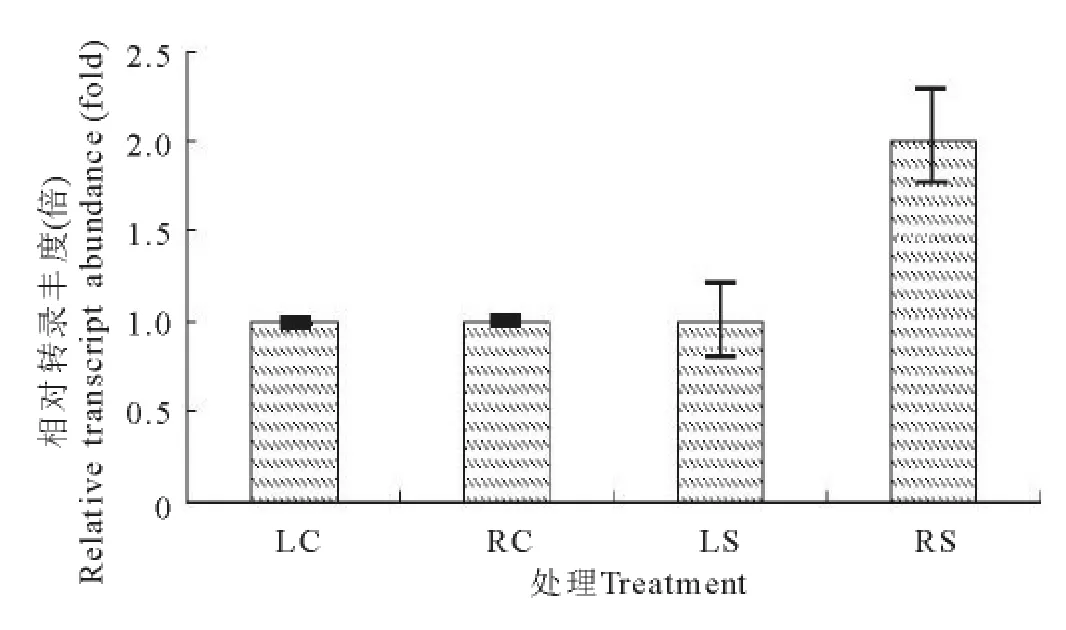
图3 CsSAMS1在未干旱及干旱胁迫下的qRT-PCR结果Fig.3 The qRT-PCR results of CsSAMS1under non-drought and drought stress
疏水性分析结果表明(图5),CsSAMS1多肽链具有最低的分值-2.056,亲水性最强;最高的分值1.733,疏水性最强。整个多肽链表现为亲水性,没有明显的疏水区域,对CsSAMS1基因进行跨膜域预测,没有跨膜结构域,结果与疏水性分析相符合。将Cs-SAMS1基因氨基酸序列利用SOPMA软件进行二级结构分析,可以看出该基因含有比较丰富的二级结构,以a-螺旋和无规卷曲为主,其中无规卷曲(cc)由164个氨基酸残基组成,占41.41%;a-螺旋(Hh)由139个氨基酸残基组成,占35.10%;连接条带由59个氨基酸残基组成,占14.59%;β-转角由34个氨基酸残基组成,占8.59%(图6)。利用Pfam数据库分析CsSAMS1基因的保守域,共含有3个保守域,N端从5到104个氨基酸残基,C端从243到385个氨基酸残基,中间是从119到241个氨基酸残基。这个肽段包括甲硫氨酸结合域GHPDK;ATP结合域GAGDQG;一个九肽的以p-环形式存在的磷酸盐结合区GGGAFSGKD;同时含有一个控制别越基因催化效率的活性中心PDIAQGVHGHFTKRPEEI(图7)。

图4 CsSAMS1的cDNA全长序列及推导的氨基酸序列Fig.4 The cDNA full length of CsSAMS1and its deduced amino acid sequence
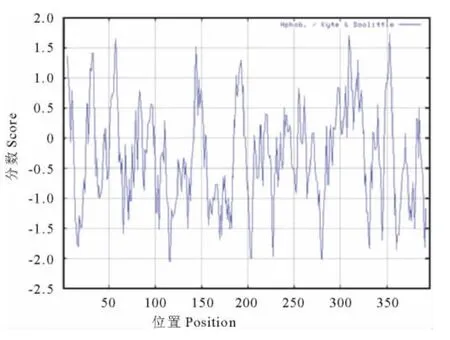
图5 CsSAMS1的疏水性分析Fig.5 Hydrophobicity prediction result of CsSAMS1
2.4 不同植物SAMS基因的多重比较
小麦、大麦(Hordeumvulgare)、玉米、粳稻(Oryzasativajaponica)、籼稻(Oryzasativaindica)、石斛兰 (Dendrobiumcrumenatum)、普 通 蓖 麻 (Ricinus communis)、胡頹子(Elaeagnusumbellate)、甘氨酸大豆(Glycinesoja)、毛果杨(Populustrichocarpa)、拟南芥 (Arabidopsisthaliana)、长 春 花 (Catharanthus roseus)、蒺藜苜蓿(Medicagotruncatula)、大洋洲滨藜(Atriplexnummularia)、无芒隐子草(Cleistogenes songorica)、红薯(Ipomoeabatatas)及番木瓜(Carica papaya)17种植物的SAMS基因的氨基酸序列的系统进化树分析显示,不同组的基因被分到不同的分支,在进化上CsSAMS1与禾本科稻属的SAMS亲缘关系最近,与大麦属和小麦属的亲缘关系次之,与兰科石斛兰属的亲缘关系较远(图8)。
从17种植物中挑选与CsSAMS1基因氨基酸序列相似度较高的5种植物的SAMS基因氨基酸序列进行多重比较,结果表明无芒隐子草中SAMS1基因的氨基酸序列与粳稻(籼稻)、大麦、小麦和玉米的SAMS基因的氨基酸序列相似度分别高达98.87%(98.62%),98.41%,98.07%,97.56%(图9),说明该基因在植物进化中非常保守。
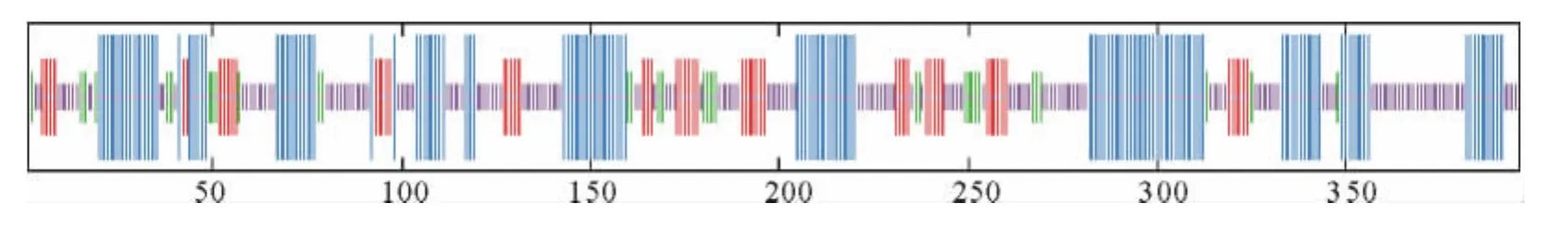
图6 CsSAMS1基因的二级结构Fig.6 The secondary structure of CsSAMS1gene
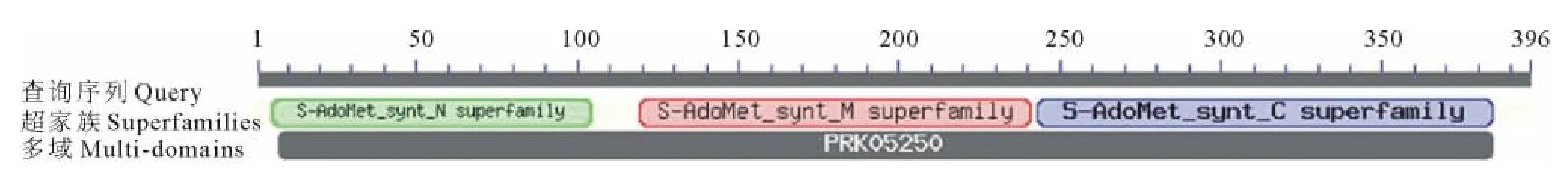
图7 CsSAMS1基因的保守区分析Fig.7 Conserved domains of CsSAMS1
3 讨论
由SAMS所催化反应的产物S-腺苷甲硫氨酸(SAM)是生物合成乙烯前体[20],而外源乙烯被证明可以诱导植物产生内源乙烯,因此乙烯利的处理可以诱导SAMS基因的大量表达。而SAM又是生物合成多胺的前体[21],近年来的研究表明乙烯和多胺都参与了植物抗逆反应[22],所以SAMS在植物抗逆生理方面发挥一定作用,大量研究发现SAMS基因受多种非生物胁迫诱导。
本研究对SAMS基因进行分析发现该基因全长为1 399bp,编码397个氨基酸,含有典型的N端结构域,中间结构域和C端结构域。疏水性结果表明没有明显的疏水区域,没有跨膜结构域,整个多肽链表现为亲水性。易乐飞等[23]对条斑紫菜(Porphyrayezoensis)的SAMS基因进行疏水性分析结果表明,其亲水性区域均匀分布在整个肽链中,PySAMS在一级结构上以亲水性为主。PySAMS基因没有跨膜结构域,结果与疏水性分析相符合。贾丽娜等[24]用ProtScale对玉米SAMS氨基酸序列的疏水性/亲水性进行预测,结果表明整个多肽链表现为亲水性,没有明显的疏水区域,SAMS基因没有跨膜结构域,结果与疏水性分析相符合。

图8 17种植物SAMS氨基酸序列的进化树Fig.8 Phylogenetic tree based on amino acid sequence of SAMSfrom seventeen plants

图9 6种植物的SAMS氨基酸序列的多重比较Fig.9 Multiple alignment of SAMSfrom six plants
用neighbour-joining(NJ)法对无芒隐子草及有亲缘关系的17种植物,构建系统发生进化树(图8),结果表明在进化上CsSAMS1与禾本科稻属的SAMS亲缘关系最近,与大麦属和小麦属的亲缘关系次之,与兰科石斛兰属的亲缘关系较远。将上述生物中与无芒隐子草亲缘关系最近的5种植物的SAMS基因和CsSAMS1进行多重序列比对,对比结果显示多种生物的SAMS基因高度相似,说明SAMS基因在其进化过程中非常保守。易乐飞等[24]将条斑紫菜的SAMS基因与其他4种植物的SAMS基因进行比对发现,PySAMS与绿藻门莱茵衣藻的SAMS亲缘关系最近,与高等植物的亲缘关系次之,与细菌的亲缘关系最远,进化树反映出的亲缘关系与传统分类相符。
用半定量和实时定量RT-PCR的方法对CsSAMS1基因在干旱胁迫下的表达分析结果均表明,该基因在干旱胁迫时根中表达量显著增加,为对照的2倍,而叶中的表达量在干旱胁迫前后无明显变化。CsSAMS1基因在干旱胁迫第8天时表达量明显增加,说明该基因主要参与无芒隐子草对干旱胁迫的响应过程。余涛等[25]在烟草(Nicotianatabacum)中克隆了一个SAMS基因,发现其表达受氧化胁迫、盐胁迫及高温胁迫的诱导。Ma等[26]发现盐地碱蓬(Suaedaglauca)的SAMS基因受NaCl胁迫的正调控,酶活性检测表明NaCl胁迫条件下该酶的活性增强。番茄(Lycopersiconesculentum)中SAMl和SAM3特异地受盐、甘露醇和ABA的诱导表达[27]。Gupta等[28]证实白杨SAMS基因受高浓度CO2和O2胁迫的诱导。拟南芥、水稻中SAMS基因的表达在水分胁迫时表达量增加亦有报道[29]。小麦中的SAMS基因的表达受干旱和复水的诱导[30]。有研究证明玉米SAMS基因参与逆境胁迫响应,在玉米逆境应答中起作用[31]。
本研究从无芒隐子草中克隆得到了SAMS1基因的全长cDNA序列,具有SAMS基因的典型结构特征。通过与近缘植物SAMS的氨基酸序列多重比较发现,不同植物的SAMS的氨基酸相似程度非常高(92%~100%),说明SAMS基因在植物进化中非常保守。CsSAMS1基因在无芒隐子草幼苗干旱胁迫诱导时,在根中大量表达,叶中表达量变化不明显,表明CsSAMS1基因可能是无芒隐子草抗旱性相关的基因。这为研究SAMS1基因在无芒隐子草中的表达分析、功能验证、蛋白的分子结构及其结构与功能的关系等奠定了基础,有助于阐明无芒隐子草SAMS1基因在逆境应答中的调控机制和功能,获得的基因资源对抗旱草类作物的遗传改良具有重要的指导意义。
[1] Khush G.Green revolution:preparing for the 21st century[J].Genome,1999,42:646-655.
[2] Herrera-estrella L,Simpson J,Martinez-trujillo M.Transgenic plants:an historical perspective[J].Methods in Molecular Biology,2005,286:3-32.
[3] Yang S F,Hoffman N E.Ethylene biosynthesis and its regulation in higher plants[J].Annual Review of Plant Physiology,1984,35:155-189.
[4] Heby O,Persson L.Molecular genetics of polyamine synthesis in eukaryotic cells[J].Trends in Biochemical Sciences,1990,15:153-158.
[5] Shelly C L.S-adenosylmethionine[J].The International Journal of Biochemistry & Cell Biology,2000,32:391-395.
[6] Winkler W C,Nahvi A,Sudarsan N.Breaker RR:An mRNA structure that controls gene exp ression by binding s-adenosylmethionine[J].Nature Structural Biology,2003,10:701-707.
[7] 岳昌武,肖静,凌锌,等.低温胁迫对甘薯S-腺苷甲硫氨酸合成酶mRNA表达水平的影响[J].农业科学与技术,2008,9(1):11-14.
[8] 林凡云,王士强,胡银岗,等.糜子SAMS基因的克隆及其在干旱复水中的表达模式分析[J].作物学报,2008,34(5):777-782.
[9] 王士强.小麦抗旱指标筛选与S-腺苷甲硫氨酸合成酶基因的克隆和功能分析[D].西安:西北农林科技大学,2008.
[10] 化烨.GsSAMS基因对苜蓿的遗传转化及转基因新株系的培育[D].哈尔滨:东北农业大学,2009.
[11] 陈默君,贾慎修.中国饲用植物志[M].北京:中国农业出版社,2002.
[12] 周志宇.阿拉善荒漠草地类初级营养类型研究[M].兰州:甘肃科学技术出版社,1990.
[13] 郇庚年.甘肃张掖重要野生草坪植物[J].草业科学,1989,6(5):60-64.
[14] 闫玉春,唐海萍.草地退化相关概念辨析[J].草业学报,2008,17(1):93-99.
[15] 黄黔.我国的生态建设与生态现代化[J].草业学报,2008,17(2):1-8.
[16] 邰建辉,王彦荣,陈谷.无芒隐子草种子萌发、出苗和幼苗生长对土壤水分的响应[J].草业学报,2008,17(3):105-110.
[17] 魏学,王彦荣,胡小文,等.无芒隐子草不同节间部位的种子休眠对高温处理的响应[J].草业学报,2008,18(6):169-173.
[18] 张吉宇,王彦荣,南志标.相对定量和绝对定量——以CsSAMDC基因表达分析为例[J].中国生物工程杂志,2009,29(8):86-91.
[19] 王冬冬,朱延明,李勇,等.电子克隆技术及其在植物基因工程中的应用[J].东北农业大学学报,2006,37(3):403-408.
[20] Yang S F,Hoffman N E.Ethylene biosynthesis and its regulation in higher plants[J].Annual Review of Phytopathology,1984,35:155-189.
[21] Mato J M,Alvarez L,Ortiz P,etal.S-adenosylmethionine synthesis:Molecular mechanisms and clinical implications[J].Pharmacology & Therapeutics,1997,73:265-280.
[22] Jennings J C,Apel-Birkhold P C,Mock N M,etal.Induction of defense responses in tobacco by the protein Nep1fromFusariumoxysporum[J].Plant Science,2001,161:891-899.
[23] 易乐飞,王萍,周向红,等.条斑紫菜SAMS基因克隆与生物信息学分析[J].中国生物工程杂志,2009,29(7):43-49.
[24] 贾丽娜,张慧杰,张晏萌,等.玉米SAMS基因的克隆与序列分析[J].河北农业科学,2008,12(8):53-55.
[25] 余涛,支立峰,彭论,等.烟草中一条新的S-腺苷甲硫氨酸合成酶基因的克隆及表达分析[J].武汉植物学研究,2004,22(4):277-283.
[26] Ma X L,Wang Z L,Qi Y C,etal.Isolation of S-adenosylmethionine synthetase gene fromSuaedasalsaand its differential expression under NaCl stress[J].Acta Botanica Sinica,2003,45(11):1359-1365.
[27] Espartero J,Pintortoro J A,Pardo J M.Differential accumulation of S-adenosylmethionine synthetase transcript in response to salt stress[J].Plant Molecular Biology,1994,25:217-227.
[28] Gupta P,Duplessis S,White H,etal.Gene expression patterns of trembling aspen trees following long-term exposure tointeracting elevated CO2and tropospheric O3[J].New Phytologist,2005,167:129-142.
[29] Mathur M,Satpathy M,Sachar R C.Phytohormonal regulation of S-adenosylmethionine synthetase by gibberellic acid in wheat aleurones[J].Acta Biochimica et Biophysica Sinica,1992,1137(3):338-348.
[30] 陈锐.小麦抗旱节水相关基因的筛选、克隆及表达分析[D].西安:西北农林科技大学,2009.
[31] 赵晋锋,余爱丽,朱晶莹,等.玉米S-腺苷甲硫氨酸合成酶基因SAMS逆境胁迫下的表达分析[J].河北农业大学学报,2010,33(5):13-17.
