外源一氧化氮对渗透胁迫下黑麦草幼苗光合和生物发光特性的影响
2013-04-10刘建新王金成王瑞娟贾海燕
刘建新,王金成,王瑞娟,贾海燕
(陇东学院生命科学与技术学院 甘肃省高校陇东生物资源保护与利用省级重点实验室,甘肃 庆阳745000)
土壤盐渍化和干旱是影响农业生产重要的逆境因子[1]。干旱和盐害引起的渗透胁迫会导致植物气孔关闭[2],光合电子传递受抑[3],光能利用率降低[4],光合机构破坏[5]。黑麦草(Loliumperenne)是目前我国栽培面积最大的禾本科优质牧草和草坪草,对保障家畜饲草供应和维持生态平衡起着极其重要的作用。随着全球气候变暖,土壤盐渍化和淡水短缺加剧,渗透胁迫已成为限制黑麦草生产的重要生态因子之一,探讨提高其适应渗透胁迫的有效途径具有重要意义。
一氧化氮(nitric oxide,NO)是生物体中一种重要的信号分子,在植物响应逆境胁迫的应答中发挥着重要作用[6]。研究表明,干旱胁迫下,NO 参与调控小麦(Triticumaestivum)气孔的关闭[7],提高核桃(Juglansregia)的光能转换效率[8]。盐胁迫下,NO可缓解黄瓜(Cucumissativus)叶肉细胞光合活性的下降[9],提高番茄(Lycopersiconesculentum)的光合速率[10]。缺铁时,NO能促进玉米(Zeamays)类囊体膜色素蛋白复合体的装配,引起电子传递速率增加和光合活性增强[11]。外源NO对渗透胁迫下黄瓜[12]和小麦[13]种子的萌发具有显著的促进作用,并可缓解渗透胁迫对红三叶(Trifolium)幼苗生长的抑制和氧化损伤[14]。然而,NO对渗透胁迫下黑麦草光合和生物发光特性影响的研究未见报道。本研究以牧草型多年生黑麦草为材料,分析NO供体硝普钠(sodium nitroprusside,SNP)对渗透胁迫下光合色素含量、气体交换和叶绿素荧光参数及生物发光的影响,以期为NO缓解牧草渗透胁迫伤害提供理论依据。
1 材料与方法
1.1 材料培养
试验于2010年4-8月在甘肃省高校陇东生物资源保护与利用省级重点实验室进行。将黑麦草品种‘Oupec’的种子(购自百绿集团北京代理处)消毒、催芽后,选露白一致的播种在装有珍珠岩的塑料钵(直径20 cm,高22cm)中,每钵播约200粒,浇足水后置生物科技园日光温室培养。出苗后每隔2d浇一次1/4Hoagland营养液,常规管理。幼苗三叶一心时,选一致壮苗用1/2Hoagland营养液培养,1周后换成完全营养液,每3d更换1次营养液,用电动气泵24h通气,当植株具5~6片叶时进行处理。
1.2 试验设计
试验首先在10%,15%,20%和25%浓度的聚乙二醇6000(polyethylene glycol 6000,PEG6000)渗透胁迫下分别添加50或100μmol/L SNP[Na2Fe(CN)5NO]处理幼苗,以叶片质膜相对透性为指标,筛选出进行后续试验的PEG6000浓度为15%,SNP浓度为100μmol/L。
由于SNP的分解产物除NO外,还有NO2-/NO3-和Fe(CN)52-阴离子[7],所以在试验中加入一定浓度的NaNO3/NaNO2和Na3Fe(CN)6(后者也是SNP的相似物,但二者均不产生NO)作为相关对照。试验设6个处理:1)对照,Hoagland营养液;2)15%PEG6000;3)15%PEG6000+100μmol/L SNP;4)15%PEG6000+100 μmol/L NaNO2+100μmol/L NaNO3(其中 NaNO2+NaNO3以 NOx-表示);5)15%PEG6000+100μmol/L Na3Fe(CN)6;6)15%PEG6000+100μmol/L SNP+0.1%Hb(牛血红蛋白 Hb,NO的清除剂),分别用CK、PEG、PEG+SNP、PEG+NOx-、PEG+F、PEG+SNP+Hb表示,各处理液用Hoagland溶液配制。每个处理重复4次,随机排列。处理液每天更换1次,用低浓度HCl或KOH调节pH至5.5±0.2。温室内平均光强620 μmol/(m2·s),昼/夜温度(28±5)℃/(21±3)℃,湿度60%~75%,每天照光约12h,处理6d后取样进行分析测定。
1.3 测定指标与方法
1.3.1 光合色素含量的测定 按李合生[15]的方法,称取叶片鲜样0.10g,加入10mL 80%丙酮研磨提取并定容至50mL。过滤,用分光光度计测定滤液A663、A646和A470值,计算叶绿素a、叶绿素b和类胡萝卜素含量。
1.3.2 光合气体交换参数的测定 采用CIRAS-2型光合测定系统(PP-systems,英国)在9:00-11:00(晴)测定幼苗倒数第2~3片功能叶的净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)和胞间 CO2浓度(intercellular CO2concentration,Ci)。气孔限制值(stomatal limited value,Ls)由公式Ls=1-Ci/Ca(Ca为大气中CO2浓度)计算得出。测定时叶室内源光强为600μmol/(m2·s),温度25℃,O2含量21%,CO2浓度为360μmol/mol。
1.3.3 叶绿素荧光参数的测定 采用FMS-2型脉冲调制式荧光仪(Hansatech,英国)测定和计算暗适应30min后幼苗倒数第2~3片功能叶的初始荧光(initial fluorescence,Fo)、最大荧光(maximal fluorescence,Fm)及光系统Ⅱ(photosystem Ⅱ,PSⅡ)最大光化学效率(maximal photochemical efficiency,Fv/Fm)=(Fm-Fo)/Fm,再测定光强为6 000μmol/(m2·s)下的稳态荧光(steady-state fluorescence,Fs)、最大荧光(Fm′)和最小荧光(minimum fluorescence,Fo′),并计算光适应下 PSⅡ实际光化学效率(actual photochemical efficiency of PSⅡ,ΦPSⅡ)=(Fm′-Fs)/Fm′,光化学猝灭(photochemical quenching,qP)=(Fm′-Fs)/(Fm′-Fo′)、非光化学猝灭(non-photochemical quenching,NPQ)=Fm/Fm′-1[16]。用(1-qP)表示PSⅡ的激发压,反映PSⅡ的关闭程度[17]。
1.3.4 超弱发光强度的测定 采用中国科学院生物物理研究所研制的超弱发光仪测定。取幼苗倒数第2~3片功能叶0.5g左右,在光强10μmol/(m2·s)白炽灯照射5min后立即放入测量杯中测量超弱发光(ultraweak luminescence,UWL)强度。测量参数:电压800V,标准光源发光强度7 000counts/s。本底强度5counts/s,采样时间200s,采样间隔1s。样品测定在暗室及恒温(25±1)℃、恒湿(相对湿度75%±2%)条件下进行。
1.3.5 叶片荧光强度的测定 采用日立F-4500荧光仪测定幼苗倒数第2~3片功能叶的荧光强度。测定条件为激发光(excitation light,EX)波长440nm,发射光(emitted light,EM)波长500~700nm,缝宽EX/EM 为10.0 nm/5.0nm,扫描速度12 000nm/min。
1.3.6 叶片磷光强度的测定 采用日立F-4500荧光仪测定幼苗倒数第2~3片功能叶的磷光强度。测定时EX波长为210nm,EM 波长为400~500nm,缝宽EX/EM 为10.0nm/5.0nm,扫描速度240nm/min。
1.4 统计分析
所有指标测定至少重复3次,结果以平均值±标准误表示,采用SPSS 16.0软件方差分析,Duncan法多重比较(P<0.05)。
2 结果与分析
2.1 外源NO对渗透胁迫下黑麦草幼苗叶片光合色素含量的影响
与CK相比,PEG处理显著提高了黑麦草叶片叶绿素a、叶绿素b含量和叶绿素a/b,降低了类胡萝卜素含量(表1);PEG+SNP处理的叶绿素a、叶绿素b含量、叶绿素a/b和类胡萝卜素含量分别比PEG处理提高了31.1%,19.8%,9.6%和40.9%;而增添 NO清除剂血红蛋白处理(PEG+SNP+Hb)后,SNP的作用被消除。PEG+NOx-和PEG+F处理的叶绿素a、叶绿素b和类胡萝卜素含量及叶绿素a/b与单独PEG处理无显著差异。
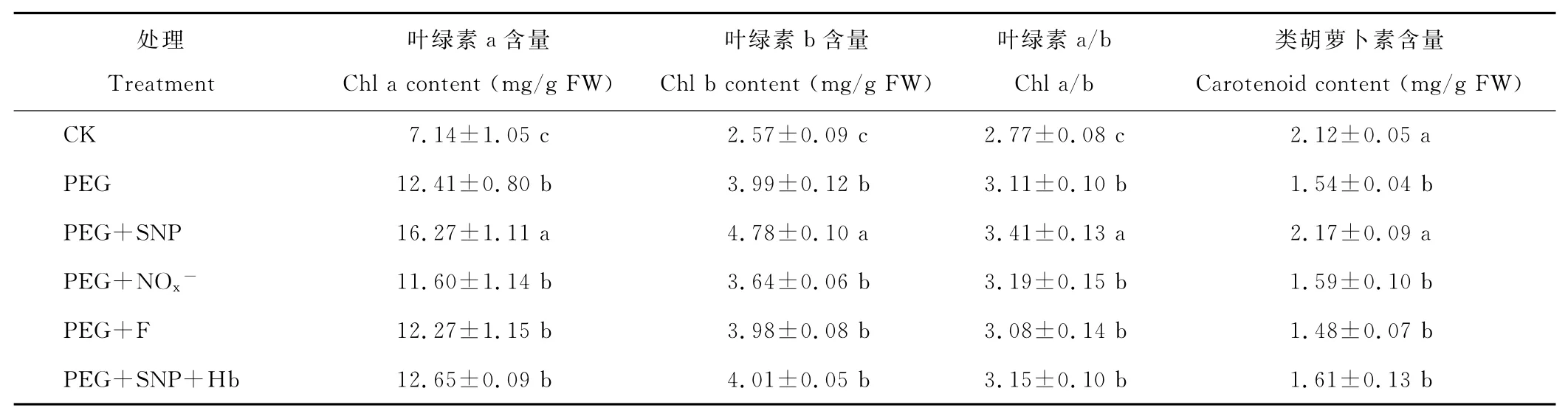
表1 外源NO对渗透胁迫下黑麦草幼苗叶片光合色素含量的影响Table 1 Effects of exogenous NO on content of photosynthetic pigment in leaves of ryegrass seedlings under osmotic stress
2.2 外源NO对渗透胁迫下黑麦草幼苗叶片光合参数的影响
引起Pn降低的因素有气孔限制和非气孔限制。Farquhar和Sharkey[18]认为,当Pn和Ci同时减小,且Ls增大时,Pn的下降主要是由Gs的降低引起的;否则,Pn的下降应主要归因于非气孔限制。与CK相比,PEG处理后黑麦草叶片的Pn、Gs、Tr和Ls显著降低,Ci明显升高(表2);PEG+SNP处理显著降低了PEG处理下Pn、Gs、Tr、Ls下降和Ci提高的幅度;PEG+SNP+Hb处理逆转了SNP对上述光合参数的调节效应。与单独PEG处理相比,PEG+NOx-或PEG+F处理对黑麦草幼苗各光合参数无显著影响。由此表明,外源NO可缓解渗透胁迫下非气孔限制引起的黑麦草Pn的降低。
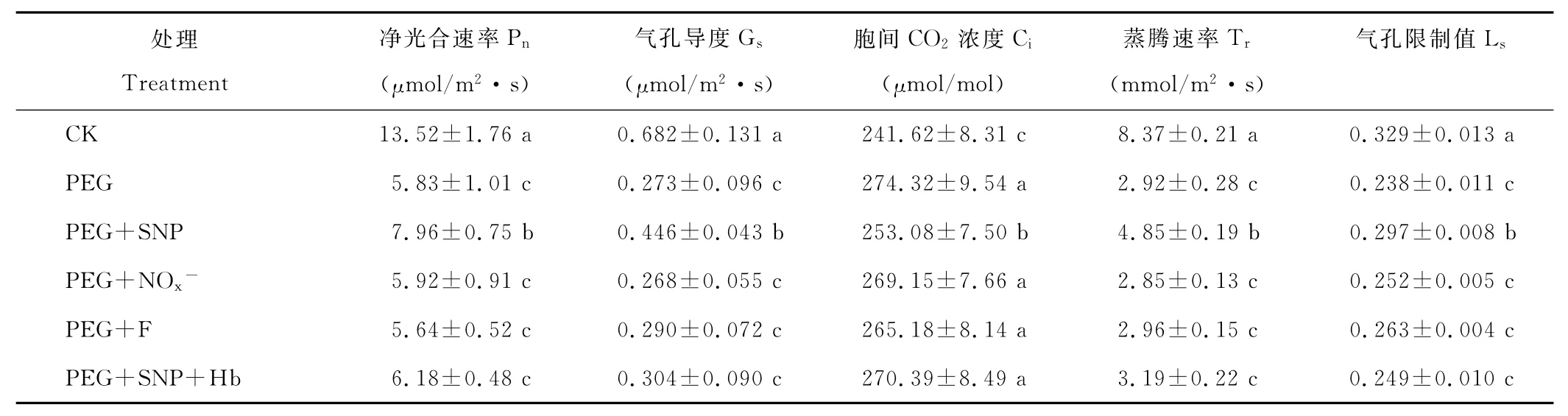
表2 外源NO对渗透胁迫下黑麦草幼苗叶片光合气体交换参数的影响Table 2 Effects of exogenous NO on photosynthetic gas exchange parameters in leaves of ryegrass seedlings under osmotic stress
2.3 外源NO对渗透胁迫下黑麦草幼苗叶片叶绿素荧光参数的影响
叶绿素荧光参数可反映环境因子对植物光合生理状况的影响。Fv/Fm常用于度量PSⅡ原初光能转换效率,反映PSⅡ利用光能的能力;ФPSⅡ反映了PSⅡ反应中心在有部分关闭情况下实际原初光能捕获效率[19];激发压(1-qP)反映的是PSⅡ的关闭程度,它与PSⅡ反应中心电子受体,特别是QA的氧化还原状态有关;NPQ反映的是PSⅡ天线色素吸收的光能不能用于光化学反应而以热的形式耗散的部分[18]。与CK相比,PEG渗透胁迫降低了黑麦草叶片的Fv/Fm和ΦPSⅡ,提高了(1-qP)和NPQ(表3);PEG+SNP处理显著提高了渗透胁迫下的Fv/Fm和ΦPSⅡ,降低了(1-qP)和 NPQ;PEG+SNP+Hb处理消除了SNP对渗透胁迫下Fv/Fm、ΦPSⅡ提高及(1-qP)、NPQ降低的作用;PEG+NOx-或PEG+F处理的上述叶绿素荧光参数与单独PEG处理无显著差异。表明NO能够提高渗透胁迫下黑麦草叶片PSⅡ的光能利用效率。
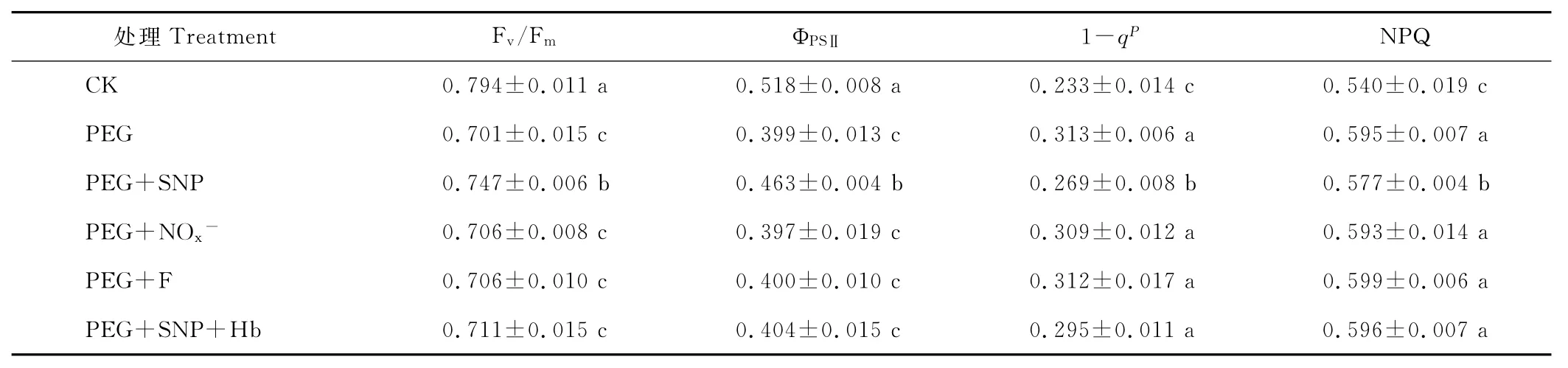
表3 外源NO对渗透胁迫下黑麦草幼苗叶片叶绿素荧光参数的影响Table 3 Effects of exogenous NO on chlorophyll fluorescence parameters in leaves of ryegrass seedlings under osmotic stress
2.4 外源NO对渗透胁迫下黑麦草幼苗叶片生物发光强度的影响
生物发光强度可反映植物体内物质代谢和能量转化的活跃程度。当体内活性氧积累时,其中的羟基自由基与细胞膜上的多不饱和脂肪酸发生脂质过氧化连锁反应,形成单线态氧(1O2),处于激发态的1O2退激回到基态时向外发射光子,形成UWL[20]。通常情况下,绝大多数的有机分子处于单线基态,当分子被激发到较高能级并经历非辐射跃迁降落到第一电子激发单重态的最低振动能级后,部分分子会回到基态而产生荧光,另一部分分子则经历非辐射的系间窜越到达亚稳的第一电子激发三重态,在三重态逗留后,再发生辐射跃迁下降到基态的各振动能级而发射磷光,组成蛋白质的某些氨基酸分子可发生能级跃迁产生磷光[21]。黑麦草幼苗在PEG处理下叶片的UWL强度、荧光强度和磷光强度分别较CK提高了50.4%,26.1%和50.3%(图1);PEG+SNP处理比PEG处理下的UWL强度、荧光强度和磷光强度分别降低了30.1%,15.6%和20.4%;增添NO清除剂处理(PEG+SNP+Hb)后SNP对3种生物发光的调节作用消失。PEG+NOx-或PEG+F处理与PEG处理相比,UWL强度和荧光强度无显著差异,而磷光强度明显增加。表明NO可能参与了渗透胁迫下黑麦草幼苗活性氧清除或防御蛋白质结构破坏的调控。
3 讨论
光合色素参与植物光能的吸收、传递和转化,叶绿素a/b可反映类囊体的垛叠程度,类囊体的垛叠程度越高,光抑制越不容易发生,植株抵御逆境胁迫的能力就越强[22,23]。本试验表明,在15%PEG6000渗透胁迫下,施用100μmol/L SNP显著提高了黑麦草幼苗叶片叶绿素a、叶绿素b和类胡萝卜素含量及叶绿素a/b,而添加血红蛋白Hb后SNP的效应被消除;施用NOx-和Na3Fe(CN)6均未显著改变渗透胁迫下光合色素的含量。SNP是NO常用的一种供体,0.5mmol/L SNP约能释放2μmol/L的 NO[24]。NOx-是 NO的分解产物,Na3Fe(CN)6是SNP的相似物或分解产物,两者均不能产生NO,Hb是NO的清除剂。因此,可以得出SNP释放的NO提高了渗透胁迫下黑麦草叶片光合色素的含量和类囊体的垛叠程度,这与邵瑞鑫和上官周平[25]对受旱小麦的研究结果类似,其原因可能与NO能够促进叶绿体发育[11]有关。
光合作用的强弱可反映植株对逆境胁迫的抵抗能力[26]。干旱胁迫通过气孔和非气孔因素导致玉米光合速率下降[27]。本试验表明,外源NO可缓解渗透胁迫下黑麦草非气孔限制引起的Pn的降低(表2)。进一步的研究显示,渗透胁迫下黑麦草叶片Fv/Fm和ΦPSⅡ显著降低,1-qP和NPQ明显提高(表3),表明渗透胁迫造成了PSⅡ反应中心的破坏,导致PSⅡ原初电子受体QA过度还原,激发能通过PSⅡ用于光化学过程的能量减少,光能利用率下降,光能过剩产生了光抑制[28],为防止过剩光能对光合机构造成进一步伤害,加强热耗散以保护PSⅡ的功能,这可能是黑麦草适应渗透胁迫的一种保护机制[29]。诸多研究表明,NO在逆境胁迫下植物光合器官功能的维持中发挥着重要的调控作用。如外源NO提高了干旱胁迫下苜蓿(Medicagosativa)幼苗的原初光能转换效率和PSⅡ的潜在活性[30],增加了受旱小麦PSⅡ反应中心开放的比例[25],提高了强光胁迫下霍山石斛(Dendrobiumhuoshanense)PSⅡ过剩光能的非光化学耗散,缓解了光抑制破坏[31]。本试验结果显示,外源NO显著缓解了渗透胁迫引起的黑麦草叶片Fv/Fm和ΦPSⅡ下降及1-qP和NPQ提高的幅度(表3),表明NO不仅可以减轻渗透胁迫对PSⅡ反应中心的损伤,维持PSⅡ的光化学活性,还可降低渗透胁迫下激发能的非光化学热耗散。这可能也是NO缓解渗透胁迫对黑麦草叶片光合速率抑制的重要原因之一,但其作用机制有待进一步揭示。
植物UWL是与植物能量代谢相联系的低水平光子辐射[21]。研究表明,植物叶片的UWL主要来自于叶绿体[32],而叶绿体UWL可能主要来自类囊体膜上的光合电子传递链[33],但也受活性氧的影响[32]。本研究中,渗透胁迫诱导黑麦草叶片UWL强度显著增加(图1),这与UWL产生的活性氧机制[34]相符合。外源NO降低了渗透胁迫下黑麦草叶片UWL强度,表明NO可能缓解了渗透胁迫对光合链电子传递的抑制,或增强了渗透胁迫下体内活性氧的清除能力,维持了类囊体膜结构和功能的完整性。渗透胁迫下黑麦草光能利用率的下降(表3),将产生过剩的激发能,多余的激发能会以光能或热能的形式释放,导致渗透胁迫下叶片荧光和磷光辐射的增强(图1)及非光化学能量耗散的提高(表3)。外源NO显著降低了渗透胁迫下黑麦草叶片荧光和磷光强度升高的幅度(图1),减缓了渗透胁迫导致的非光化学能量耗散提高的幅度(表3)。表明NO可通过提高光能的利用效率,降低渗透胁迫诱导的过剩激发能对光合机构的破坏,从而提高渗透胁迫下黑麦草叶片的光合速率。
综上所述,渗透胁迫限制了黑麦草幼苗光合机构功能的正常发挥,外源NO不仅能够提高渗透胁迫下黑麦草叶片的光合色素含量,还可通过增加PSⅡ反应中心的开放比例,降低非光化学能量耗散和生物发光强度,提高光能利用效率,从而缓解渗透胁迫下非气孔因素引起的黑麦草叶片光合速率的下降,提高植株光合机构对渗透胁迫的适应能力。
[1] 蔡建一,马清,周向睿,等.Na+在霸王适应渗透胁迫中的生理作用[J].草业学报,2011,20(1):89-95.
[2] Cornic G.Drought stress inhibits photosynthesis by decreasing stomatal aperture-not by affecting ATP synthesis[J].Trends in Plant Science,2000,5:187-188.
[3] Dodd I C,Critchley C,Woodall G S,etal.Photo inhibition in differently colored juvenile leaves ofSyzygiumspecies[J].Journal of Experimental Botany,1998,49:1437-1445.
[4] Morales F,AbadiáA,AbadiáJ.Photoinhibition and photoprotection under nutrient deficiencies,drought and salinity[A].Advances in Photosynthesis and Respiration:Photoprotection,Photoinhibition,Gene Regulation,and Environment[M].Netherlands:Springer Press,2006:65-85.
[5] Gonzalez-Rodriguez A M,Martin-Olivera A,Morales D,etal.Physiological responses of tagasaste to a progressive drought in its native environment on the Canary Islands[J].Environmental and Experimental Botany,2005,53:195-204.
[6] Besson-Bard A,Pugin A,Wendehenne D.New insights into nitric oxide signaling in plants[J].Annual Review of Plant Biology,2008,59:21-39.
[7] Mata C G,Lamattina L.Nitric oxide induces stomatal closure and enhances the adaptive plant responses against drought stress[J].Plant Physiology,2001,126:1196-1204.
[8] 相昆,李宪利,王晓芳,等.水分胁迫下外源NO对核桃叶绿素荧光的影响[J].果树学报,2006,23(4):616-619.
[9] 樊怀福,郭世荣,焦彦生,等.外源一氧化氮对NaCl胁迫下黄瓜幼苗生长、活性氧代谢和光合特性的影响[J].生态学报,2007,27(2):546-553.
[10] 吴雪霞,朱为民,朱月林,等.外源一氧化氮对NaCl胁迫下番茄幼苗光合特性的影响[J].植物营养与肥料学报,2007,13(6):1105-1109.
[11] 敬岩,孙宝腾,符建荣.一氧化氮改善铁胁迫玉米光合组织结构及其活性[J].植物营养与肥料学报,2007,13(5):809-815.
[12] 汤绍虎,周启贵,孙敏,等.外源NO对渗透胁迫下黄瓜种子萌发、幼苗生长和生理特性的影响[J].中国农业科学,2007,40(2):419-425.
[13] 张华,孙永刚,张帆,等.外源一氧化氮供体对渗透胁迫下小麦种子萌发和水解酶活性的影响[J].植物生理与分子生物学学报,2005,31(3):241-246.
[14] 高景慧,席雪丽,刘记,等.外源NO对渗透胁迫下红三叶幼苗生长抑制及氧化损伤的缓解效应[J].种子,2009,28(8):24-28.
[15] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:134-137.
[16] 苏秀荣,王秀峰,杨凤娟,等.硝酸根胁迫对黄瓜幼苗叶片光合速率,PSⅡ光化学效率及光能分配的影响[J].应用生态学报,2007,18(7):1441-1446.
[17] Ono K,Nishi Y,Watannabe A,etal.Possible mechanisms of adaptive leaf senescence[J].Plant Biology,2001,3:234-243.
[18] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345.
[19] Carrasco R M,Rodriguez J S,Perez P.Changes in chlorophyll fluorescence during the course of photoperiod and in response to drought inCasuarinaequisetifoliaForst.and Forst[J].Photosynthetica,2002,40(3):363-368.
[20] Foyer C H,Lopez-Delgado H,Dat J F,etal.Hydrogen peroxide-and glutathione-associated mechanisms of acclimatory stress tolerance and signalling[J].Physiologia Plantarum,1997,100:241-254.
[21] 魏玉霞,董川.磷光分析法在生命科学中的应用新进展[J].生命的化学,2003,23(4):320-322.
[22] 高奔,宋杰,刘金萍,等.盐胁迫对不同生境盐地碱蓬光合及离子积累的影响[J].植物生态学报,2010,34(6):671-677.
[23] 黄增荣,隆小华,刘兆普,等.KNO3对NaCl胁迫下两菊芋品种幼苗生长及光合能力的影响[J].草业学报,2011,20(1):82-88.
[24] Delledonne M,Xai Y J,Dixon R A,etal.Nitric oxide functions as a signal in plant disease resistance[J].Nature,1998,394:585-588.
[25] 邵瑞鑫,上官周平.外源一氧化氮供体SNP对受旱小麦光合色素含量和PSⅡ光能利用能力的影响[J].作物学报,2008,34(5):818-822.
[26] 陈良,隆小华,郑晓涛,等.镉胁迫下两种菊芋幼苗的光合作用特征及镉吸收转运差异的研究[J].草业学报,2011,20(6):60-67.
[27] 张仁和,薛吉全,浦军,等.干旱胁迫对玉米苗期植株生长和光合特性的影响[J].作物学报,2011,37(3):521-528.
[28] Santos C V.Regulation of chlorophyll biosynthesis and degradation by salt stress in sunflower leaves[J].Scientia Horticulturae,2004,103(1):93-99.
[29] Bilger W,Bjorkman O.Role of the xanthophylls cycle,fluorescence and photosynthesis inHederacanariensis[J].Photosynthesis Research,1990,25(5):173-185.
[30] 姜义宝,杨玉荣,郑秋红.外源一氧化氮对干旱胁迫下苜蓿幼苗抗氧化酶活性和叶绿素荧光特性的影响[J].干旱地区农业研究,2008,26(2):65-68.
[31] 樊洪泓,李廷春,李正鹏,等.强光胁迫下外源NO对霍山石斛叶绿素荧光和抗氧化系统的影响[J].园艺学报,2008,35(8):1215-1220.
[32] 谭石慈,邢达,唐永红,等.植物叶片超微弱发光光谱研究[J].光子学报,2000,29(11):961-965.
[33] 李德红,唐永红,何永红,等.白菜叶绿体的超弱发光机理初探[J].激光生物学报,2002,11(1):64.
[34] Boveris A,Cadenas E,Chance B.Ultraweak chemiluminescence:a sensitive assay for oxidative radical reactions[J].Federation Proceedings,1981,40:125-128.
