HDACI、8在肺泡II型上皮细胞间质转化中的表达及意义
2013-04-10姜巍徐国萍
姜巍,徐国萍
(1.大理学院临床医学院,云南大理671000;2.大理学院基础医学院,云南大理671000)
HDACI、8在肺泡II型上皮细胞间质转化中的表达及意义
姜巍1,徐国萍2*
(1.大理学院临床医学院,云南大理671000;2.大理学院基础医学院,云南大理671000)
目的:观察TGF-β1作用下,肺泡Ⅱ型上皮细胞RLE-6TN在EMT过程中HDAC1、8的表达情况及TSA对TGF-β1诱导细胞EMT的影响。方法:将TGF-β1加入到体外培养的细胞中,于不同时间收取细胞,采用WB及Real-time RT-PCR检测HDAC1、8及E-cad、α-SMA的表达情况。然后将TGF-β1加入经过TSA预处理的细胞中,于不同时间收取细胞,重新检测上述基因。结果:加入TGF-β1后,E-cad蛋白表达下调;α-SMA蛋白表达上调;HDAC1蛋白表达上调;HDAC8蛋白表达下调。E-cad mRNA表达下调α-SMA及HDAC8的mRNA均于12 h表达上调,6 h、24 h表达下调;HDAC1 mRNA表达于6 h下调,24 h上调。加入TSA后,E-cad蛋白表达上调;α-SMA、HDAC1及HDAC8蛋白的表达均下调。E-cad mRNA表达上调;α-SMA mRNA表达于6 h、12 h上调,24 h下调;HDAC1 mRNA表达下调;HDAC8 mRNA表达上调。结论:TGF-β1体外诱导的RLE-6TN细胞EMT,可以通过应用TSA抑制其获得α-SMA表型、失去E-cad表型,从而部分逆转TGF-β1诱导的肺泡Ⅱ型上皮EMT。
HDAC1;TGF-β1;TSA;肺泡Ⅱ型上皮细胞;EMT
肺纤维化(pulmonary fibrosis,PF)是各种间质性肺疾病所引起的慢性肺部疾病的共同结局,严重威胁着人类的健康。与其他器官纤维化一样,PF涉及到细胞、细胞因子、EMT(Epithelial-Mesenchymal Transition)等的共同参与〔1〕。EMT是指上皮细胞失去其特有的表型(E-cad),获得新的表型(α-SMA),转化为间质细胞。EMT参与调控器官的发生和其它生理病理过程,包括器官纤维化。组蛋白去乙酰化酶(HDACs)也在这些相关的过程中起着重要作用〔2〕。HDACs是平衡染色质重塑中组蛋白乙酰转移酶(HAT)乙酰化活动的酶类,二者间平衡在特定条件下被破坏,就会导致基因转录的失调及信号转导改变,从而引起基因表达异常,这种异常在纤维化和癌症的发生和发展中起着重要作用〔3〕。近年的研究表明,HDAC1在TGF-β1诱导的肝细胞EMT过程中发挥重要作用〔2〕,但是HDAC是否参与了肺泡上皮细胞EMT进程目前尚不清楚。本研究拟通过在体外培养大鼠肺泡Ⅱ型上皮细胞中加入TGF-β1,观察HDAC1、8和E-cad、α-SMA的表达情况,然后加入组蛋白去乙酰化酶抑制剂TSA,观察其对TGF-β1诱导的EMT的影响,探讨HDAC1、8在肺泡上皮细胞EMT过程中的作用及其机制,为肺纤维化的治疗开辟一条崭新道路。
1 材料与方法
1.1 材料
1.1.1 细胞培养SV40永生化大鼠肺泡Ⅱ型上皮细胞系RLE-6TN购自美国ATCC,细胞在37℃、5%CO2、饱和湿度的条件下用含10%胎牛血清的DMEM/F12培养基培养。
1.1.2 主要试剂TGF-β1购自R&D公司,单克隆抗E-cadherin抗体购自BD公司,单克隆抗α-SMA抗体及TSA购自Sigma公司,多克隆抗HDAC1、8抗体购自Proteintech Group公司,引物采用Primer3.0软件设计并由上海生工生物技术有限公司合成,RT-PCR Kit购自大连Takara公司。
1.1.3 主要仪器二氧化碳培养箱(Thermo Forma公司,USA),相差显微镜(Nikon,Japan),垂直式电泳仪及半干式转移仪(BIO-RAD),7900HT Fast Real-Time PCR System(Applied Biosystem,USA)。
1.2 方法
1.2.1 观察TGF-β1作用下,细胞的E-cad、α-SMA、HDAC1及HDAC8的表达情况
1.2.1.1实验分组实验分为:空白对照组、TGF-β1(3 ng/mL)诱导组。
1.2.1.2Western blot检测当细胞生长至70%~ 80%融合后加入含0.5%FBS的静止液同步化作用24 h,换成含TGF-β1(3 ng/mL,下同)的静止液分别作用0、12、24、48、72 h后裂解细胞提取总蛋白,BCA法测定浓度后取40 μg样品进行10%的十二烷基磺酸钠-聚丙烯酰胺凝胶变性电泳,然后转至PVDF膜,加入一抗,37℃1 h,4℃过夜。洗涤后加二抗,室温45 min,加入发光液后封膜、显影。扫描图像结果,并用Quantity-One软件计算灰度值。


表1 RT反应体系

表2 PCR反应体系
1.2.2 观察HDACi对TGF-β1诱导的细胞EMT的影响
1.2.2.1实验分组实验分为:空白对照组、TGF-β1组、TSA组及TSA与TGF-β1共用组。
1.2.2.2Western blot检测当细胞同步化作用24 h后,于新鲜静止液中加入TSA(300 nM,下同)预处理6 h,而后加入TGF-β1,余步骤同1.2.1.2。
1.2.2.3Real-time RT-PCR检测当细胞同步化作用24 h后,于新鲜静止液中加入TSA预处理6 h并加入TGF-β1,余步骤同1.2.1.3。
1.2.3 统计学处理多组比较采用单因素方差分析及Post Hoc检验,用SPSS19.0统计软件处理数据。
2 结果
2.1 TGF-β1对细胞EMT标志物及HDAC1、8表达的影响与对照组相比,上皮细胞标志物E-cad蛋白表达下调,以48 h最明显,为对照组的0.37倍(P<0.05);间质细胞标志物α-SMA蛋白表达上调,以48 h最明显,为对照组的2.87倍(P<0.01);HDAC1蛋白表达上调,以24 h最明显,为对照组的1.28倍(P<0.01);HDAC8蛋白表达上调,其中以72 h上调为对照组的1.19倍(P<0.01)最明显。见图1。
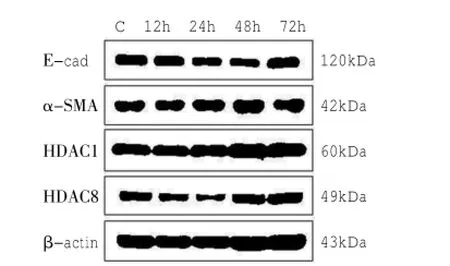
图1 TGF-β1对细胞EMT标志物及HDAC的表达情况
与对照组相比,E-cad mRNA的表达于6、12 h下调,分别为对照组的0.41倍、0.39倍,24 h上调,为对照组的1.1倍;α-SMA mRNA的表达于6、24 h下调,分别为对照组的0.79倍、0.88倍,12 h上调,为对照组的1.6倍;HDAC1 mRNA的表达6 h是下调的,为对照组的0.65倍,24 h是上调的,为对照组的1.3倍;HDAC8的表达于6、24 h下调,分别为对照组的0.68倍、0.95倍,但差异无统计学意义。见表3。

表3 TGF-β1对细胞EMT标志物及HDAC1、8表达的影响
2.2 TSA对TGF-β1诱导的细胞EMT的影响与对照组相比,加入TSA后,E-cad蛋白表达是上调的,以72 h为对照组的1.3倍(P<0.01)最为明显α-SMA、HDAC1及HDAC8蛋白的表达均是下调的,其中α-SMA于24 h为对照组的0.70倍(P< 0.01);HDAC1于12 h为对照组的0.78倍(P< 0.01);HDAC8于24 h为对照组的0.45倍(P<0.01)最为显著。见图2。

图2 TSA对TGF-β1诱导的细胞EMT的影响
与对照组相比,加入TSA后,E-cad mRNA的表达是上调的,为对照组的3.83倍、2.78倍、1.67倍;α-SMA mRNA的表达于6、12 h上调,分别为对照组的1.53倍、1.18倍,24 h下调,为对照组的0.7倍;HDAC1 mRNA的表达是下调的,分别为对照组的0.92倍、0.58倍、0.38倍。HDAC8的mRNA表达是上调的,分别为对照组的1.64倍、2.33倍、1.8倍但差异无统计学意义。见表4。
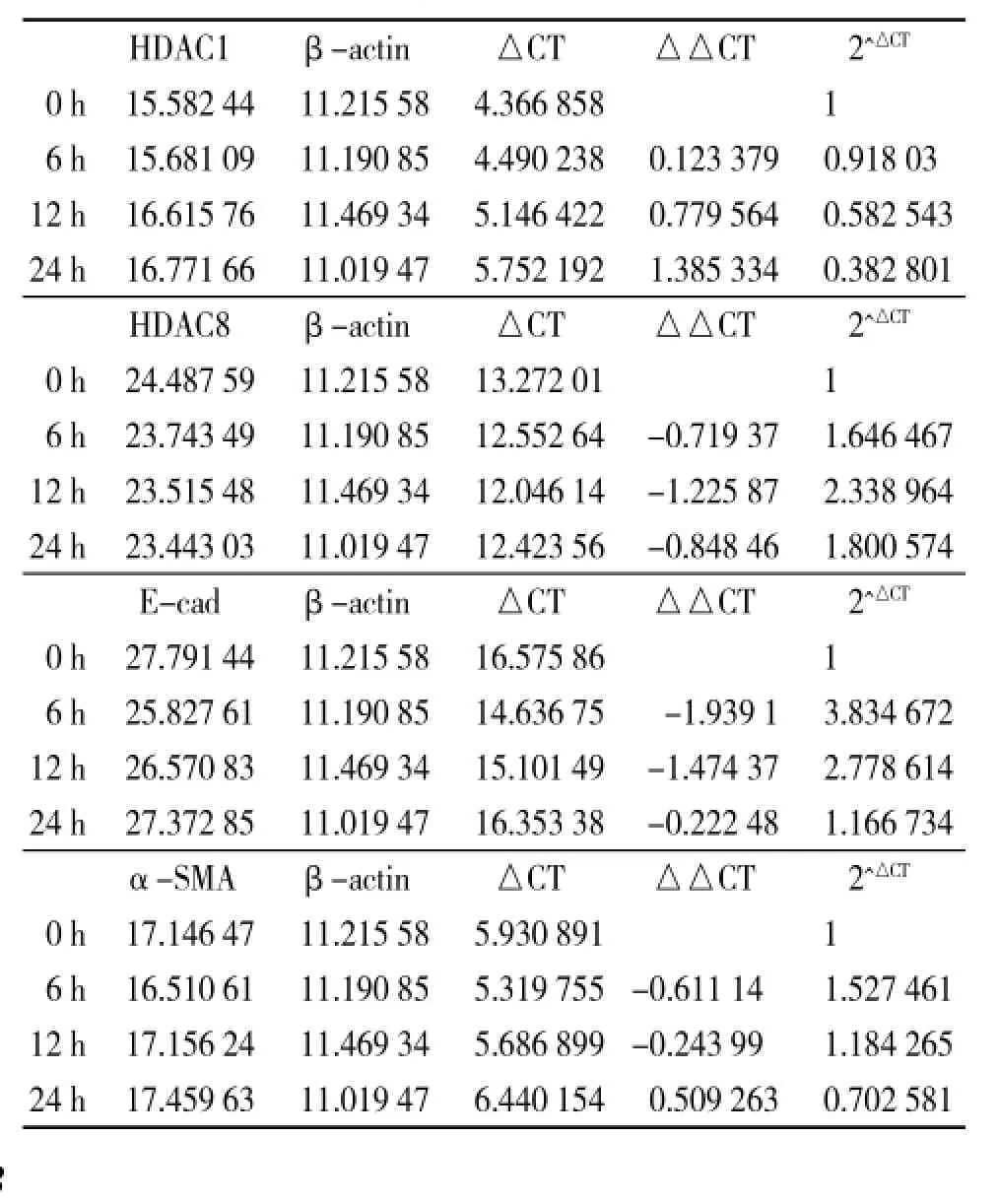
表4 TSA对TGF-β1诱导的细胞EMT的影响
3 讨论
肺间质纤维化时,其病灶内出现大量成肌纤维细胞(Myofibroblast,MFb)聚集,研究表明MFb是肺纤维化时主要的效应细胞。MFb的来源除了肺内固有的间充质细胞外,部分来自肺泡上皮细胞的的间质转变〔1〕。TGF-β1是一种最主要的促纤维化因子,在EMT过程中起着重要作用〔4〕,且这种转变是细胞内不同信号通路整合的结果〔5〕。本实验中,加入TGF-β1后,E-cad表达下调,α-SMA表达上调,细胞发生了EMT,这与文献报道〔6〕一致。
在表观遗传学中,基因的表达调控包括磷酸化、甲基化和乙酰修饰化等,其中组蛋白乙酰化和去乙酰化是最主要的方式,是基因表达的主要动力〔7〕。HDAC1已经被证明其在核小体组蛋白末端的去乙酰化作用中导致了组蛋白核心周围的DNA被包裹得更加紧密,而这个结果反过来导致了基因转录的抑制〔8〕。有研究表明,HDAC1参与调控EMT,能够抑制ZO-1和E-cad的启动子活性,并且在TGF-β1诱导的肝细胞EMT过程中是必须的〔2〕。本实验中加入TGF-β1后,肺泡Ⅱ型上皮细胞发生了EMT转变,在此过程中,观察到HDAC1的表达上调,表明HDAC1可能通过抑制E-cad基因启动子活性参与TGF-β1诱导的EMT过程。同时,当肺泡上皮向间质细胞转变过程中,HDAC8表达上调并与α-SMA共表达与胞质内,呈细胞骨架样分布〔9〕,这与有研究表明在前列腺组织中HDAC8只表达在间质细胞及血管壁细胞中〔10〕的报道一致。
TSA是应用最广泛的HDACi,是一种非竞争性可逆的HDAC活性抑制剂,可以抑制I类和II类HDAC〔11〕。本实验中,加入TSA后,HDAC1、8的表达均下调,证明了其对HDAC1、8的抑制性,这种抑制性是通过减少转录因子SP1的表达水平来抑制TGF-β1诱导的Ⅰ型胶原在MFb上的表达〔12〕。正是由于TGF-β1的作用被抑制,从而抑制了EMT,这说明TSA可以抑制细胞发生EMT。实验中加入TSA后,HDAC8的mRNA表达上调与蛋白表达不一致可能是由于蛋白在翻译过程中部分修饰被抑制而mRNA的转录未被抑制有关,这种情况是否也发生在其它HDACi中以及具体机制尚需进一步研究。
综上所述,TGF-β1体外诱导的RLE-6TN细胞EMT,可以通过应用TSA部分逆转,进而达到抑制EMT、降低肺纤维化发病风险的目的。而抑制HDAC1、8的活性将可能成为抗纤维化治疗新的分子靶点。
〔1〕Brigham C,Willis.Induction of Epithelial-Mesenchymal Transition in Alveolar Epithelial Cells by Transforming Growth Factor-beta1〔J〕.American Journal of Pathology,2005,166(5):1321-1332.
〔2〕Lei Weiwei,Zhang Kehua,Song Jianguo,et al.Histone deacetylase 1 is required for transforming growth factorβ1-inducedepithelial mesenchymal transition〔J〕.The International Journal of Biochemistry&Cell Biology 2010,42:1489-1497.
〔3〕Pang Maoyin,Zhuang Shougang.Histone Deacetylase:A Potential Therapeutic Target for Fibrotic Disorders〔J〕.The Journal of Pharmacology and Experimental Therapeutics 2010,335(2):266-272.
〔4〕Kim K K,Kugler M C,Wolters P J,et al.Alveolar epithelial cellmesenchymaltransitiondevelopsinvivoduring pulmonary fibrosis and is regulated by the extracellular matrix〔J〕.Proc Natl Acad Sci USA,2006,103:13180-13185.
〔5〕徐国萍,高不郎,许祖德.TGF-β1与EGF对肺泡Ⅱ型上皮细胞表型及功能的影响〔J〕.大理学院学报,2011,10(6):17-20.
〔6〕徐国萍,李清泉,曹汐汐,等.Smad7对转化生长因子β1诱导的肺泡上皮细胞向间质细胞转变的影响〔J〕.中华医学杂志,2007,87(27)1918-1923.
〔7〕Minucci S,Pelicci P G.Histone deacetylase inhibitors and the promise of epigenetic(and more)treatments for cancer〔J〕.Nat Rev Cancer,2006,6:38-51.
〔8〕Glozak M A,Sengupta N,Zhang X,et al.Acetylation and deacetylation of non-histone proteins〔J〕.Gene,2005,363 15-23.
〔9〕David Waltregny,Wendy Glénisson,Siv Ly Tran,et al. HistonedeacetylaseHDAC8associateswithsmooth muscle α-actin and is essential for smooth muscle cell contractility〔J〕.The FASEB Journal,2005,19(8):966-968.
〔10〕David Waltregny,Laurence de Leval,Wendy Gle`nisson et al.Expression of Histone Deacetylase 8,a ClassⅠHistoneDeacetylase,IsRestrictedtoCellsShowing Smooth Muscle Differentiation in Normal Tissues〔J〕. American Journal of Pathology,2004,165(2):553-562.
〔11〕Yoshida M,Kijima M,Akita M.Potent and specific inhibition of mammalian histone deacetylase both in vivo and in vitro by trichostatin A〔J〕.J Biol Chem,1990,265:17174-17179.
〔12〕Ghosh A K,Mori Y,Dowling E,et al.Trichostatin A blocks TGFbeta-inducedcollagengeneexpressioninskin fibroblasts:involvement of Sp1〔J〕.Biochem Biophys Res Commun,2007,354:420-426.
(责任编辑 董杰)
Expression and Significance of Histone Deacetylase 1,8 in Alveolar Epithelial Type II Cells Mesenchymal Transition
JIANG Wei1,XU Guoping2*
(1.Clinical College,DaliUniversity,Dali,Yunnan 671000,China;2.Pre-clinical College,Dali University,Dali,Yunnan 671000,China)
Objective:To observe the expression of histone deacetylase 1,8 on the process of TGF-β1 induced type II alveolar epithelial cells to EMT,and investigate the effect of TSA on TGF-β1-induced the cells EMT process.Methods:RLE-6TN cell lines were cultured and treated with TGF-β1,and collected cells at different time points.The expression of markers and mRNA of E-cad α-SMA,HDAC1 and HDAC8 were assayed by Western Blot and Real-time RT-PCR,respectively.Then add TGF-β1 to the cells after TSA pretreatment for 6 hours and repeat the above assay.Results:With the treatment of TGF-β1,the expression of E-cad protein was down regulated;α-SMA,HDAC1 and HDAC8 protein was unregulated.E-cad mRNA was down regulated;both the mRNA of α-SMA and HDAC8 were up regulated at 12 h,and were down regulated at 6 h,24 h;HDAC1 mRNA at 6 h were down regulated,24 h was up regulated.After pretreated with TSA,the expression of E-cad protein was up regulated;α-SMA,HDAC1 and HDAC8 protein was down regulated.E-cad mRNA was up regulated;α-SMA mRNA at 6 h,12 h was up regulated,24 h was down regulated;HDAC1 mRNA was down regulated;HDAC8 mRNA was up regulated.Conclusion:It is possible to use TSA inhibited RLE-6TN cells to receive α-SMA phenotype,loss of E-cad phenotype,which partially reverse the EMT of RLE-6TN induced by TGF-β1 in vitro.
HDAC1;TGF-β1;TSA;alveolar epithelial type II cells;EMT
R563.1+3
A
1672-2345(2013)03-0016-04
国家自然科学基金青年科学基金资助项目(81100045)
2013-10-15
姜巍,硕士研究生,主要从事外科学研究. *通信作者:徐国萍,教授.
