体外循环过程中吸入七氟烷对婴幼儿心脏术后恢复过程影响的随机对照临床研究
2013-04-10熊红燕辛渭川雷兰萍金振晓
熊红燕,辛渭川,雷兰萍,金振晓
体外循环过程中吸入七氟烷对婴幼儿心脏术后恢复过程影响的随机对照临床研究
熊红燕,辛渭川,雷兰萍,金振晓
目的观察体外循环过程中吸入七氟烷对婴幼儿心脏手术后恢复过程及术后血清肌钙蛋白I(cTnI)含量的影响。方法 90例拟在体外循环下行根治手术的先天性心脏病患儿纳入本随机对照研究,随机分为七氟烷组(45例)和对照组(45例),七氟烷组在体外循环开始后通过氧合器吸入2%七氟烷,体外循环结束前停止吸入。对照组只给予空氧混合气。体外循环前后记录患儿血压,术后5个时间点(返回ICU即刻、ICU 3 h、ICU 6 h、ICU 12 h和ICU 24 h)取血样检测cTnI含量。术后恢复过程中其它参数如动脉血乳酸含量、血糖含量、呼吸机辅助呼吸时间、ICU 24 h尿量、ICU时间、术后正性肌力药物使用情况、术后住院时间、死亡和并发症发生情况同时记录。结果 两组患儿术前、术中各项参数无显著差异。七氟烷组患儿体外循环后动脉舒张压显著高于对照组(P=0.028)。七氟烷组术后死亡1例,对照组术后因呼吸功能不全二次插管2例。七氟烷组呼吸机辅助呼吸时间显著低于对照组(P=0.0064)。术后ICU时间、术后住院时间、术后24 h内5个时间点血清cTnI含量、血乳酸含量和血糖含量两组比较无显著差异。结论 体外循环中吸入2%七氟烷在一定程度上有利于改善婴幼儿心脏手术后的恢复,对术后cTnI的血清含量无显著影响。
婴幼儿;体外循环;七氟烷;肌钙蛋白I
吸入麻醉剂的抗心肌缺血/再灌注损伤作用在成人心脏手术过程中已经进行了大量的深入的研究。但是吸入麻醉剂对小婴儿和婴幼儿心脏手术围术期临床转归的影响研究甚少,Malagon等[1]的研究表明,与丙泊酚比较,七氟烷维持麻醉并不能显著降低婴幼儿心脏手术后肌钙蛋白(cardiac troponin,cTn)T的释放量。cTnI是心肌梗死的特异性血清标志物[2],也是婴幼儿心肌损伤的可靠标志物[3],其血清含量较cTnT高,对于心肌损伤的诊断较cTnT更敏感。本研究在婴幼儿体外循环过程中全程应用2%七氟烷,以血清cTnI含量为心肌损伤的主要指标,观察七氟烷对婴幼儿心脏手术围术期的心肌保护效应和临床转归的影响。
1 病例与方法
1.2 麻醉方法 麻醉前用药为阿托品0.02 mg/kg
1.1 病例纳入与分组 获得医院伦理委员会和患儿家长的同意后,连续90例拟在体外循环心脏停搏下行心脏畸形根治手术的患儿纳入本随机对照前瞻性临床研究。纳入标准:体重低于10 kg;排除标准:术前合并肺炎、严重心衰、呼吸衰竭需要机械辅助呼吸、心内畸形合并主动脉弓部畸形需深低温停循环下进行手术、合并其它系统疾病、术前7天内使用糖皮质激素、术中转为非体外循环或不停跳姑息手术、患儿监护人要求退出研究、研究中出现其它意外情况被迫终止研究的。患儿按照计算机生成随机数表随机分配到七氟烷组和对照组,每组45例。和咪唑安定0.5 mg/kg,麻醉诱导前30 min给予。麻醉诱导方案为七氟烷吸入+苏芬太尼(1 mg/kg,i.v.)+潘克罗尼(0.2 mg/kg,i.v.)。麻醉维持采用下列两种方法之一:咪唑安定[0.2 mg/(kg·h)]持续静脉注射或者2%七氟烷(雅培,美国)经氧合器(CAPIOX®RX05 Baby RXTM,泰尔茂,日本)持续吸入。所有患儿同时进行苏芬太尼[2 mg/(kg·h)]持续静脉注射。麻醉诱导后采用空氧混合气机械通气,体外循环开始后机械通气停止。
1.3 体外循环与围术期监护数据采集 全身肝素化(3 mg/kg)及体外循环插管后即开始体外循环,动脉流量为150~200 ml/(kg·min)。根据患儿体重不同,预充量在370~750 ml之间,预充液成分包括醋酸盐缓冲液、甘露醇、红细胞、血浆和肝素。体外循环期间的体温维持在鼻咽温度28℃左右。所有患儿在体外循环结束后进行改良超滤。患儿转入ICU后于返回ICU即刻、ICU 3 h、6 h、12 h和24 h等5个时间点抽取血样(0.5 ml),送临床检验科检测cTnI含量(Beckman Coulter Inc.Fullerton,美国)。动脉血葡萄糖和乳酸含量采用血气分析仪(ABL800睿智,雷度公司,丹麦)检测。同时记录48 h内液体平衡、患儿机械通气时间、血管活性药物用量。为了量化正性肌力药物用量,正性肌力药物指数(inotrope score,IC)采用以下公式计算:IC=多巴胺×1+米力农×15+肾上腺素×100[1-2,4-6]。
1.4 统计学分析 回顾性分析15例患儿的资料,其术后cTnI水平(SD)是56.8(27.2)ng/ml。如果以组间差异为15 ng/ml,α=0.05,可信限80%进行样本量分析表明需要86例患儿。正态分布数据用均数±标准差表示,采用ANOVA和Bonferroni矫正的post-hoc分析,非正态分布数据采用均数±标准差()和95%可信限表示,采用Mann Whitney检验进行比较。cTnI血清浓度数据为非正态分布,先经过对数转换,然后采用重复测量的ANOVA检验及Bonferroni's矫正。计数资料采用卡方检验分析。正态分布数据变量间的相关性分析采用Pearson检验,非正态分布变量间的相关性分析采用Spearman检验,P<0.05认为相差具有显著性。
2 结 果
2.1 两组术前和术中临床参数比较 两组患儿在性别、年龄、体重、紫绀、麻醉后动脉氧分压、手术类型、体外循环时间、升主动脉阻闭时间、心室切口、心肌保护液用量和灌注次数、体外循环中红细胞比容、超滤量、尿量等多项参数均没有显著差异,见表1。
2.2 两组术后各项临床参数比较 术后两组患儿返回ICU后均行机械辅助呼吸,总体机械通气时间在七氟烷组显著低于对照组(P=0.0064),术后24 h尿量、引流量、各时间点正性肌力药物指数、血清乳酸含量、葡萄糖浓度、ICU监护时间、术后住院时间、围术期用血量均无显著差异。对照组有2例患儿因呼吸功能不全进行了二次插管呼吸机辅助呼吸,但是没有围术期死亡;七氟烷组有1例患儿于术后第8天误吸,心跳骤停,心肺复苏,并行二次插管呼吸机辅助呼吸,于术后第10天死亡。见表2。
2.3 两组体外循环前后血压变化比较 两组患儿在体外循环前血压参数没有差异;体外循环后,七氟烷组患者动脉舒张压较对照组显著升高(P=0.028),而收缩压和平均压较对照组没有显著变化,见表3。
2.4 两组术后血清cTnI含量比较 两组患儿返回ICU即刻血清cTnI含量均显著升高,ICU 3 h时达到最高值,随后逐渐下降,到ICU 24 h仍然处于较
高水平。但是两组患儿血清cTnI含量在对应时间点比较,均无显著差异。两组患儿血清cTnI浓度随时间变化的曲线下面积数据仍然为非正态分布,经过对数转换后成为正态分布数据,非配对随机数据t检验显示仍然无显著差异,见表4。单变量相关性分析表明ICU 3 h时cTnI血清含量与是否使用七氟烷及术前紫绀情况无显著相关性,但是与术中采用右心室切口有相关性[r=0.30(0.10,0.48),P=0.0018]。紫绀患儿ICU 3 h时cTnI血清含量为61.89(32.54,91.24)μg/L,与非紫绀患儿45.97(33.77,58.17)μg/L比较无显著差异(P=0.178)。采用右心室切口患儿ICU 3 h时cTnI血清含量为73.39(42.42,112.4)μg/L显著高于未采用右心室切口的患儿43.45(31.90,55.00)μg/L(P=0.002)。
表1 两组患儿术前基本参数比较(n=45,
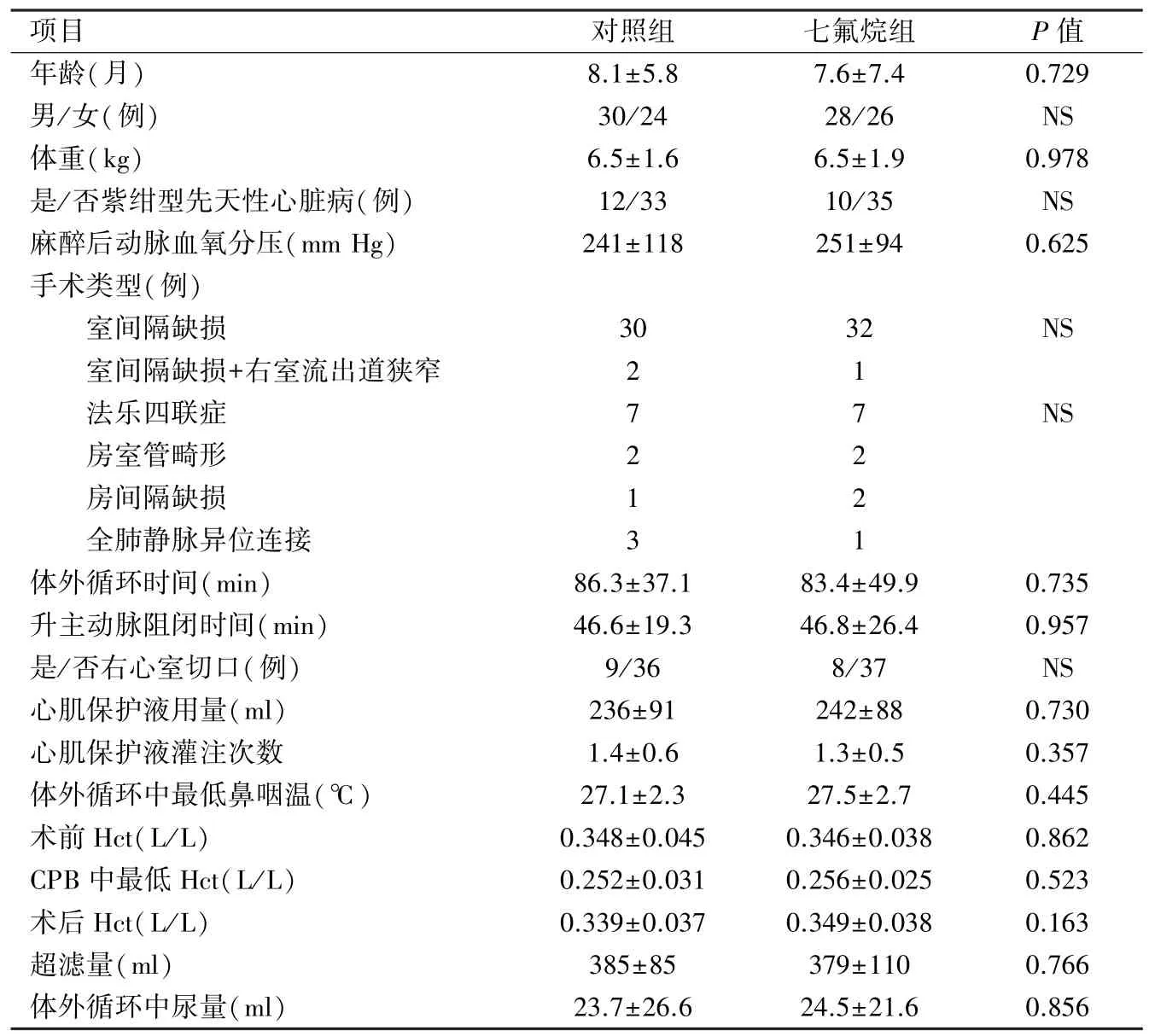
表1 两组患儿术前基本参数比较(n=45,
项目对照组七氟烷组P值年龄(月)8.1±5.87.6±7.40.729男/女(例)30/2428/26NS体重(kg)6.5±1.66.5±1.90.978是/否紫绀型先天性心脏病(例)12/3310/35NS麻醉后动脉血氧分压(mm Hg)241±118251±940.625手术类型(例)室间隔缺损3032NS室间隔缺损+右室流出道狭窄21法乐四联症77NS房室管畸形22房间隔缺损12全肺静脉异位连接31体外循环时间(min)86.3±37.183.4±49.90.735升主动脉阻闭时间(min)46.6±19.346.8±26.40.957是/否右心室切口(例)9/368/37NS心肌保护液用量(ml)236±91242±880.730心肌保护液灌注次数1.4±0.61.3±0.50.357体外循环中最低鼻咽温(℃)27.1±2.327.5±2.70.445术前Hct(L/L)0.348±0.0450.346±0.0380.862 CPB中最低Hct(L/L)0.252±0.0310.256±0.0250.523术后Hct(L/L)0.339±0.0370.349±0.0380.163超滤量(ml)385±85379±1100.766体外循环中尿量(ml)23.7±26.624.5±21.60.856
表2 两组患儿术后临床参数比较(n=45,或×95%可信区间)

表2 两组患儿术后临床参数比较(n=45,或×95%可信区间)
项目对照组七氟烷组P值术后机械通气时间(h)38.8[25.7,51.9]24.9[18.7,31.1]0.0064 ICU 24 h尿量(ml)518±142506±1410.665 ICU 24 h引流量(ml)44.8±25.953.9±34.30.123 ICU时间(d)5.37[4.18,6.56〛3.89[3.38,4.40〛0.1119术后住院时间(d)12.0±5.510.6±2.40.087死亡(例)01NS二次插管(例)21NS正性肌力药物指数ICU 0 h5.6±4.05.6±3.70.911 3 h5.1±4.15.4±4.80.747 6 h5.0±4.05.4±8.70.744 12 h4.2±3.84.9±8.10.607 24 h3.8±3.93.3±2.90.496 48 h2.8±3.02.8±3.00.916血乳酸含量(mmol/L)ICU 0 h3.0±1.63.0±1.90.918 3 h2.3±1.82.4±2.50.798 6 h1.9±1.02.3±2.00.173 12 h1.7±1.01.7±1.90.479 24 h1.3±0.61.5±1.80.603 48 h1.0±0.41.2±1.90.293血糖含量(mmol/L)ICU 0 h161±51154±400.433 3 h173±73152±370.164 6 h153±61153±520.944 12 h138±35145±490.411 24 h127±34122±350.499 48 h112±28109±210.622输血量悬浮红细胞(U)2.3±0.72.3±1.20.924血浆(ml)291±102274±1610.514
表3 两组患儿体外循环前后血压变化比较(n=45,)
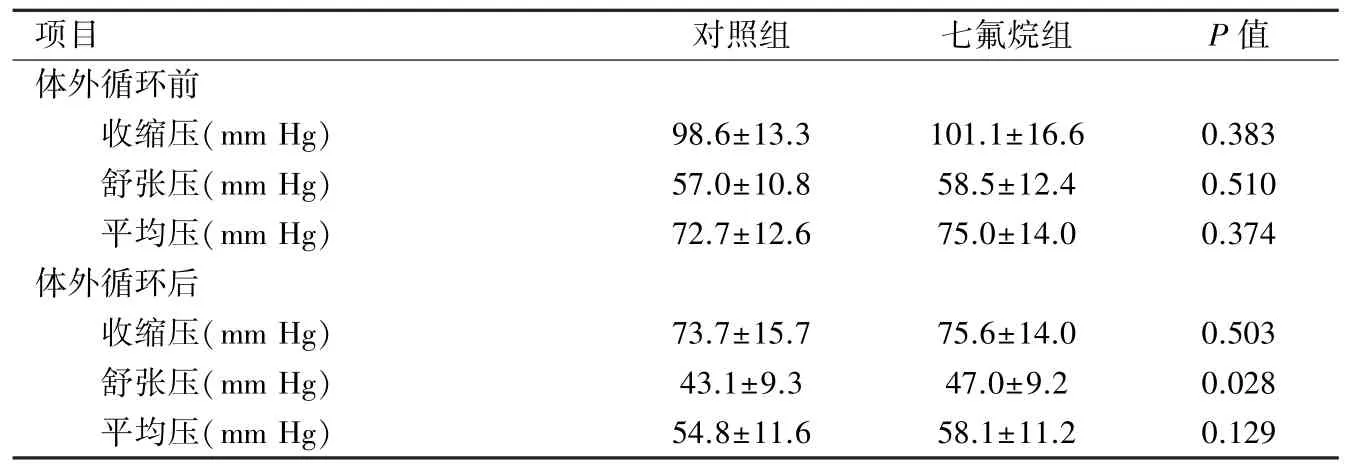
表3 两组患儿体外循环前后血压变化比较(n=45,)
项目对照组七氟烷组P值体外循环前收缩压(mm Hg)98.6±13.3101.1±16.60.383舒张压(mm Hg)57.0±10.858.5±12.40.510平均压(mm Hg)72.7±12.675.0±14.00.374体外循环后收缩压(mm Hg)73.7±15.775.6±14.00.503舒张压(mm Hg)43.1±9.347.0±9.20.028平均压(mm Hg)54.8±11.658.1±11.20.129
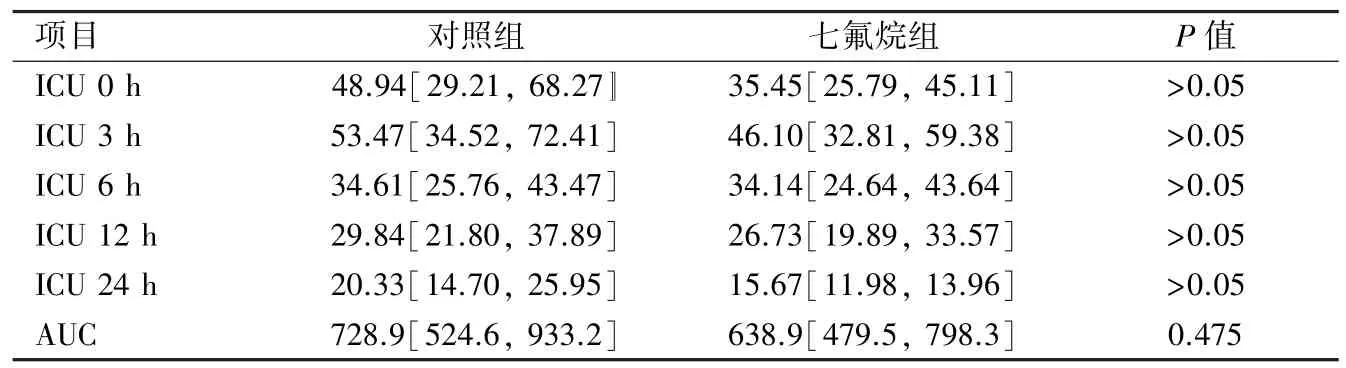
表4 不同时间点两组患儿术后血清cTnI含量(μg/L)及曲线下面积[μg/(L·h)]比较[n=45,X(95%可信限)]
3 讨 论
先天性心脏病患儿进行心脏畸形矫治手术过程中,通常会经历一定时间的心肌缺血。动物实验研究表明吸入麻醉剂[7]、吗啡和其它阿片类药物可以模拟缺血预处理的心肌保护作用[8],也被称为麻醉预处理。但是,缺血预处理现象在婴幼儿心肌上是否也存在还缺乏证据。有学者认为,相比较于成人心肌,婴幼儿心肌对于体外循环心脏手术过程中心肌缺血的耐受能力较强[9]。但是近来的研究表明,婴幼儿心肌对缺氧和心脏停搏液带来的损伤更加敏感[10]。而且,紫绀型患儿的心肌在体外循环开始后还要暴露在高氧环境下,这相当于再灌注损伤。多数临床研究表明,与以咪唑安定和丙泊酚为基础的全静脉麻醉相比,心脏手术过程中应用吸入麻醉剂能改善心脏手术患者的恢复过程[11-12]。吸入麻醉剂可以降低心脏手术患者的围术期死亡率已经写入2011年发表的专家共识[13]。
3.1 体外循环过程中全程吸入2%七氟烷对患儿的心肌保护效应 缺血预处理在儿童人群中还没有广泛研究。对大鼠的研究表明,刚刚出生的大鼠并不具有经典的缺血预处理现象,1周后,缺血预处理才对心脏收缩功能的恢复有促进作用[14]。Baker等在未缺氧的未成熟离体兔心上可以诱导出缺血预处理现象[15],同时他们也发现,出生后处于慢性缺氧状态的未成熟兔心上不能诱导出预处理现象,即使增加预处理次数也不行。动物实验提示[16],怀孕大鼠暴露在慢性间断缺氧环境下,新生大鼠立即进行缺血预处理过程,单独进行孕期操作或者生后操作都不能增强其对随后缺氧的耐受性,但是联合应用这两种方法却具有增强对缺氧耐受性的作用。
吸入麻醉剂可以改善顿抑心肌收缩功能的恢复。七氟烷可以模拟预处理效应,改善离体豚鼠心脏缺血后收缩功能[17]。七氟烷可以缩小犬的心肌梗死范围,降低预处理效应的时间阈值[18-19],其心肌保护作用不依赖于冠脉血流量的变化和心脏做功的降低。七氟烷除了具有预处理作用,还具有抗再灌注损伤作用,此作用可能归功于其自由基清除能力和抑制缺血后中性粒细胞黏附作用[20]。
cTn的血清含量被认为是心肌损伤的最好的血清标志物[21],无论是在敏感性还是特异性上都优于磷酸肌酸激酶(CKMB)、乳酸脱氢酶(LDH)等曾经常用的心肌损伤标志物。cTn复合体包括3个成分,即cTnT、cTnI和cTnC,由于cTnC在骨骼肌中也有表达,因此不具有心脏特异性[22],cTnT和cTnI就成为临床诊断心肌损伤的主要指标,这两者都常用于先心病患儿术后心肌损伤程度的监测[1,4-6,23]。相关研究表明,监测cTnT的抗体与骨骼肌肌钙蛋白有交叉反应[24],而cTnI则无论在新生儿期还是在其它已知的病理情况下,均未见在心脏之外的其它组织中表达[25],因此,cTnI具有更好的特异性。本研究检测到的患儿术后cTnI浓度与有的报道类似[26-28],与其它研究者报道的结果有差异[29],这可能反映了不同的患者群以及不同的心肌保护策略导致的术后cTnI释放量不同,更主要的原因可能是不同研究采用的cTnI检测系统不同导致的cTnI绝对值差异较大[30]。因此,比较不同研究者报道的cTnI血清水平的绝对值来判断某种心肌保护效果优于或者劣于另外一种心肌保护策略似乎不可行。
体外循环对紫绀型患儿的作用类似于再灌注损伤。Allen[31]在体外循环开始10 min后采集紫绀型和非紫绀型患儿的心肌样本,测定抗氧化能力,发现紫绀型患儿心肌组织快速氧合后,内源性组织抗氧化剂迅速耗竭。笔者的研究采用单因素分析表明,紫绀对术后cTnI的释放量没有影响,但是总体上紫绀患儿术后cTnI释放量高于非紫绀型患儿。本研究还发现,与术后cTnI峰值相关的因素主要是右心室切口,这与笔者之前的研究结果相同[5]。
本研究提示体外循环过程中全程应用2%七氟烷对婴幼儿心脏手术后cTnI的释放量没有显著影响。如果儿童也具有缺血预处理效应,本研究中七氟烷似乎没有表现出其在成人身上具有的预处理效果。
3.2 体外循环过程中全程吸入2%七氟烷对患儿术中血流动力学的影响 动物研究表明,七氟烷抑制小鼠心脏功能,2%的七氟烷显著降低心输出量和左室射血分数,左室舒张末和收缩末容积[32]。对体外循环下心脏手术的患者的研究表明[33],体外循环过程中吸入1%~2%的七氟烷有助于维持低温体外循环术中患者体循环阻力的稳定,而不用吸入麻醉剂的患者容易出现体循环阻力逐渐升高。Ueda等[34]发现体外循环过程中使用七氟烷调控灌注压与氯普鲁马嗪相比更安全,更容易维持足够的体外循环阻力,停止体外循环后使用的去甲肾上腺素更少。Rodig等[35]发现体外循环中吸入1.5MAC的七氟烷可以显著降低体循环阻力,同时患者血液中儿茶酚胺含量也显著下降。这些研究结果表明,体外循环中吸入七氟烷对体循环阻力有明显的调节作用,其效果与剂量相关。但是,这些研究的对象都是成年患者,对婴幼儿体循环阻力的影响还未见报道。笔者的研究发现,体外循环结束后,七氟烷组患儿动脉舒张压较对照组有显著升高,尽管升高的幅度只有不足4 mm Hg。本研究没有对整个体外循环过程中患儿体循环阻力进行计算和测量,是否吸入七氟烷有助于保护体外循环后患儿的血管反应性,进而有助于患儿的恢复(如本研究发现的术后七氟烷组机械辅助呼吸时间缩短),还需要深入研究。
3.3 体外循环过程中全程吸入2%七氟烷对患儿术后恢复的影响 迄今为止,虽然有许多研究发现,吸入麻醉剂可以降低围术期心肌损伤血清标志物的水平[29,36-40]。也有很多研究在未检测到心肌损伤血清标志物水平降低的情况下,仍然有助于改善患者的术后恢复,如Piriou等[41]对冠状动脉旁路移植术患者于体外循环前吸入七氟烷(1MAC)进行预处理,结果对cTnI释放量没有影响,对心肌组织中保护性信号转导途径蛋白含量没有影响,但是术后预处理组患者低心脏指数发生率低于对照组。De Hert等[11]也发现,吸入七氟烷虽然不能降低冠状动脉旁路移植术后cTnT的释放量,但是可以显著降低术后住院时间和术后1年内死亡率。也正是因为这些研究结果,吸入麻醉剂可以降低心脏手术患者的围术期死亡率已经成为专家共识[13]。本研究发现,体外循环中全程吸入2%七氟烷虽然没有显著降低术后cTnI的释放量,但是仍然可以改善患儿的术后恢复,表现为显著缩短术后机械辅助呼吸的时间,其中具体的机制仍然需要深入研究。
4 结 论
婴幼儿心脏手术体外循环过程中吸入2%七氟烷麻醉,可以改善患儿的术后恢复过程,但是不能降低心肌损伤标志物cTnI的释放量。
[1] Malagon I,Hogenbirk K,van Pelt J,et al.Effect of three different anaesthetic agents on the postoperative production of cardiac troponin T in paediatric cardiac surgery[J].Br J Anaesth,2005,94(6):805-809.
[2] Kemp M,Donovan J,Higham H,et al.Biochemical markers of myocardial injury[J].Br J Anaesth.2004,93(1):63-73.
[3] Immer FF,Stocker F,Seiler AM,et al.Troponin-T:improved diagnostic assessment of myocardial damage in childhood[J].Acta Paediatr,1997,86(12):1321-1327.
[4] Liu Y,Zhang SL,Duan WX,et al.The myocardial protective effects of a moderate-potassium blood cardioplegia in pediatric cardiac surgery:a randomized controlled trial[J].Ann Thorac Surg,2012,94(4):1295-1301.
[5] Jin Z,Duan W,Chen M,et al.The myocardial protective effects of adenosine pretreatment in children undergoing cardiac surgery:a randomized controlled clinical trial[J].Eur J Cardiothorac Surg,2011,39(5):e90-96.
[6] Jin ZX,Zhang SL,Wang XM,et al.The myocardial protective effects of a moderate-potassium adenosine-lidocaine cardioplegia in pediatric cardiac surgery[J].J Thorac Cardiovasc Surg,2008,136(6):1450-1455.
[7] Cason BA,Gamperl AK,Slocum RE,et al.Anesthetic-induced preconditioning:previous administration of isoflurane decreases myocardial infarct size in rabbits[J].Anesthesiology,1997,87(5):1182-1190.
[8] Schultz JJ,Hsu AK,Gross GJ.Ischemic preconditioning and morphine-induced cardioprotection involve the delta(delta)-opioid receptor in the intact rat heart[J].J Mol Cell Cardiol,1997,29(8):2187-2195.
[9] Hammon JW Jr.Myocardial protection in the immature heart[J].Ann Thorac Surg,1995,60(3):839-842.
[10] Taggart DP,Hadjinikolas L,Wong K,et al.Vulnerability of paediatric myocardium to cardiac surgery[J].Heart,1996,76(3):214-217.
[11] De Hert S,Vlasselaers D,Barbé R,et al.A comparison of volatile and non volatile agents for cardioprotection during onpump coronary surgery[J].Anaesthesia,2009,64(9):953-960.
[12] Landoni G,Bignami E,Oliviero F,et al.Halogenated anaesthetics and cardiac protection in cardiac and non-cardiac anaesthesia[J].Ann Card Anaesth,2009,12(1):4-9.
[13] Landoni G,Augoustides JG,Guarracino F,et al.Mortality reduction in cardiac anesthesia and intensive care:results of the first International Consensus Conference[J].HSR Proc Intensive Care Cardiovasc Anesth,2011,3(1):9-19.
[14] Awad WI,Shattock MJ,Chambers DJ.Ischemic preconditioning in immature myocardium[J].Circulation,1998,98(19 Suppl):II206-1213.
[15] Baker JE,Holman P,Gross GJ.Preconditioning in immature rabbit hearts:role of KATPchannels[J].Circulation,1999,99(9):1249-1254.
[16] Ostádalová I,Ostádal B,Jarkovská D,et al.Ischemic preconditioning in chronically hypoxic neonatal rat heart[J].Pediatr Res,2002,52(4):561-567.
[17] Novalija E,Fujita S,Kampine JP,et al.Sevoflurane mimics ischemic preconditioning effects on coronary flow and nitric oxide release in isolated hearts[J].Anesthesiology,1999,91(3):701-712.
[18] Toller WG,Kersten JR,Pagel PS,et al.Sevoflurane reduces myocardial infarct size and decreases the time threshold for ischemic preconditioning in dogs[J].Anesthesiology,1999,91(5):1437-1446.
[19] Hara T,Tomiyasu S,Sungsam C,et al.Sevoflurane protects stunned myocardium through activation of mitochondrial ATP-sensitive potassium channels[J].Anesth Analg,2001,92(5):1139-1145.
[20] Heindl B,Reichle FM,Zahler S,et al.Sevoflurane and isoflurane protect the reperfused guinea pig heart by reducing postischemic adhesion of polymorphonuclear neutrophils[J].Anesthesiology,1999,91(2):521-530.
[21] Jaffe AS.Troponin--past,present,and future[J].Curr Probl Cardiol,2012,37(6):209-228.
[22] Parmacek MS,Solaro RJ.Biology of the troponin complex in cardiac myocytes[J].Prog Cardiovasc Dis,2004,47(3):159 -176.
[23] Chen Y,Liu J,Li S,et al.Which is the better option during neonatal cardiopulmonary bypass:HTK solution or cold blood cardioplegia[J]?.ASAIO J,2013,59(1):69-74.
[24] Jaffe AS,Vasile VC,Milone M,et al.Diseased skeletal muscle:a noncardiac source of increased circulating concentrations of cardiac troponin T[J].J Am Coll Cardiol,2011,58(17):1819-1824.
[25] Thygesen K,Mair J,Katus H,et al.Recommendations for the use of cardiac troponin measurement in acute cardiac care[J].Eur Heart J,2010,31(18):2197-2204.
[26] Montgomery VL,Sullivan JE,Buchino JJ.Prognostic value of pre-and postoperative cardiac troponin I measurement in children having cardiac surgery[J].Pediatr Dev Pathol,2000,3(1):53-60.
[27] Ma J,Li XH,Yan ZX,et al.Effect of myocardial protection during beating heart surgery with right sub-axiliary approach[J].Chin Med J(Engl),2009,122(2):150-152.
[28] Carmona F,Manso PH,Vicente WV,et al.Risk stratification in neonates and infants submitted to cardiac surgery with cardiopulmonary bypass:a multimarker approach combining inflammatory mediators,N-terminal pro-B-type natriuretic peptide and troponin I[J].Cytokine,2008,42(3):317-324.
[29] De Hert SG,Van der Linden PJ,et al.Cardioprotective properties of sevoflurane in patients undergoing coronary surgery with cardiopulmonary bypass are related to the modalities of its administration[J].Anesthesiology,2004,101(2):299-310.
[30] Pretorius CJ,Wilgen U,Ungerer JP.Serial cardiac troponin differences measured on four contemporary analyzers:relative differences,actual differences and reference change values compared[J].Clin Chim Acta,2012,413(21-22):1786-1791.
[31] Allen BS,Rahman S,Ilbawi MN,et al.Detrimental effects of cardiopulmonary bypass in cyanotic infants:preventing the reoxygenation injury[J].Ann Thorac Surg,1997,64(5):1381-1388.
[32] Gentry-Smetana S,Redford D,Moore D,et al.Direct effects of volatile anesthetics on cardiac function[J].Perfusion,2008,23(1):43-47.
[33] Rodig G,Keyl C,Wiesner G,et al.Effects of sevoflurane and isoflurane on systemic vascular resistance:use of cardiopulmonary bypass as a study model[J].Br J Anaesth,1996,76(1):9-12.
[34] Ueda T,Mizuguchi K,Tsuji T,et al.Regulation of perfusion pressure during cardiopulmonary bypass using sevoflurane[J].Int J Artif Organs,2001,24(1):30-33.
[35] Rodig G,Keyl C,Kaluza M,et al.Effects of rapid increases of desflurane and sevoflurane to concentrations of 1.5 MAC on systemic vascular resistance and catecholamine response during cardiopulmonary bypass[J].Anesthesiology,1997,87(4):801-807.
[36] Bein B,Renner J,Caliebe D,et al.The effects of interrupted or continuous administration of sevoflurane on preconditioning before cardio-pulmonary bypass in coronary artery surgery:comparison with continuous propofol[J].Anaesthesia,2008,63(10):1046-1055.
[37] Hellstrom J,Owall A,Bergstrom J,et al.Cardiac outcome after sevoflurane versus propofol sedation following coronary bypass surgery:a pilot study[J].Acta Anaesthesiol Scand,2011,55(4):460-467.
[38] Cromheecke S,Pepermans V,Hendrickx E,et al.Cardioprotective properties of sevoflurane in patients undergoing aortic valve replacement with cardiopulmonary bypass[J].Anesth Analg,2006,103(2):289-296.
[39] De Hert SG,Van der Linden PJ,Cromheecke S,et al.Choice of primary anesthetic regimen can influence intensive care unit length of stay after coronary surgery with cardiopulmonary bypass[J].Anesthesiology,2004,101(1):9-20.
[40] Julier K,da Silva R,Garcia C,et al.Preconditioning by sevoflurane decreases biochemical markers for myocardial and renal dysfunction in coronary artery bypass graft surgery:a double-blinded,placebo-controlled,multicenter study[J].Anesthesiology,2003,98(6):1315-1327.
[41] Piriou V,Mantz J,Goldfarb G,et al.Sevoflurane preconditioning at 1 MAC only provides limited protection in patients undergoing coronary artery bypass surgery:a randomized bicentre trial[J].Br J Anaesth,2007,99(5):624-631.
Effect of sevoflurane inhalation during cardiopulmonary bypass on post-operative courses of pediatric patients undergoing cardiac surgery:a randomized controlled clinical trial
Xiong Hong-yan,Xin Wei-chuan,Lei Lan-ping,Jin Zhen-xiao
Department of Cardiovascular Surgery,Xijing Hospital,Fourth Military Medical University,Xi'an 710032,China Corresponding author:Jin Zhen-xiao,Email:jinzx10262@aliyun.com
ObjectiveTo investigate the effect of sevoflurane inhalation during cardiopulmonary bypass(CPB)on post-operative courses and serum cardiac troponin I(cTnI)concentrations in pediatric patients undergoing cardiac surgery.MethodsNinety patients undergoing congenital heart defects repair with CPB were investigated in this prospective randomized controlled study.They were randomized into two groups:sevoflurane group,who received 2%sevoflurane during CPB through oxygenator,and control group,who received only air-oxygen mixture.Arterial blood pressures were recorded before and immediately after CPB.The cTnI was measured five times during the first 24 h following admission to the pediatric intensive care unit(ICU).Other variables measured included arterial blood lactate,glucose,and fluid balance,use of inotropic drugs,ventilator hours,ICU days and post-operative hospital days.ResultsThe pre and intra operative parameters were comparable between the two groups.There was a slightly but statistically significant increase of arterial diastolic pressure in sevoflurane group immediately after CPB compared with control patients(47.0±9.2 mmHg vs 43.1±9.3 mmHg,P=0.028).There was one death in sevoflurane group due to cardiac arrest,and two patients in control group committed re-intubation due to respiratory dysfunction.The post operative ventilation time(in mean[95%confidence interval])was shorter in sevoflurane group than that in control group(24.9[18.7,31.1]h vs 38.8[25.7,51.9]h,P=0.0064).The post operative ICU time,hospital days and serial serum cTnI concentrations,blood lactate and glucose content had no significantly difference between the two groups.ConclusionInhalation of 2%sevoflurane during CPB is helpful to the recovery of pediatric patients undergoing cardiac surgery,but has no significant effect on the post operative cTnI release.
Pediatric;Cardiopulmonary bypass;Sevoflurane;Cardiac troponin I
R654.1
A
1672-1403(2013)04-0224-07
2013-06-17)
2013-07-16)
陕西省攻关计划项目(2012SF2-21-1,2012K15-02-01)
710032西安,第四军医大学第一附属医院心血管外科(熊红燕、雷兰萍、金振晓);710003西安,西安市中心医院胸心外科(熊红燕、辛渭川)
金振晓,Email:jinzx10262@aliyun.com
