乌司他丁对外源性过氧化氢介导内皮细胞损伤的保护作用
2013-04-10雷兰萍魏毅君熊红燕金振晓
雷兰萍,魏毅君,熊红燕,杨 阳,陈 涛,金振晓
·基础研究·
乌司他丁对外源性过氧化氢介导内皮细胞损伤的保护作用
雷兰萍,魏毅君,熊红燕,杨 阳,陈 涛,金振晓
目的研究乌司他丁对外源性过氧化氢介导的内皮细胞损伤的保护作用。方法 体外培养的人脐静脉内皮细胞(HUVECs)培养液中加入外源性过氧化氢(250 μmol/L)制作内皮细胞损伤模型,加入不同浓度的乌司他丁(100、500、1 500、3 000和5 000 U/ml),MTT法检测内皮细胞存活率,同时检测培养液中乳酸脱氢酶(LDH)活性、一氧化氮含量和弹性蛋白酶活性,并测定内皮细胞黏附能力。结果 外源性过氧化氢可以显著降低内皮细胞存活率,同时培养液中LDH活性显著升高、一氧化氮含量显著降低、弹性蛋白酶活性显著升高,内皮细胞黏附能力下降。乌司他丁虽然可以在一定程度上抑制细胞培养液中弹性蛋白酶活性的升高,但是对细胞存活率、LDH的释放、一氧化氮的释放、细胞黏附能力均无明显改善作用。结论 本研究采用的乌司他丁剂量对外源性过氧化氢介导的内皮细胞损伤无明显保护效果。
乌司他丁;内皮细胞;过氧化氢;弹性蛋白酶
血管内皮细胞介于血液与组织间,发挥着屏障作用,同时具有多种生理功能,对维持内环境的稳定起着积极作用。内皮功能异常是II型糖尿病患者血管并发症的始发因素[1]。氧化应激是糖尿病患者血管内皮功能异常的重要原因[2]。抗氧化治疗对于预防和治疗糖尿病性血管病变具有重要的临床意义[3]。内皮细胞氧化应激过程中,会出现溶酶体膜不稳定和溶酶体内蛋白酶的释放,是氧化应激造成内皮细胞损伤的重要机制。采用适当措施稳定溶酶体膜并对抗这些蛋白酶对细胞内结构和细胞膜结构的溶解破坏作用是对抗氧化应激损伤的重要方法。目前,临床上最常用的蛋白酶抑制剂是乌司他丁,乌司他丁是一种从正常男性尿液中提取的蛋白酶抑制剂,常用于对抗过度炎症反应引起的各种组织损伤[4]。本研究的主要目的是观察乌司他丁是否能在体外抑制过氧化氢介导的内皮细胞损伤,并初步探讨其对内皮细胞的保护作用的可能机制。
1 材料与方法
1.1 试剂、细胞与仪器 重组人肿瘤坏死因子α(rhTNF-α)(R&D公司,美国),干扰素γ(IFN-γ)(R&D公司,美国),乌司他丁(广州天普药业公司)。人脐静脉内皮细胞株由第四军医大学第一附属医院心血管外科实验室提供,小牛血清(杭州四季青公司),DMEM低糖培养液(Hyclone,美国),胰蛋白酶(Sigma,美国),MTT(Sigma公司),乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所),弹性蛋白酶活性的检测试剂盒(南京建成生物工程研究所),DMSO(Sigma,美国),细胞裂解液(碧云天,上海)。弹性蛋白酶细胞荧光探针AAPV Elastase CellProbeTMReagent(Beckman公司,美国)。CO2细胞培养箱(Forma,美国),酶标仪(Biotech,美国),超净工作台(苏州净化设备仪器厂),倒置显微镜(O-lympus,日本),低速离心机(赛特湘仪,湖南)。
1.2 人脐静脉内皮细胞(HUVECs)的培养、准备与实验分组 HUVECs用含10%小牛血清的DMEM细胞培养液在37℃,5%CO2培养箱内培养2~3 d。待细胞融合后,用0.25%胰蛋白酶消化。镜下观察到细胞收缩变圆时弃去消化液,加入培养液以终止胰蛋白酶的作用。用滴管吹打壁上的细胞,使其完全脱落并分离。根据实验需要按2×105/ml接种于96孔培养板中。待细胞融合后,换用无血清的DMEM培养液培养24 h,使细胞同步化,然后即可进行分组实验。过氧化氢浓度为250 μmol/L,实验分为7组:对照组,H2O2损伤组,H2O2+乌司他丁保护组(乌司他丁浓度分别为100、500、1 500、3 000和5 000 U/ml)。对照组,HUVECs在DMEM中孵育4 h;H2O2损伤组,HUVECs在含有H2O2的DMEM中孵育4 h;H2O2+乌司他丁保护组,HUVECs在含有H2O2和不同浓度乌司他丁的DMEM中孵育4 h。孵育完成后,收集培养液用于其它检测。
1.3 MTT法检测不同浓度乌司他丁对过氧化氢介导HUVECs损伤后细胞存活率的影响 加入DMEM培养液(100 μl)和含0.5%MTT的培养液(10 μl),37℃,5%CO2培养箱内孵育4 h后,弃培养液,加入100 μl的DMSO原液,振荡10 min,待结晶完全溶解后,同时用酶标仪于490 nm波长处测定吸光值(OD值),实验重复3次。
1.4 培养液中LDH含量的测定 LDH试剂盒购至南京建成生物工程研究所,按照试剂盒说明书对上述收集到的培养液进行LDH含量检测。实验重复3次。
1.5 培养液中一氧化氮(NO)含量的测定 以Griess法测定细胞培养液中NO含量[5]。方法简述如下:100 μl细胞培养液与100 μl的Griess试剂(1%磺胺溶于2.5%磷酸与等体积的0.1%萘乙二胺盐酸盐混合液)在室温下反应10 min,在酶标仪上于540 nm测定吸光度。根据NaNO2的标准曲线,计算出细胞培养液中NO的含量。实验重复3次。
1.6 培养液中弹性蛋白酶活性的检测 培养液中中性粒细胞弹性蛋白酶活性采用显色性底物方法检测,弹性蛋白酶将其特异性底物N-methoxysucciny-Ala-Ala-Pro-Val-p-nitroanilide分解后,释放出pnitroanilide,即可在分光光度计测定其含量。方法简述如下:培养上清液400 g离心10 min后,加入含有显色底物和NaCl(0.5 M)的Tris-HCl(0.1 mM)缓冲液,37℃孵育10 min,0.1 M NaOH终止反应,弹性蛋白酶消化底物释放出的p-nitroanilide的含量在405 nm波长分光光度计下检测。以损伤组的平均OD值为1,其它各组培养液中弹性蛋白酶的活性表示为1的倍数。实验重复3次。
1.7 黏附实验测定细胞黏附能力 实验方法参照文献报道[6],具体为:细胞种于50 ml培养瓶中,各组细胞处理4 h后,PBS洗3遍,用0.25%胰蛋白酶进行消化,离心、重悬后,每组细胞计数5×105/ml,种于96孔板,每组8个复孔。接种0.5 h后弃去培养液,加入DMEM培养液(100 μl)和含0.5%MTT的培养基(10 μl),37℃、5%CO2培养箱内孵育4 h,倒置显微镜拍照,不同观察者对同一视野的细胞计数。实验重复3次。
1.8 细胞内活性氧(reactive oxygen species,ROS)含量测定 参照文献报道[7],ROS可以将非荧光的2′,7′-DCFH-DA转化能发出荧光的DCFH。内皮细胞接种在黑色96孔板中,进行分组处理后,PBS(pH 7.4)洗涤然后加入含有DCFH-DA(20 μM)的PBS,37°C孵育2 h.孵育结束后,FLX 800型微孔板荧光检测仪(Biotech Instruments Inc.,USA)检测荧光(波长530 nm)强度,激发光波长为485 nm。无细胞微孔为本底值。以对照孔的平均荧光强度为100,结果表示为对照孔荧光强度的百分比。
1.9 统计学分析 统计学处理应用SPSS 12.0统计软件进行统计分析,所有实验数据均以均数±标准差(mean SD)表示,采用Mann-Whitney检验进行组间比较,P<0.05为有统计学差异。
2 结 果
2.1 MTT法检测乌司他丁对H2O2致HUVECs损伤的保护 H2O2可以显著降低内皮细胞存活率,而本研究采用的乌司他丁剂量都没有显著提高内皮细胞存活率。见图1。

图1 MTT法检测不同处理组内皮细胞存活率比较
2.2 培养液中LDH含量 各组细胞处理后检测培养液中的LDH含量与单纯DMEM孵育组相比,过氧化氢与HUVECs共孵育可引起培养液中LDH含量的显著升高。本研究采用的乌司他丁剂量均未能显著抑制过氧化氢与HUVECs共孵育引起的培养液中LDH的升高。见图2。
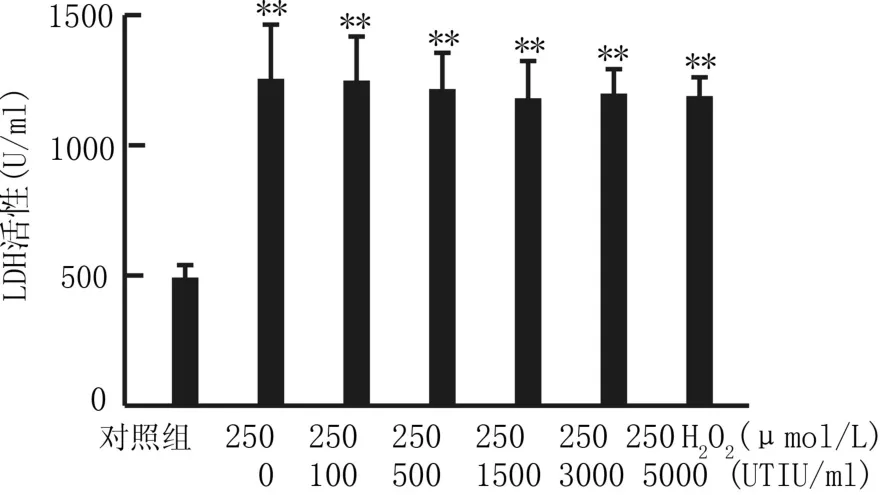
图2 不同处理组内皮细胞培养液中LDH含量比较
2.3 培养液中NO含量的检测 各组细胞处理后检测培养液中的NO含量,与单纯DMEM孵育组相比,过氧化氢与HUVECs共孵育可以引起培养液中NO含量的显著下降。本研究采用的乌司他丁剂量均未能显著抑制过氧化氢与HUVECs共孵育引起的培养液中NO含量下降。见图3。
2.4 培养液中弹性蛋白酶活性的检测 各组细胞处理后检测培养液中的弹性蛋白酶的活性,对照组HUVECs的培养液中几乎检测不到弹性蛋白酶的活性,过氧化氢与HUVECs共孵育可以引起培养液中弹性蛋白酶活性显著升高。超过3 000 U/ml的乌司他丁可有效抑制过氧化氢与HUVECs共孵育引起的培养液中弹性蛋白酶活性。见图4。

图3 不同处理组内皮细胞培养液中NO含量比较

图4 不同处理组内皮细胞培养液中弹性蛋白酶活性比较
2.5 黏附实验测定细胞黏附能力 各组细胞处理后黏附0.5 h后细胞计数统计学分析,见图5,结果表明H2O2可以有效降低内皮细胞黏附能力,而不同浓度乌司他丁均未能显著增加内皮细胞黏附能力。
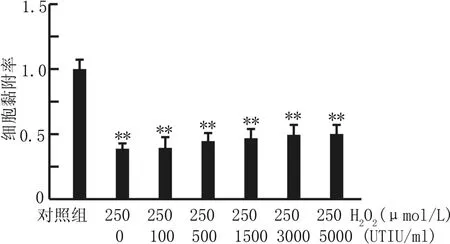
图5 不同处理组内皮细胞黏附能力的比较
2.6 细胞内活性氧含量测定 各组细胞处理后检测细胞内活性氧物质含量,以对照组HUVECs中ROS含量为100,过氧化氢与HUVECs共孵育可以引起细胞内ROS含量显著升高。本研究采用的乌司他丁剂量未能有效抑制过氧化氢与HUVECs共孵育引起的细胞内ROS含量的升高。见图6。

图6 不同处理组内皮细胞内ROS含量的比较
3 讨 论
H2O2能很容易地穿透细胞膜自由进入细胞,在细胞核内的H2O2可转变成具有高活性羟自由基,从而造成DNA链断裂,导致细胞损伤[8]。LDH是细胞损伤后释放到细胞外的细胞内容物,其在细胞外的活力反映细胞损伤的程度[9]。本实验中H2O2损伤组HUVECs培养液中LDH含量明显升高,这表明H2O2能引起内皮细胞损伤,同时抑制细胞的增殖代偿能力。内皮细胞的黏附能力也是血管内皮损伤后修复能力的体现,本研究结果提示过氧化氢处理可以显著降低培养内皮细胞的黏附能力,表明循环血液中氧化应激水平的升高确实可以对内皮的损伤修复能力造成损害。内皮细胞内活性氧含量反映了细胞内氧化应激的水平,而细胞培养液中弹性蛋白酶的含量反映的是内皮细胞损伤后,溶酶体释放的细胞溶解酶的释放量。NO是由内皮细胞合成的血管活性物质,它具有舒张血管平滑肌,抑制异常增殖和炎症反应,以及抑制血小板聚集等作用[10]。内皮源性NO对心血管系统具有广泛而明确的调控作用,维持正常的NO水平,对心血管保护作用具有重要的意义。II型糖尿病患者常有血管内皮功能异常,内皮源性NO表达减少[5]。
本实验中不同剂量的乌司他丁虽然在一定程度上降低了细胞培养液中弹性蛋白酶的活性,但是不能对抗外源性H2O2损伤造成的内皮细胞存活率下降,也不能抑制内皮细胞LDH的释放,不能抑制内皮细胞内活性氧物质的升高,不能改善外源性过氧化氢损伤后内皮细胞的黏附能力及提高培养液中的NO含量,提示乌司他丁对这种外源性过氧化氢造成的内皮细胞损伤没有明显的保护作用。
[1] Petrofsky JS.The effect of type-2-diabetes-related vascular endothelial dysfunction on skin physiology and activities of daily living[J].J Diabetes Sci Technol,2011,5(3):657-667.
[2] Yang H,Jin X,Kei Lam CW,et al.Oxidative stress and diabetes mellitus[J].Clin Chem Lab Med,2011,49(11):1773 -1182.
[3] Drummond GR,Selemidis S,Griendling KK,et al.Combating oxidative stress in vascular disease:NADPH oxidases as therapeutic targets[J].Nat Rev Drug Discov,2011,10(6):453-471.
[4] Ogawa M,Nishibe S,Mori T,et al.Effect of human urinary trypsin inhibitor on granulocyte elastase activity[J].Res Commun Chem Pathol Pharmacol,1987,55(2):271-274.
[5] Craige SM,Chen K,Pei Y,et al.NADPH oxidase 4 promotes endothelial angiogenesis through endothelial nitric oxide synthase activation[J].Circulation,2011,124(6):731-740.
[6] Huang PH,Chen YH,Chen YL,et al.Vascular endothelial function and circulating endothelial progenitor cells in patients with cardiac syndrome X[J].Heart,2007,93(12):1064-1070.
[7] Liu HT,Li WM,Xu G,et al.Chitosan oligosaccharides attenuate hydrogen peroxide-induced stress injury in human umbilical vein endothelial cells[J].Pharmacol Res,2009,59(3):167-175.
[8] Jiang J,Zou J,Zhu L,et al.Degradation of methylene blue with H2O2activated by peroxidase-like Fe3O4 magnetic nanoparticles[J].J Nanosci Nanotechnol,2011,11(6):4793-4799.
[9] Giordano G,Hong S,Faustman EM,et al.Measurements of Cell Death in Neuronal and Glial Cells[J].MethodsMol Biol,2011,758:171-178.
[10] Huang PH,Chen JS,Tsai HY,et al.Globular adiponectin improves high glucose-suppressed endothelial progenitor cell function through endothelial nitric oxide synthase dependent mechanisms[J].J Mol Cell Cardiol,2011,51(1):109-119.
The protective effects of ulinastatin against exogenous H2O2-induced vascular endothelial cells injury
Lei Lan-ping,Wei Yi-jun,Xiong Hong-yan,Yang Yang,Chen Tao,Jin Zhen-xiao.
Department of Cardiovascular Surgery,Xijing Hospital,Fourth Military Medical University,Xi'an 710032,China Corresponding author:Jin Zhen-xiao.Email:jinzx10262@aliyun.com
ObjectiveTo investigate the protective effect of ulinastatin on exogenous H2O2-induced vascular endothelial cells injury.MethodsIn vitro H2O2mediated endothelial cell injury model was established by adding H2O2(250 μmol/L)into the Human umbilical vein endothelial cells(HUVECs)culture system.Serial concentrations(100,500,1 500,3 000 and 5 000 U/ml)of ulinastatin were added to the culture system.Cellular viability was determined with MTT assay;lactate dehydrogenase(LDH)content,NO content and elastase activity in the culture medium were examined.Cellular adhesive ability was also measured.ResultsThe co-culture process of H2O2and HUVECs significantly decreased the viability and adhesive ability of HUVECs,decreased the NO content and increased the LDH and elastase content in the culture medium.Ulinatatin inhibited the changes of medium elastase contents at some level,but had no significant effects on cellular viability and adhesive ability.It had no significant effects on the medium content of LDH,NO either.ConclusionUlinastatin,in the dose used in this study,has no significant protective effects on H2O2mediated endothelial cell injury.
Ulinastatin;Endothelial cell;H2O2;Elastase.
R654.1
A
1672-1403(2013)04-0238-04
2013-07-15)
2013-07-26)
陕西省攻关计划项目(2012SF2-21-1,2012K15-02-01);天普研究基金项目(01201104)
710032西安,第四军医大学第一附属医院心血管外科(雷兰萍、段维勋、杨 阳、陈 涛、金振晓);721004宝鸡,解放军第三医院神经外科(魏毅君);710003西安,西安市中心医院胸心外科(熊红燕)
金振晓,Email:jinzx10262@aliyun.com
