肺动脉灌注压力对体外循环后肺功能的影响
2013-04-10张仁腾汪曾炜王辉山宋恒昌
张仁腾,汪曾炜,王辉山,姜 辉,宋恒昌,李 宁
·基础研究·
肺动脉灌注压力对体外循环后肺功能的影响
张仁腾,汪曾炜,王辉山,姜 辉,宋恒昌,李 宁
目的本实验在之前研究的基础上进一步探索体外循环过程中,保护液肺动脉灌注时,不同的灌注压力对体外循环后肺功能的影响。方法20只健康家犬随机平均分为一个对照组及三个灌注组,模拟临床体外循环肺损伤特点建立动物模型。体外循环期间,分别以三个不同的压力段(低:15~20 mm Hg,中:25~30 mm Hg,高:40~45 mm Hg)对灌注组动物实验肺实施保护液灌注,对照组动物无保护液灌注。90 min体外循环肺缺血后,再灌注4 h,行实验肺肺功能变化测定。结果较之基础值,4组动物实验肺各项肺功能指标均有不同程度的恶化。较之对照组,中压灌注组各指标的变化幅度均明显减低。较之中压组,低压组的变化幅度进一步减低。高压组各指标的变化幅度稍低于对照组,但无明显统计学意义。结论体外循环过程中,保护液肺动脉灌注可有效缓解体外循环后肺功能损害。灌注压力是影响肺保护效果的重要因素,30 mm Hg以下的灌注压力是安全而有效的,15~20 mm Hg的效果更佳;高至40~45 mm Hg的灌注压力,未见明显有益的肺保护效应。不同灌注压力下的液体流量负荷和对肺血管内皮细胞的机械应力,可能是灌注压力影响肺保护效果的重要机制。
体外循环;肺损伤;肺功能;肺动脉灌注;灌注压力
大量研究证明,肺缺血及体外循环炎症反应双重因素导致体外循环肺损伤[1-2],肺功能障碍是影响术后恢复的重要因素。近来,保护液控制性灌注在体外循环肺保护的研究中取得积极的成果[3-5]。之前的动物实验,我们以灌注压力、时机、时间作为保护液灌注的三个变量建立肺动脉灌注模式,实验证明,该模式可有效缓解体外循环肺组织损伤,保护肺功能[6-7]。
然而,肺动脉灌注是一把双刃剑,正如Halldorsson的研究[8]所示,灌注压力不仅可影响保护液的流量和分布,而且也直接决定液体灌注对肺血管的机械应力。过高的机械应力或流量可能会损伤内皮细胞并影响组织内环境的稳定,而保护液灌注不足或分布不均可能达不到肺保护的效果。本实验力图进一步探索不同灌注压力对体外循环后肺功能的影响,以期获得更为安全有效的灌注压力。
1 材料与方法
1.1 动物模型的建立 20只健康家犬(15~20 kg)建立测压及输液通路。麻醉诱导后,插入气管插管,连接呼吸机,采用容量控制模式,潮气量10~15 ml/kg,呼气末正压3 mm Hg,吸入氧浓度50%~60%,气管插管采用双腔气管导管(该类型气管插管有利于根据需要变换双侧通气或任一单侧通气)。麻醉维持以微量泵持续输注丙泊酚50~150 μg/(kg· min)。7 F的热稀释肺动脉导管由右侧颈内静脉送入主肺动脉备测肺动脉压及心输出量。正中开胸,进入心包及两侧胸膜腔,游离左侧肺动脉、左侧肺静脉及右侧肺动脉。各组于左心房置测压管备测压。静脉注射4 mg/kg肝素,检测活化凝血时间(activated coagulation time,ACT)大于480 s后,分别于升主动脉及右心房插管建立体外循环,采用储血罐、转流泵、鼓泡式氧合器等装置。以适量晶体液、胶体液、碳酸氢钠及甘露醇预充、排气后,并行循环,保持平均灌注压60 mm Hg左右,流量约60~90 ml/(kg· min),降温至鼻咽温32℃。根据情况适当静脉应用多巴胺(或间腔胺)、硝普钠泵入调节血压稳定。
对照组仅阻闭左肺动脉,并调整气管插管及潮气量行右侧单肺通气。灌注组以8 F的DLP管经主肺动脉切口送入左肺动脉根部以备保护液灌注之用,结扎左肺动脉根部阻闭带,固定DLP管的同时,阻闭左肺动脉血流;于左肺动脉阻闭带远侧置测压管,备测保护液灌注压力;同时,调整气管插管及潮气量行右侧单肺通气。
在左肺动脉阻闭期间,各组均暂时阻闭左侧肺静脉根部,以避免左心房含氧血逆向传导至左肺血管而影响肺缺血的效果;于左侧上、下肺静脉各切一小口(约3 mm长),以使左肺内支气管动脉血或肺保护液回流通畅。各组90 min后,开放左肺动脉,并恢复左肺机械通气。同时,以5-0聚丙烯线缝合左侧肺静脉切口,开放左侧肺静脉[9]。
左肺再灌注后,渐减少体外循环流量,体温满意、循环稳定后停止体外循环。继续以丙泊酚泵入维持镇静。左肺再灌注4 h后,测定左肺肺功能的变化。实验过程中,保持电解质、血气指标、红细胞比容在满意范围。
1.2 保护液肺动脉灌注方法在左肺动脉阻闭期间,各组动物分别行如下保护液灌注操作:对照组:不行保护液肺动脉灌注。低压灌注组:分别于左肺动脉阻闭之初及开放之前,以改良低钾右旋糖酐(Low potassium dextran,LPD)保护液行左肺动脉灌注,每次约3~4 min,保持灌注压力15~20 mm Hg。两次保护液的温度分别为8℃和25℃。在保护液灌注期间,调整气管插管及潮气量暂时行双侧通气。中压灌注组:保持灌注压力25~30 mm Hg。其余同低压灌注组。高压灌注组:保持灌注压力40~45 mmHg。其余同低压灌注组。
1.3 LPD保护液的配置 保护液的成分包括:右旋糖酐40(40 g/L),葡萄糖(15 g/L),胰岛素(3 u/L),Na2HPO4(6.4 g/L),NaH2PO4(0.6 g/L),NaCl(3 g/L),KCl(0.45 g/L),前列腺素E1(250 μg/L),甲泼尼龙(200 mg/L),山莨菪碱(50 mg/L),L-精氨酸(2.0 g/L)[10]。上述药品及试剂均购自国药集团化学试剂有限公司。溶液中Na+浓度为146 mmol/L,K+浓度为6.0 mmol/L。胶体渗透压24~28 mm Hg,稍高于正常血浆胶体渗透压。适当滴加H3PO4溶液,调整保护液pH值为7.7~7.8。
1.4 左肺功能变化的测定 分别于体外循环前(基础状态)及左肺动脉再灌注4 h后,暂时阻闭右侧肺动脉,并调整气管插管及潮气量行左侧单肺通气,使循环血流及机械通气量完全通过左肺动脉及左主支气管进入左肺,保持循环稳定,获得下述肺功能指标的相关数据后,开放右肺动脉及右主支气管,并调节潮气量至原值。
1.4.1 肺血管阻力指数(pulmonary vascular resistance index,PVRI)。该指标计算公式:PVRI(dyn× sec×cm-5)=(PAP-LAP)÷CO×80,其中,PAP为平均肺动脉压,LAP为平均左心房压力,CO为心输出量。LAP通过左心房测压管测得;PAP通过肺动脉导管测得;CO的测量根据热稀释法,取三次测量的平均值。测心排量的仪器使用美国爱德华(Edwards)公司Swan-Ganz导管。
1.4.2 动态肺顺应性(dynamic lung compliance,Cd)。即指在呼吸过程中,单位压力所引起的吸气容量改变,即:Cd=⊿V/⊿P。在使用呼吸机的情况下,动态肺顺应性可表示为潮气量与(气道峰压-呼气末正压)的比值,即Cd=Vt/(PIP-PEEP)(ml/mm Hg)。测量时,动物充分镇静,阻断自主呼吸,并吸净气管内分泌物。
1.4.3 左肺氧合指数(PaO2/FiO2)。循环平稳后,抽取动脉血3 ml,行血气分析检测氧分压。动脉血氧分压(PaO2)与吸氧浓度(FiO2)之比,即左肺氧合指数,反应左肺氧合状况。
左肺功能指标的基础值(Fb)与再灌注后值(Fp)的差值,与基础值的比值表示再灌注4 h后肺功能的变化,即:肺功能的变化=|Fb-Fp|÷Fb[8]。测量时,控制同一动物前后两个时间段左侧单肺通气的参数于相似水平,吸氧浓度(FiO2)均调至100%。
1.5 统计方法计量数据以均数±标准差表示。采用SAS 8.0软件进行统计分析,同一指标的多组间比较以方差分析证明其差异性(F检验);若多组比较存在明显差异性,同一指标各组两两间比较用SNK检验(q检验),在设定α=0.05的水平上,判断同一指标两组间差异是否有统计学意义。
2 结 果
表1示左肺再灌注4 h后,4组动物左肺功能指标的变化比例。较之基础值,再灌注4 h后,4组动物左肺顺应性及肺氧合指数均有不同程度下降,肺血管阻力有不同程度升高。较之对照组,中压灌注组和低压灌注组上述各指标的变化幅度均明显减低(P<0.01)。较之中压灌注组,低压灌注组上述肺功能指标的变化幅度进一步减低(P<0.01)。高压灌注组上述各项肺功能指标的变化幅度稍低于对照组,但二者差异无明显统计学意义。见表1。
3 讨 论
体外循环心脏手术过程中肺组织面临着缺血再灌注损伤及循环炎性介质的双重威胁[11-12]。本实验模型设计充分考虑到体外循环致肺损伤因素:①实验肺(左肺)肺动脉阻断90 min后再灌注,模拟临床心脏手术时肺缺血损伤;②实验肺缺血期间,同时体外循环转流,模拟临床非生理循环的炎症反应。
与实际临床操作不同,实验过程中,我们并未制造心脏停跳:①避免了因心肌缺血再灌注损伤产物对肺损伤检测指标(如有实验可能以丙二醛或其他心肺共同损伤产物作为判断指标)造成干扰;②简化了手术操作,减少了动物创伤,使实验动物较长时间地安全耐受手术,顺利通过实验。
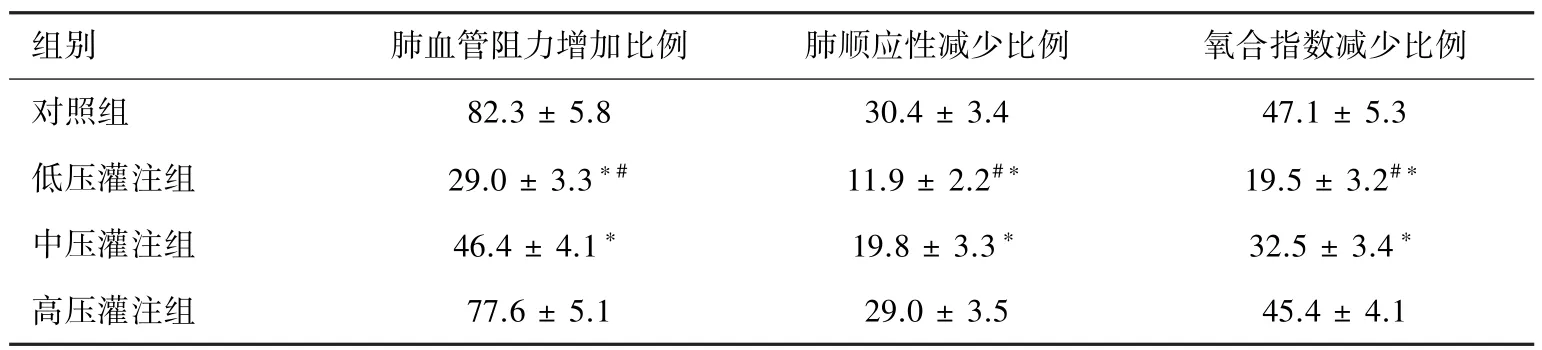
表1 再灌4 h后,左肺功能变化比例(%,|基础值-再灌注后值|/基础值)
在之前的实验中,我们以灌注压力、时机、时间作为控制体外循环过程中肺动脉保护液灌注的变量,实验证明,选择合适的保护液,在适当的灌注压力、时机和时间的情况下,肺动脉灌注可提高肺血管内皮细胞及肺组织对缺氧及炎症反应的耐受性,有效缓解体外循环肺组织损伤,保护肺功能[6]。在该灌注模式中,灌注压力作为控制保护液灌注的标准,不仅关乎保护液的流量和分布,也直接决定了保护液与肺组织,尤其是与血管内皮细胞之间的机械应力(切应力、压应力、牵张力),是影响灌注效果的重要指标。
本实验对照组及三个灌注组的实验数据对比显示,不同的灌注压力确实严重影响肺功能的变化。较之对照组,体外循环肺缺血过程中以中压和低压对实验肺进行保护液灌注均可明显缓解再灌注后肺功能的恶化;较之中压组,低压灌注的保护效果更为明显;当灌注压力进一步升高至40~45 mm Hg,较之对照组,肺功能的恶化程度未见明显缓解。基于上述结果,我们可能得出如下结论:在肺组织遭受体外循环炎症反应及缺血-再灌注损伤的情况下,较之更高的灌注压力,15~20 mm Hg的灌注压力及与之相应的机械应力既能保证有效的液体流量和分布,有助于发挥对血管内皮及血气屏障的保护作用[13-15],又能避免因高灌注压力所导致的组织内液体负荷过重及血管内皮应力损伤的风险。Halldorsson等[8]在肺缺血再灌注损伤的实验中亦发现:较之更高的灌注压力,肺缺血期间20~30 mm Hg的保护液灌注压力具有更好的肺保护效果。可见,在肺动脉灌注过程中,灌注压力的精确调控对于实现有效肺保护具有至关重要的意义。
总之,在肺动脉保护液灌注过程中,灌注压力是影响肺保护效果的重要因素,对于本实验灌注模式,30 mm Hg以下的灌注压力较为合适,15~20 mm Hg的灌注压力更为安全和有效,高至40~45 mm Hg的灌注压力,未见明显有益的肺保护效应。不同灌注压力下的液体流量负荷和对肺血管内皮细胞的机械应力,可能是灌注压力影响肺保护效果的重要机制。
本实验有一定的局限性。首先,本实验所设压力范围有限,仍有进一步降低的空间;其次,本实验所用动物,是健康的低龄动物,无基础心肺病变及症状,必然具有较低的肺动脉压、肺血管阻力,这有利于保护液在组织中扩散和分布。因此,在体外循环背景下,低于15~20 mm Hg的灌注压力将会对肺功能产生怎样的影响?对于其他动物(如伴有肺动脉高压或基础心脏病变),肺动脉灌注过程中不同的灌注压力将会产生怎样的效果?值得进一步研究。
[1]Chai PJ,Williamson JA,Lodge AJ,et al.Effects of ischemia on pulmonary dysfunction after cardiopulmonary bypass[J].Ann Thorac Surg,1999,67(3):731-735.
[2]Kuratani T,Matsuda H,Sawa Y,et al.Experimental study in a rabbit model of ischemia-reperfusion lung injury during cardiopulmonary bypass[J].J Thorac Cardiovasc Surg,1992,103(3):564-568.
[3]Halldorsson A,Kronon M,Allen BS,et al.Controlled reperfusion after lung ischemia:implications for improved function after lung transplantation[J].J Thorac Cardiovasc Surg,1998,115(2):415-425.
[4]Wei B,Liu Y,Wang Q,et al.Lung perfusion with protective solution relieves lung injury in corrections of tetralogy of Fallot[J].Ann Thorac Surg,2004,77(3):918-924.
[5]Gabriel EA,Fagionato Locali R,Katsumi Matsuoka P,et al.Lung perfusion during cardiac surgery with cardiopulmonary bypass:is it necessary[J]?Interact Cardiovasc Thorac Surg,2008 Dec,7(6):1089-1095.
[6]张仁腾,汪曾炜,王辉山,等.体外循环中有效的肺动脉灌注方式[J].中华胸心血管外科杂志,2010,26(6):409-412.[7]张仁腾,汪曾炜,王辉山,等.体外循环肺损伤动物模型的建立[J].中国体外循环杂志,2011,9(2):105-107.
[8]Halldorsson AO,Kronon MT,Allen BS,et al.Lowering reperfusion pressure reduces the injury after pulmonary ischemia[J].Ann Thorac Surg,2000,69(1):198-204.
[9]Strüber M,Hohlteld JM,Fraund S,et al.Low-potassium dextran solution ameliorates reperfusion injury of the lung and protects surfactant function[J].J Thorac Cardiovasc Surg,2000,120(3):566-572.
[10]Liu Y,Wang Q,Zhu X,et al.Pulmonary artery perfusion with protective solution reduces lung injury after cardiopulmonary bypass[J].Ann Thorac Surg,2000,69(5):1402-1407.
[11]Boyle EM Jr,Pohlman TH,Johnson MC,et al.Endothelial cell injury in cardiovascular surgery:the systemic inflammatory response[J].Ann Thorac Surg,1997,63(1):277-284.
[12]Verrier ED,Morgan EN.Endothelial response to cardiopulmonary bypass surgery[J].Ann Thorac Surg,1998,66(5 Suppl):S17-19.
[13]Gimbrone MA Jr,Topper JN,Nagel T,et al.Endothelial dysfunction,hemodynamic forces,and atherogenesis[J].Ann N Y Acad Sci,2000,902:230-239.
[14]Davis ME,Cai H,Drummond GR,et al.Shear stress regulates endothelial nitric oxide synthase expression through c-Src by divergent signaling pathways[J].Circ Res,2001,89(11):1073-1080.
[15]Reinhart WH.Shear-dependence of endothelial functions[J].Experientia,1994,50(2):87-93.
Effects of different pulmonary artery perfusion pressures on cardiopulmonary bypass-induced pulmonary function injury
Zhang Ren-teng,Wang Zeng-wei,Wang Hui-shan,Jiang Hui,Song Heng-chang,Li Ning
Department of cardiovascular surgery,General hospital of shenyang military command,Shenyang,110016,China
ObjectiveReducing lung injury during cardiopulmonary bypass(CPB)is important for patients'recovery.On the basis of prevenient experiments,the present study was designed to evaluate the effects of pulmonary artery perfusion pressure on the extent of lung function injury during CPB in an animal model.MethodsTwenty healthy mongrel dogs were randomly divided into four groups(5 for each group),including a control group and three perfusion groups designed to simulate clinical cardiopulmonary bypassinduced lung injury.During pulmonary ischemia and CPB,protective perfusions were performed using different perfusion pressures(15 -20,25-30,and 40-45 mm Hg),while animals in the control group were not perfused.After pulmonary reperfusion,the changes in pulmonary function were determined.ResultsCompared with the control group,lung compliance,oxygenation and vascular resistance after reperfusion were significantly improved in both low-and moderate-pressure groups,and in the low-pressure group the improvement was more significant.However,there were no significant differences in any of these parameters between the control group and the high-pressure group.ConclusionThe perfusion pressure is an important factor that determines the extent of lung protection,and the use of pressures below 30 mm Hg is optimal,with the safest and most effective range being 15-20 mm Hg.When the pressure is further elevated to 40-45 mmHg,there is no obvious benefit found compared to the control group.The volume load of perfusate and mechanical stress forces exerted on the lung due to different perfusion pressures may be the important mechanism influencing the protection effect.
Cardiopulmonary bypass;Lung injury;Pulmonary function;Pulmonary artery perfusion;Perfusion pressure
R654.1
A
1672-1403(2013)01-0037-04
2012-06-15)
2012-09-03)
110016沈阳,沈阳军区总医院心血管外科
