凝胶剂种类对凝胶油物性及结晶形态的影响
2013-04-04朱小勇李进伟刘元法
朱小勇 孟 宗 李进伟 蒋 将 刘元法
(江南大学食品学院,无锡 214122)
随着食品专用油脂消费向着多品种、多档次、复合型方向发展,为满足食品工业中低反式脂肪酸和低饱和脂肪酸的健康需求,液态油脂的有机凝胶固态化构造成为近年来研究的热点之一[1-2]。目前国内市场上在售的涂抹脂产品的反式脂肪酸质量分数在10%左右[3]。本试验通过添加米糠蜡、巴西棕榈蜡、蜂蜡以及谷维素和谷甾醇混合物等食品级的大分子物质到低芥酸菜籽油中,通过一定的加工条件可以使其形成类似凝胶状的塑性油脂,依据形成机理的不同,可以划分为两种模式:结晶模式和分子自组装模式[4]。米糠蜡、巴西棕榈蜡、蜂蜡组凝胶油属于结晶模式凝胶油,谷维素和谷甾醇混合物组凝胶油属于分子自组装模式凝胶油。相比于其他固态油脂,凝胶油综合了低芥酸菜籽油低饱和脂肪酸的同时,还具有低反式脂肪酸、半固态油脂黏弹性等众多突出优点[5]。此类凝胶化油脂可以广泛应用到食品、药品、化妆品、化工等行业[4,6-7]。
1 材料与方法
1.1 材料
1.1.1 原料与试剂
精炼低芥酸菜籽油:上海益海嘉里公司;米糠蜡、蜂蜡、巴西棕榈蜡、谷维素、谷甾醇:均为食品级,市售。
1.1.2 仪器
RT10型多点磁力搅拌仪:德国IKA公司;GC-14B型气相色谱仪:日本岛津公司;MQC-23脉冲式核磁共振仪:英国Oxford公司;Pyris 1型差式量热扫描仪:美国PerkinElmer公司;Physica MCR301型流变仪:奥地利安东帕公司;TA.XTPlus型质构仪:英国SMS公司;马尔文纳米粒度及ZETA电位仪:英国马尔文公司;Bruker D8-Advance粉末X-射线衍射仪:德国Bruker公司;配置LINKAM T95-PE型冷热台的E600型偏振光显微镜:日本尼康公司。
1.2 试验方法
1.2.1 样品制备
分别称取:a 2.50 g(精确到0.01 g,下同)蜂蜡,b 1.50 g谷维素和1.00 g谷甾醇混合,c 2.50 g米糠蜡和d 2.50 g巴西棕榈蜡蜡,各自放入50 mL烧杯中,分别添加25.00 g精炼低芥酸菜籽油,在80℃下,以480 r/min的速率搅拌样品0.5 h,然后转入5℃的冰箱中保存24 h,分别制得样品a~样品d;对蜂蜡组再使用 e 720 r/min、f 960 r/min的搅拌速率,其他条件一致,得到样品e、样品f。
1.2.2 脂肪酸组成
脂肪酸组成的测定采用气相色谱法,样品采用三氟化硼甲酯化方法处理。色谱条件:CP-Si188毛细管柱,100 m×0.25 mm×0.2μm;程序升温,FID检测器,检测器温度250℃;进样温度250℃;载气N2,压力 200 kPa;H2压力 60 kPa;空气压力 50 kPa。根据标样保留时间定性,面积归一化法定量。
1.2.3 固体脂肪含量(SFC)
将样品放入低场脉冲式核磁共振仪专用玻璃管,在100℃下熔化15 min以消除结晶记忆,转移至恒温器中于0℃下保留90 min后测其SFC,然后再升温至 5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80℃,各保留30 min,测得各个温度下的SFC。
1.2.4 流变性
使用physica MCR301型流变仪测定剪切速率对凝胶油黏度和屈服应力的影响,剪切速率0~400 s-1。不同凝胶剂种类凝胶油流变性测试:分别取适量样品a~样品d,于10℃下测定其流变性;不同温度下凝胶油流变性的测定:取适量d组凝胶油样品,分别在10、20、30、40、50℃温度下测定其流变性。
1.2.5 硬度
取适量样品a~样品d于50 mL小烧杯中,保持体系的均匀性及测试表面的平整度,于20℃温度下放置48 h之后进行测定。质构仪硬度测定条件:探针 P5,测前速度2 mm/s,测试中的速度1 mm/s,测后速度2 mm/s,下压深度10 mm。各组样品均在20℃下测定3次,取平均值。
1.2.6 粒径
样品平均粒径测定条件:分别取适量样品a~样品f,按1∶25 000的体积比溶解于异丁醇中,超声处理30 min使样品颗粒完全分散至异丁醇中,在25℃下取适量样品于仪器专用的G6比色皿中,转入马尔文纳米粒度及ZETA电位仪中测定平均粒径,每组平行测定2次,使用仪器自带的Zatasizes软件处理结果得到各样品的分散系数。
1.2.7 晶型分析
晶型分析采用X-射线衍射法,取适量样品a~样品d平铺于检测片上的圆孔内,于25℃下用D8Advance型X-射线衍射仪器测定。条件为Cu靶,工作电压40 kV,电流40 mA,发射及防反射狭缝为1.0 mm、接受狭缝0.1 mm,室温25℃条件下,扫描范围2θ从3.0°到40°,扫描速率4°/min。使用JADE5.0软件对扫描谱图进行分析。
1.2.8 结晶形态
用点样毛细管取适量样品a~样品d于载玻片上,盖上盖玻片,使用木塞压平至样品均一。采用连接LINKAM T95-PE型冷热台的尼康E600型偏振光显微镜于20℃下观察样品的微观晶体形态。
2 结果与讨论
2.1 基料油及凝胶油的脂肪酸组成
基料油及4种凝胶剂下凝胶油的脂肪酸组成如表1所示。

表1 基料油及凝胶油脂肪酸组成/%
由表1可见,4种凝胶油和精炼低芥酸菜籽油的脂肪酸组成相差不大,均为油酸(C18∶1)含量最高,其次是亚油酸(C18∶2)。基料油及4种凝胶油脂肪酸种类相似,只是各脂肪酸的含量略有差异,饱和脂肪酸的质量分数低于8%,反式脂肪酸的低于0.4%,芥酸(C22∶1)的低于0.5%。凝胶油的脂肪酸组成满足制备低反式低饱和脂肪酸食品专用油脂的要求。
2.2 凝胶油的熔化特性
SFC曲线能反应产品固体脂肪含量随温度变化的情况,是评价食品专用油产品功能特性的重要指标之一,DSC曲线能评价样品的熔化结晶特性。为此对不同种类的凝胶油的SFC及DSC曲线进行了测定,结果见图1。
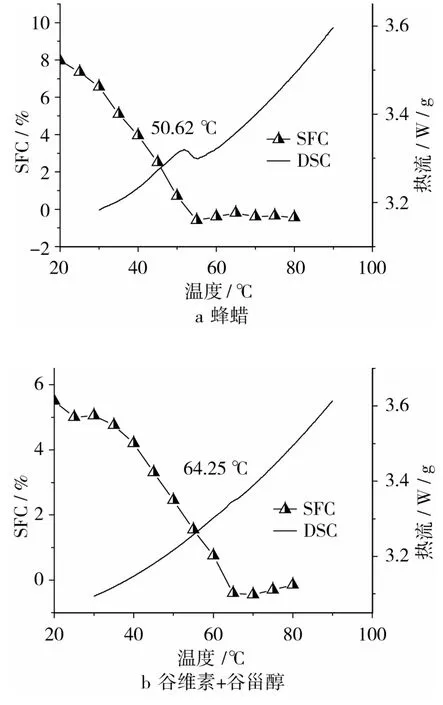

图1 不同凝胶剂制备的凝胶油的SFC及DSC曲线
由图1可以看出,蜂蜡凝胶油的熔点较低且熔程较宽,4种凝胶油的平衡固体脂肪含量都较低,这都可以赋予食品良好的口感。从DSC曲线可以看出,熔化曲线熔化峰温 Tp值分别为50.62、64.25、65.53、74.80℃,与SFC熔融曲线一致。a样品在较低温度下全部很快熔融,b、c、d熔化温度较高,各类凝胶油的熔化温度可以通过降低凝胶剂浓度来降低(数据另文指出),Sawalha等[8]关于谷维素和谷甾醇混合物凝胶油温度和浓度对自组装凝胶油微观结构的研究也证实了这一点。
2.3 硬度和粒径
图2为不同的凝胶剂种类下凝胶油的硬度及平均粒径测定结果。可以看出,不同凝胶剂制备的凝胶油硬度相差较大,谷维素和谷甾醇混合物(3∶2)凝胶油硬度远远大于米糠蜡、棕榈蜡、蜂蜡等结晶模式凝胶油的硬度。比较米糠蜡、棕榈蜡、蜂蜡基凝胶油,其中蜂蜡结晶模式凝胶油硬度最大,这可能与凝胶油微观结构及其分子间作用力有关。而平均粒径结果显示,结晶模式凝胶油(米糠蜡、巴西棕榈蜡、蜂蜡组凝胶油)平均粒径和硬度变化趋势一致,均远大于分子自组装模式凝胶油(谷维素和谷甾醇混合组凝胶油)平均粒径,这可能同凝胶油结晶机理及凝胶油的微观结构有关。
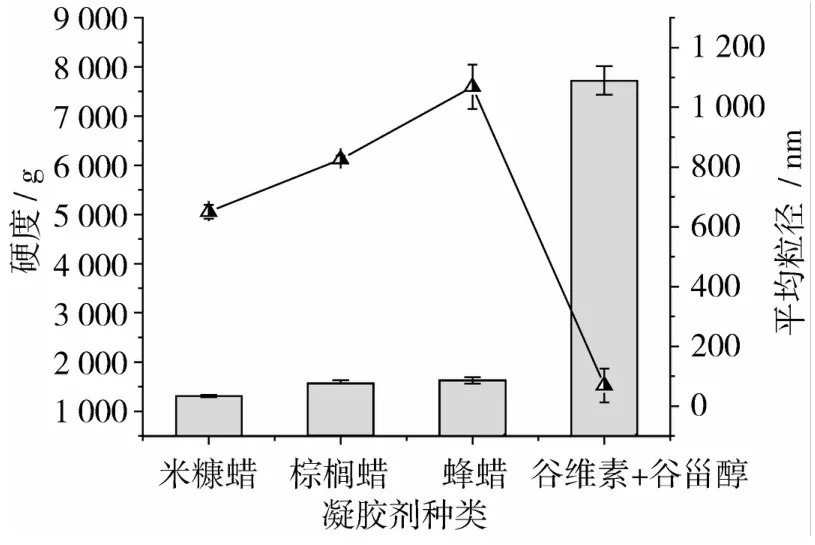
图2 不同凝胶剂下凝胶油硬度(柱状)及平均粒径(散点)
选择各项性质较佳的添加10%蜂蜡为凝胶剂的a、e、f组样品结晶模式凝胶油进行粒径分析,结果如图3所示,随着加工过程中搅拌速率的增大,a、e、f样品的平均粒径有减小的趋势,对粒径结果采用仪器自带的Zatasizes软件处理得到3种加工条件下a、e、f样品在异丁醇中的分散系数分别为 0.766、0.706、0.773,分散情况一致。出现这种情况可能是在制备过程中高温下搅拌时搅拌速率的增大使得蜂蜡分子的布朗运动增强,在油相中分布的越均一,由于成核过程通常在10 s之内完成,而在其后的快速冷却过程中,所形成的大量晶核也很快稳定下来,晶核分布较为密集,体系黏度较大,抑制了晶体生长。
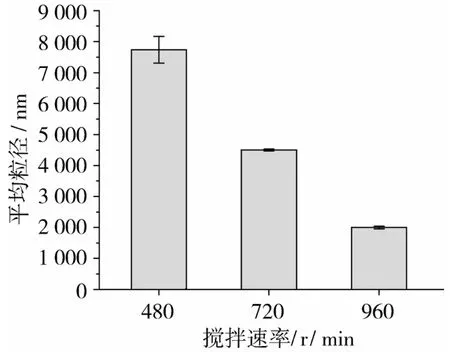
图3 不同搅拌速率下蜂蜡凝胶油平均粒径比较
2.4 流变性质
2.4.1 凝胶剂种类对黏度的影响
2种模式凝胶油的结构不同,体系表现的流变性质也不同,其影响产品的的物理化学性能,自组装模式能显著的影响产品的黏稠度[9-10]。本试验通过测定不同种类凝胶剂下凝胶油的表观黏度,得到图4凝胶油的流变曲线。
从图4可以看出,凝胶油的黏度随着剪切速率的增加逐渐降低,表现出剪切变稀的假塑性。一般假塑性体表观黏度与剪切速率的关系符合幂律方程[11]。其方程为:

式中:η、γ、K、n分别为表观黏度、剪切速率、稠度系数和幂律指数。幂律方程中稠度系数K是与流动指数是与液体性质有关的经验常数。K是液体黏稠度的量度,K越大,液体越黏稠。n值是假塑性程度的量度,n值小于1,为剪切变稀的假塑性流体,n值偏离1越大,则意味着剪切越易变稀,即假塑性程度越大。
考虑到拟合方便性和观察直观性,对式(1)两边取以2为底的对数,得到式(2):

选择式(2)通过Origin 8软件对不同种类凝胶剂下凝胶油表观黏度-剪切速率曲线0~100 s-1范围内的试验数据进行拟合得到图5。图5中拟合的曲线(直线)与试验数据(散点)较为吻合。通过计算直线斜率n-1,截距log2K,即可得出稠度系数K和幂律指数n。拟合得到凝胶油黏度的稠度系数和幂律指数数据见表2,拟合函数的相关系数平方值(R2)在0.987~0.997之间,说明表观黏度和剪切速率试验数据的关系符合幂律方程关系式。
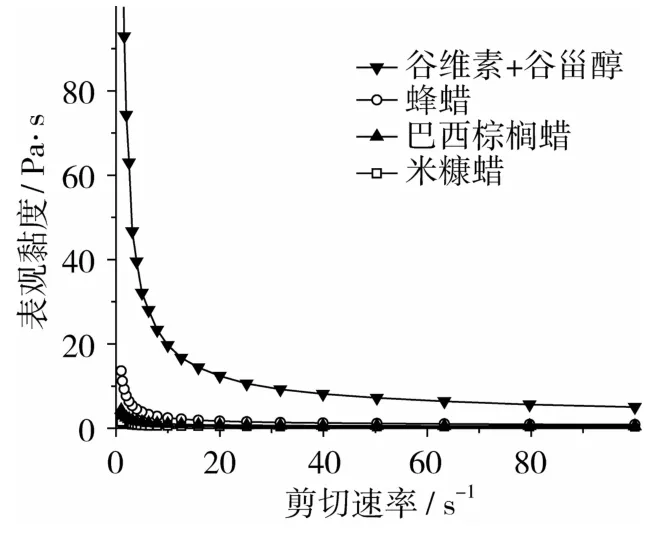
图4 不同凝胶剂下凝胶油表观黏度-剪切速率曲线
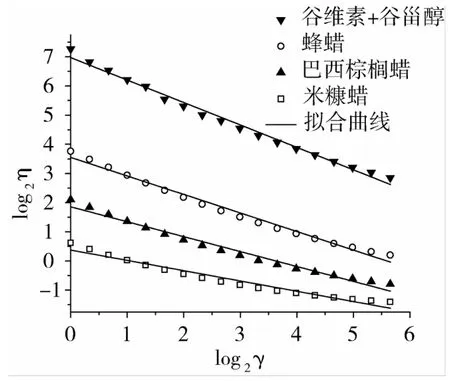
图5 不同凝胶剂下凝胶油的log2η与log2γ关系图
由图4和图5可以看出,随着剪切速率的升高,各类凝胶油的黏度值均表现为减小,属于非牛顿流体中的假塑性流体,即剪切变稀型流体。有别于黏度为常数的牛顿流体,非牛顿流体的黏度被称为表观黏度,它是剪切速率的函数。流体在剪切速率变化时表现出不同黏度变化规律可以反映其自身结构。当剪切速率增大时,蜡质颗粒的解聚及沿流动方向定向排列以及谷维素和谷甾醇等大分子构型的伸长可能是造成凝胶油剪切变稀的原因。
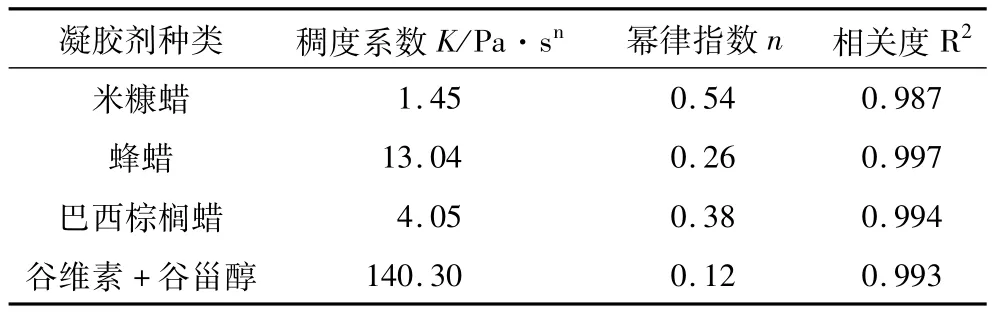
表2 添加10%不同种类凝胶剂下凝胶油表观黏度的稠度系数和幂律指数
2.4.2 温度对凝胶油黏度的影响
温度对凝胶油的黏度影响很大。从图6可以看出,随着温度的升高,蜂蜡凝胶油的黏度逐渐降低,当温度超过40℃以上时,凝胶油流变性由曲线变为接近一条直线,假塑性流体倾向变小,牛顿性流体倾向变大。当温度升高,蜂蜡和低芥酸菜籽油分子的布朗运动加剧,分子流动阻力降低,因而黏度下降,当温度超过40℃时,分子之间的布朗运动变得非常快,足以摆脱自结胶束之间的作用力形成无序胶束,因此凝胶油表观黏度-剪切速率关系由曲线变为近似一条直线。
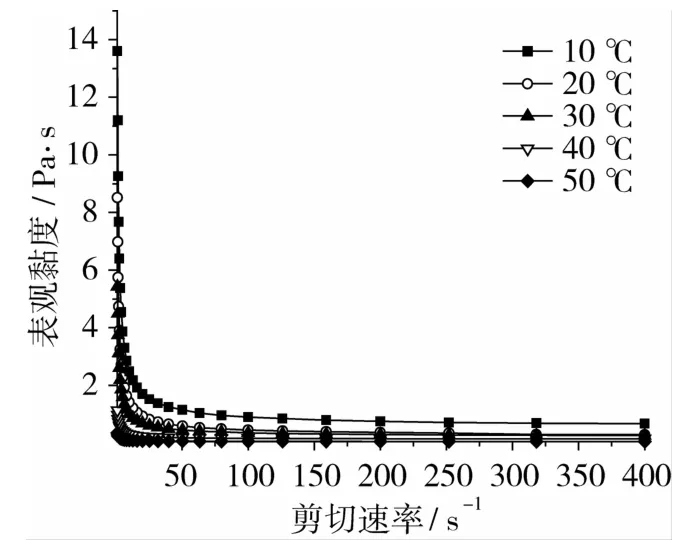
图6 不同温度下凝胶油表观黏度-剪切速率曲线

图7 不同温度下蜂蜡凝胶油的log2η与log2γ关系图
同理,采用式(2)对图6中0~100 s-1范围内的试验数据进行拟合可以得到线性相关性较好的拟合曲线,如图7所示。拟合得到凝胶油表观黏度的稠度系数和幂律指数数据见表3。n值在0.22~0.45之间,说明其属于非牛顿流体中的典型的假塑性流体。
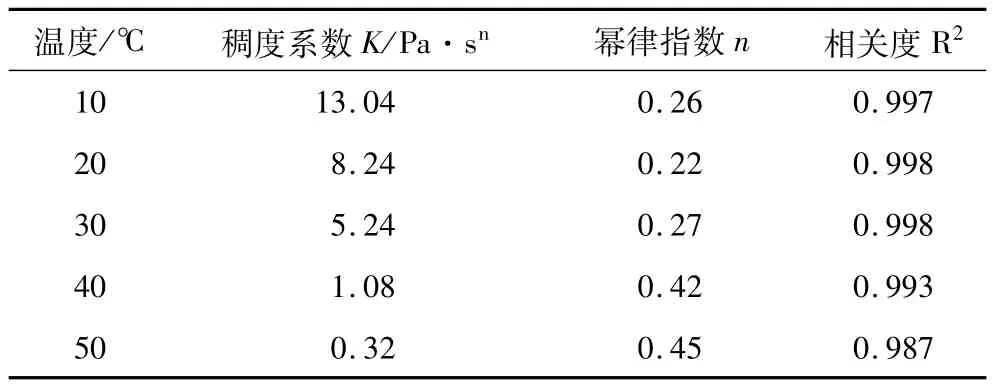
表3 不同温度下蜂蜡凝胶油表观黏度的稠度系数和幂律指数
2.5 晶型测定
分别在25℃下对a、b、c和d组样品进行X-衍射分析,结果如图8所示。


图8 不同种类凝胶剂下凝胶油的XRD图
X-射线衍射分析被广泛应用于研究脂肪的同质多晶现象,短间距在0.42 nm为α型晶体的特征峰,0.38 nm和0.42 nm附近强衍射峰为β′型晶体的特征峰,0.46 nm附近强衍射峰为 β型晶体特征峰[12]。从图 8中可以看出,a、c、d 3种凝胶油中均含有α、β、β′晶型3种晶体,而b组凝胶油主要以β型晶体为主,试验结果与Dassanayake等[13]关于蜡质结晶模式凝胶油的结果基本一致。这与产品的结晶形成机理相关,结晶形成机理的不同导致样品晶型存在较大差异。对于含不同晶型的凝胶油,可以满足制备不同食品专用油脂的需求。
2.6 凝胶油晶体微观形态
脂肪所形成的晶体网络的微观结构对终产品的性质有着至关重要的影响。晶体微观结构包括晶体的空间分布、粒子尺寸、粒子形状和粒子间的交互作用力,可采用偏振光显微镜进行观察,应用盒维数法对晶体网络微观结构定量分析。
添加不同种类的凝胶剂下制备的样品a~样品d在20℃下的结晶形态如图9所示。可以看出,添加不同种类的凝胶剂所形成的凝胶油微观结构有很大的差别,其中添加蜂蜡的样品a所形成的结构最为细小散乱,呈细小的针状结构,较之添加米糠蜡的样品c和巴西棕榈蜡的样品d结构差别比较清晰,可能凝胶油的这种结构是造成其在结晶模式样品中具有较大硬度的一个重要因素。添加米糠蜡和巴西棕榈蜡的体系中出现大量的絮状结晶。而添加谷维素和谷甾醇混合物得到的分子自组装模式凝胶油b的结晶形态与其余3种结晶模式凝胶油的结晶形态有很大区别,呈片状结晶,结晶碎片堆积形成大颗粒。另外,可以看出,4种不同凝胶剂所形成的凝胶油体系微观晶体结构尺寸也有区别。在分布上,c、d组结晶模式凝胶油表现得更为规则。

图9 凝胶剂种类对凝胶油微观晶体形态的影响
对其三维结晶网络应用盒维数法定量分析所得的不规则碎片维数Db值如表4所示。

表4 凝胶剂种类对凝胶油晶体不规则碎片维数Db的影响
微观结构各因素中对Db有显著影响的主要有晶体的尺寸大小、微观形态以及结晶面积等,通常Db值越高就意味着网络被填充的越多,c样品Db值最大,b、d样的Db值相差不大,都大于a样品,这和偏振光显微镜直观观察结果相符。Tang等[14]研究结果表明,SFC值较高时结晶面积的增大会引起Db值的增大,而细小晶体的数目增大对Db值的影响较小;在低SFC值时,晶体尺寸及结晶面积的增大会引起Db值的增大,而与晶体数目无关。可以看出,凝胶剂种类对Db值影响较大。
3 结论
制备得到的凝胶油样品反式脂肪酸含量低于0.4%,饱和脂肪酸含量低于8%。SFC曲线显示蜂蜡为凝胶剂时得到的产品具有较宽熔程,与DSC曲线显示低熔点相符。结晶模式凝胶油的硬度和平均粒径均以蜂蜡组最大,巴西棕榈蜡居中,米糠蜡组最低,而自组装模式凝胶油硬度远大于结晶模式凝胶油,粒径却远小于结晶模式凝胶油;随搅拌速率的增大,凝胶油平均粒径减小。添加蜂蜡的结晶模式凝胶油随着温度升高,假塑性和黏稠度都变低;凝胶剂种类对凝胶油晶体微观形态有较大影响;X衍射分析表明结晶模式凝胶油中均含有α、β、β′3种类型晶体,而自组装模式凝胶油中仅存在β型晶体,且其形成的微观晶体网络结构也存在较大差异。
参考文献
[1]王德志,马传国,王高林.专用油脂在食品工业中的应用[J].中国油脂,2008,33(4):7-11
[2]Marangoni A G.Organogels:an alternative edible oil-structuring method[J].Journal of the American Oil Chemists'Society,2012,89(5):749-780
[3]徐子剑.零反式脂肪酸涂抹脂的制备与评价[D].无锡:江南大学,2012
[4]Dassanayake L SK,Kodali D R,Ueno S.Formation of oleogels based on edible lipid materials[J].Current Opinion in Colloid&Interface Science,2011,16(5):432-439
[5]Hughes N E,Marangoni A G,Wright A J,et al.Potential food applications of edible oil organogels[J].Trends in Food Science&Technology,2009,20(10):470-480
[6]Bot A,Agterof W G M.Structuring of edible oils by mixtures ofγ-oryzanol withβ-sitosterol or related phytosterols[J].Journal of the American Oil Chemists'Society,2006,83(6):513-521
[7]Zhao X Y,Cao Q,Zheng L Q,et al.Rheological properties and microstructures of gelatin-containing microemulsionbased organogels[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2006,281(1):67-73
[8]Sawalha H,Venema P,Bot A,et al.The influence of concentration and temperature on the formation ofγ-oryzanol+βsitosterol tubules in edible oil organogels[J].Food biophysics,2011,6(1):20-25
[9]Hawker N.Liposomes for food industry[J].Food Technol Eur,1994,1(5):44-46
[10]Vauthey S,Milo C,Frossard P,et al.Structured fluids as microreactors for flavor formation by the Maillard reaction[J].Journal of Agricultural and Food Chemistry,2000,48(10):4808-4816
[11]侯万国,孙德军,张春光.应用胶体化学[M].北京:科学出版社,1998:51
[12]Chopin-Doroteo M,Morales-Rueda J A,Dibildox-Alvarado E,et al.The effect of shearing in the thermo-mechanical properties of candelilla wax and candelilla waxtripalmitin organogels[J].Food Biophysics,2011,6(3):359-376
[13]Dassanayake L S K,Kodali D R,Ueno S,et al.Physical properties of rice bran wax in bulk and organogels[J].Journal of the American Oil Chemists'Society,2009,86(12):1163-1173
[14]Tang D,Marangoni A G.Computer simulation of fractal dimensions of fat crystal networks[J].Journal of the American Oil Chemists'Society,2006,83(4):309-314.
