钨酸钠处理对枳幼苗生长及植株硝态氮含量的影响
2013-04-03孙敏红谢深喜卢晓鹏
孙敏红 ,谢深喜 ,卢晓鹏 ,李 静
(1.中南林业科技大学 林学院,湖南 长沙 410004;2.湖南农业大学 园艺园林学院,湖南 长沙 410128)
枳Poncirus trifoliate(L).Raf是我国大部分柑橘产区常用的砧木类型,具有耐寒、耐旱、耐瘠,抗流胶病、裙腐病、线虫病等优点,嫁接植株也具有矮化、早期丰产、果实品质优良等特性。柑橘生产中经常发生氮肥过量但吸收利用较少的现象。硝态氮是进入植物体的主要氮素形态之一,植株中硝态氮累积是旱作植物的共性[1]。除作为营养物质外,硝态氮还可以作为植物体各种代谢过程的信号物质及渗透调节物质。根据作物体内的硝态氮含量,调控氮肥用量以控制作物生长发育,可保证作物高产,且降低作物体内过量累积硝态氮,避免养分资源的浪费。
硝酸还原酶(NR)是硝酸盐还原过程的关键酶和限速酶,其活性反映出植物对硝态氮的还原及转化能力,并与植物吸收和积累硝态氮的能力密切相关[2]。该酶是一种水溶性钼黄蛋白,为同聚多亚基蛋白,每个亚基含有3个辅基:黄素腺嘌呤二核苷酸(FAD)、细胞色素(Cytc)以及钼辅因子(MoCo),每个辅基就是一个氧化还原中心[3]。钼原子(Mo)作为酶的重要组成部分,参与硝态氮还原为铵的过程[4]。而钨酸钠(Na2WO4)中的钨原子(W)性质与钼原子相似,可以直接取代硝酸还原酶复合体中的钼,从而起到抑制酶活性的作用[5]。
为提高柑橘植株氮利用效率,笔者以柑橘主要砧木类型枳为材料,研究不同浓度钨酸钠溶液处理后枳幼苗生物量及硝态氮含量的变化,筛选最佳的处理浓度及处理时间,旨在为柑橘生产中氮肥过量后的缓解探索可行方法,为柑橘生产中氮肥施用提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为1年生枳实生幼苗,采用沙培方法培养,取1年生长势基本一致的枳幼苗,种于沙子与珍珠岩1∶1混合的基质中。移栽初期用水浇灌,使其适应,1个月后进行处理。整个培养过程在湖南农业大学柑橘中心温室里进行。
1.2 测定项目与方法
1.2.1 试验处理
以Hoagland营养液为基本配方,处理溶液分别为0.5,1.0,1.5,2.0 mmol/L钨酸钠溶液。对照采用Hoagland营养液浇灌,2天1次。不同处理用钨酸钠溶液与Hoagland营养液轮流浇灌。处理后,每隔7 d取样1次,共取样6次,用于生长量及硝态氮含量的测定。
1.2.2 样品干质量的测定
每次取样后,分别称量幼苗根、茎、叶的质量。并放于80 ℃下烘箱中烘干72 h,取出后再次称其质量,即为干质量,以“g”为单位。每个处理3次重复,每次重复取3株幼苗。
1.2.3 硝态氮含量的测定
将烘干样品打碎成粉末状,用于测定硝态氮含量。测定方法为:取干样0.5 g,经过硫酸-过氧化氢消煮后得到透明消煮液[6-8]。取5 mL消煮液于50 mL比色管中,无氨水稀释并定容,摇匀后在波长210 nm处用紫外分光光度计进行硝态氮含量的测定。以无氨水为参比,测其吸光度,然后根据标准曲线计算其硝态氮含量。

其中,Fm为NO-3-N的质量分数;C为样品液NO-3质量浓度;N为稀释倍数;m为样品干质量。
1.2.4 硝态氮标准曲线的制作
分别吸取含硝态氮的标准液[9]0,1,2,3,4,5,6 mL于50 mL比色管中,各加1 mL空白消煮液,用水稀释至50 mL,摇匀,测定OD210后绘制标准曲线。其线性关系较好,回归方程为:y=0.618x+0.035,相关系数R2=0.997(n=7)。
1.2.5 数据分析
利用SPSS13.0统计软件进行方差分析。采用LSD法对不同处理结果进行显著性比较。
2 结果与分析
2.1 不同钨酸钠处理对枳幼苗生长量的影响
不同钨酸钠溶液处理对枳幼苗根茎叶生长量的影响见表1。由表1可知,不同浓度钨酸钠处理对枳幼苗根、茎、叶干质量变化有一定影响,处理42 d后,所有处理中各部位的干质量均显著低于对照,其中处理2(1.0 mmol/L钨酸钠溶液)中不同部位的干质量均显著高于其它处理,但仍低于对照。
各处理间叶片干质量均有显著差异,各处理按照叶片干质量由高到低排序依次为对照、处理2、处理3、处理1、处理4。对照的茎干质量显著高于其它处理,处理2显著高于处理1、3和4;处理1和处理3之间无显著差异但均显著高于处理4。不同处理间根系干质量差异显著,各处理按照根系干质量由高到低排序依次为对照、处理2、处理3、处理1、处理4,这与叶片干质量变化表现一致。
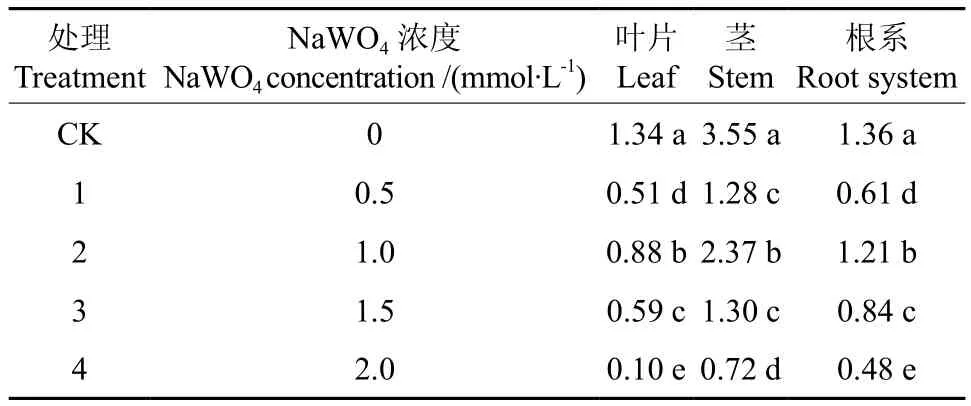
表1 不同钨酸钠处理对枳不同部位干质量的影响†Table 1 Effect of different NaWO4 treatments on dry mass of different organs in Poncirus trifoliate seedlings g
2.1.1 不同钨酸钠处理对枳幼苗叶片干质量变化的影响
叶片是光合作用器官,是果实产量形成的重要因素,故可通过叶片干质量含量的变化筛选出钨酸钠处理的最佳浓度和处理时间。
不同浓度钨酸钠溶液处理对枳叶片干质量的影响动态见图1。由图1可以看出,对照叶片干质量是随着时间增加而逐步增加,而各处理中叶片干质量均表现为先升高后降低的趋势。处理1随着时间增加表现出叶片干质量先增加后减少,处理28 d后植株有新叶抽生,且生物量增加到最大(1.03 g),但仍显著低于处理2和对照,随后生物量开始减少;处理2培养28 d后,生物量达到最大(1.72 g),且显著高于其它处理及对照,试验中观察植株有新叶抽生,并有分枝;处理3培养21 d后,叶片干质量达到最大(0.81 g),低于其它处理而显著高于处理4的叶片干质量,随后叶片干质量逐渐减少,并表现出植株矮小,叶片黄化、稀少等症状;处理4培养28 d时,叶片生物量达到最大(0.67 g),但显著低于其它处理及对照,之后叶片干质量逐渐降低,生长表现为植株细小,42 d时植株下部叶片已完全脱落,叶片平均干质量仅为0.1 g,这可能与氮素含量减少有关。由叶片的干物质含量可看出最适的钨酸钠处理浓度为1.0 mmol/L,处理时间为28 d,随着处理时间延长,叶片干质量会下降。
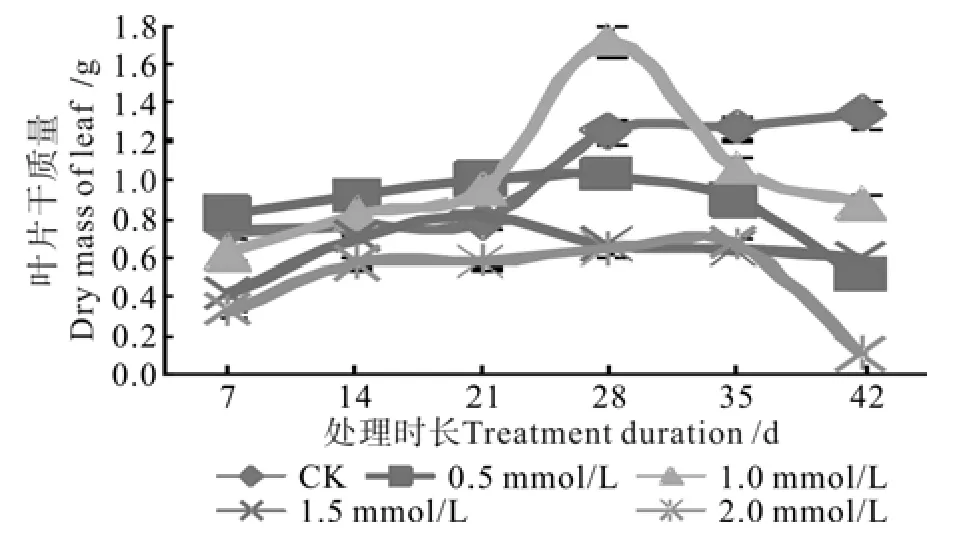
图1 钨酸钠处理对枳叶片干质量的动态影响Fig.1 Dynamic effect of NaWO4 treatments on dry mass of Poncirus trifoliate leaf
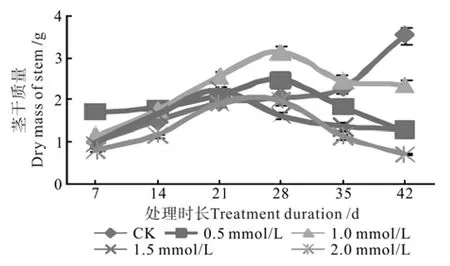
图2 钨酸钠处理对枳茎干质量的动态影响Fig.2 Dynamic effect of NaWO4 treatments on dry mass of Poncirus trifoliate stem
2.1.2 不同钨酸钠处理对枳幼苗茎干质量变化的影响
茎干的干质量可反映出植物的大小及健壮程度,不同浓度钨酸钠溶液处理对枳幼苗茎干质量的影响动态见图2。
由图2可知,对照枳幼苗茎的干质量逐步增加,而钨酸钠处理表现为先增加后降低的趋势。其中,对照随着时间延长,茎干质量急剧增加,42 d时已由最初的1.02 g增加至3.55 g;处理1中培养28 d后茎干质量增加至最大(2.48 g),显著低于处理2却高于其它处理,之后茎干质量逐渐降低;处理2培养28 d后茎干质量达到最大(3.16 g),随后逐渐降低,且第2~7次取样所测的茎干质量均显著高于其它处理及对照,植株茎杆较粗;处理3培养21 d后茎干质量达到最大(2.25 g),显著低于处理2但高于其它处理及对照,后逐渐降低;处理4培养28 d后茎干质量达到最大(2.0 g),但仍显著低于其它处理和对照的茎干质量,之后开始大幅度降低,所测植株茎干细长。由此可知,低浓度的钨酸钠溶液对茎干生长有一定的促进作用,而高浓度(2.0 mmol/L)的钨酸钠对植物的茎干生长有抑制作用。由茎干质量的变化可以看出,钨酸钠最佳浓度为1.0 mmol/L,处理时间为28 d时茎干生长健壮,处理时间延长后生长势减弱。
2.1.3 不同钨酸钠处理对枳幼苗根系干质量变化的影响
根系是植物吸收养分的主要器官,只有健壮的根系才可以吸收更多的营养,根系干质量可反映出植株根系的发达程度。不同浓度钨酸钠溶液处理对枳幼苗根干质量的影响动态见图3。
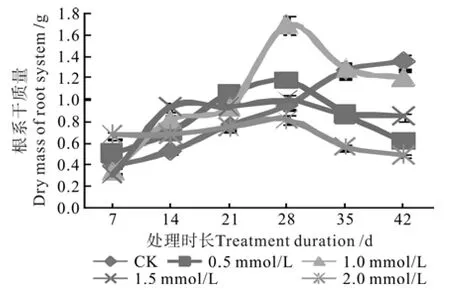
图3 钨酸钠处理对枳根系干质量的动态影响Fig.3 Dynamic effect of NaWO4 treatments on dry mass of Poncirus trifoliate root system
由图3可知,对照处理随着培养时间增加根系干质量逐渐增加,其它处理则表现为先增加后降低的趋势;其中对照处理的根系干质量由第1次取样的0.39 g增加至第6次取样的1.36 g,根系形态表现为根系发达,须根多;处理1栽培28 d时根系干质量达到最大值1.18 g,显著低于处理2却高于其它处理和对照,随后根系干质量缓慢降低;处理2在培养28 d时根系干质量达到最大值1.70 g,显著高于其它处理及对照,之后开始降低;处理3根系干质量由第1次取样时的0.3 g增至第4次取样时的1.0 g,但显著低于处理1和处理2,但高于处理4和对照,随后根系干质量缓慢下降;处理4的根系增重缓慢,且显著低于其它处理及对照,之后根系干质量逐步下降,形态表现为根系稀少,老化。根据不同钨酸钠处理植株根系干质量的变化可知,1.0 mmol/L钨酸钠溶液处理28 d时对枳幼苗根系生长有促进作用,随着处理时间延长根系干质量逐步下降。
通过根、茎、叶干质量的变化趋势可以看出,钨酸钠溶液处理初期对植物生长有一定的促进作用,这可能是因为一定浓度的Na+对植物生长的促进;但随着处理时间延长,植物各个部位干质量表现为下降趋势,可能是过量Na+的毒害或钨酸钠溶液处理引起局部氮素含量变化所导致。
2.2 不同钨酸钠处理对枳幼苗硝态氮含量变化的影响
处理42 d后,不同钨酸钠溶液对枳幼苗根、茎和叶中硝态氮含量的影响见表2。由表2可知,叶片硝态氮含量表现为随着钨酸钠浓度的增加,所有处理的叶片硝态氮含量均显著少于对照,但处理间硝态氮含量差异不显著;幼苗茎部硝态氮含量随着钨酸钠溶液浓度增加而减少,其中处理4的硝态氮含量显著低于其它处理,处理2与处理3无显著差异,处理1与对照的茎干硝态氮含量无显著差异,但显著大于其它处理;不同钨酸钠浓度处理的根系硝态氮含量表现为所有处理均显著高于对照,其中处理4硝态氮含量最高为0.26,其它处理间无显著差异。由此可知,一定浓度的钨酸钠处理可以降低叶片和茎干的硝态氮含量,而根的硝态氮含量有所增加,这与杨荣等在油菜上的研究结果相一致[10]。
2.2.1 不同钨酸钠处理对枳叶片硝态氮含量变化的影响
叶片中大部分氮以硝态氮形式存在,而叶片硝态氮含量直接反映出植物体内硝态氮累积和代谢状况,故硝态氮是植物氮素营养、氮素同化利用与再利用状况的重要指标。不同钨酸钠处理对枳幼苗叶片中硝态氮含量的影响进程见图4。由图4可知,随着处理时间的延长,所有处理的叶片硝态氮含量均有所下降。其中对照的硝态氮含量由第1次取样时的0.38 mg/g降至第6次取样时的0.14 mg/g,显著大于其它处理;钨酸钠溶液处理的植株硝态氮含量随处理时间延长也有所下降,处理42 d后不同处理间硝态氮含量无显著差异,但显著低于对照。由此可以看出,钨酸钠溶液处理对降低叶片硝态氮含量具有显著效果,但不同浓度处理间差异不显著。
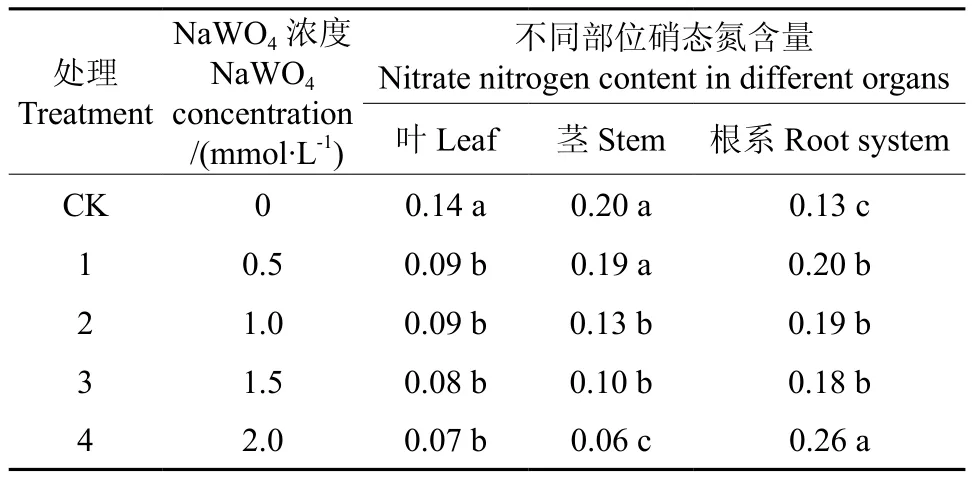
表2 钨酸钠处理对枳不同部位硝态氮含量的影响Table 2 Effect of NaWO4 treatments on nitrate nitrogen content in different organs of Poncirus trifoliate mg·g-1
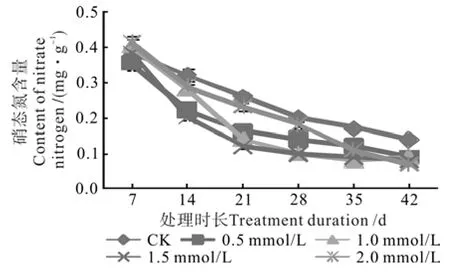
图4 钨酸钠处理对枳叶片硝态氮含量的动态影响Fig.4 Dynamic effect of NaWO4 treatments on nitrate nitrogen content in Poncirus trifoliate leaf
2.2.2 不同钨酸钠处理对枳茎硝态氮含量变化的影响
不同钨酸钠浓度处理对枳幼苗茎的硝态氮含量的影响进程见图5。由图5可知,随着处理时间增加,对照幼苗茎部硝态氮含量逐步下降,由第1次测定时的0.29 mg/g降到处理42 d后的0.2 mg/g;而被处理植株的硝态氮含量均出现先增加后下降的趋势;处理1前4次所测定硝态氮含量变化不明显,处理28 d后硝态氮含量迅速下降;处理2前期硝态氮含量缓慢增加,由最初的0.27 mg/g增加到最大值0.31 mg/g,培养14 d后开始迅速下降;处理3与处理4茎硝态氮含量表现为前期无明显变化,培养21 d后开始迅速下降。处理42 d后,处理2、处理3和处理4的硝态氮含量显著低于处理1和对照。
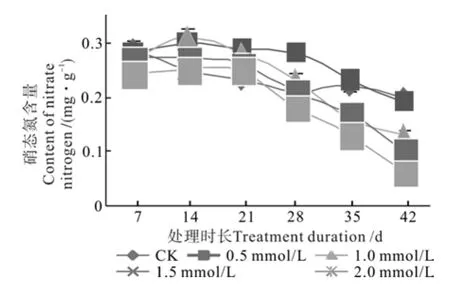
图5 不同钨酸钠处理对枳茎硝态氮含量的动态影响Fig.5 Dynamic effect of NaWO4 treatments on nitrate nitrogen content in Poncirus trifoliate stem
2.2.3 不同钨酸钠处理对枳根系硝态氮含量变化的影响
不同钨酸钠处理对枳根系硝态氮肥含量变化的影响如图6所示。由图6可知,随着培养时间增加,对照根系硝态氮含量逐渐减少,由第1次测定时的0.24 mg/g降至第6次取样时的0.13 mg/g。这说明正常管理的植株根系硝酸还原酶活性较高,可将根系吸收的硝态氮运转至地上部,减少根系硝态氮积累;处理1与处理2、处理3均表现为硝态氮含量先降低后增加,这可能是因为低浓度的钨酸钠溶液短期处理对幼苗根系硝酸还原酶活性影响不大,但处理一定时间后硝态氮含量开始缓慢增加,可以看出这3个处理均在培养14 d后开始抑制硝酸还原酶活性,减少了硝态氮的转运,致使硝态氮积累;而处理4培养初期硝态氮含量无显著变化,后期开始逐步积累,这可能是因为高浓度钨酸钠溶液对硝酸还原酶活性的抑制作用较强,故短期内使得硝态氮无转运,且逐步积累。在培养42 d后,所有处理中表现为随着钨酸钠溶液浓度增加,硝态氮含量也增加,处理4硝态氮含量显著高于其它处理,而处理1硝态氮含量最低,其它处理间无显著差异。
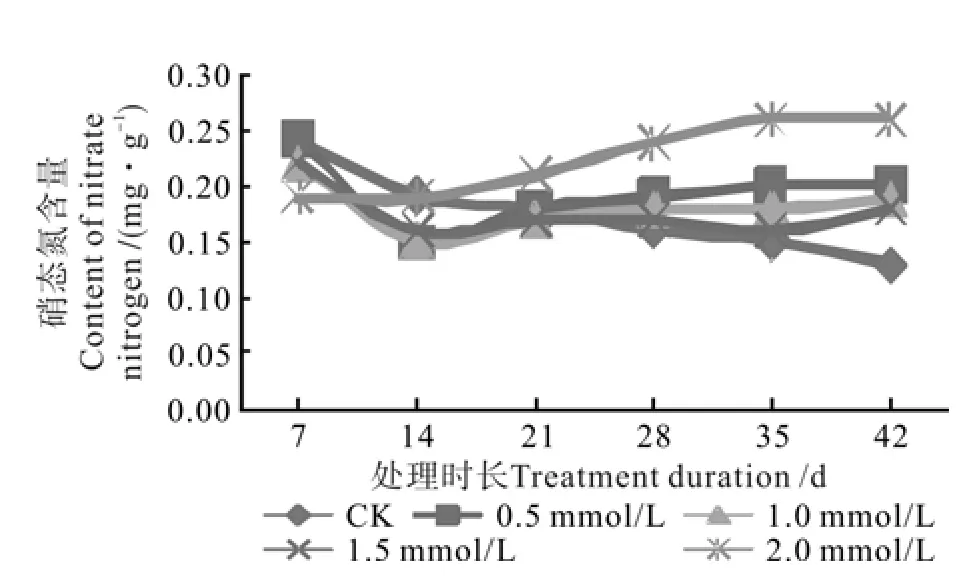
图6 不同钨酸钠处理对枳根系硝态氮含量的动态影响Fig.6 Dynamic effect of NaWO4 treatments on nitrate nitrogen content in Poncirus trifoliate root system
通过枳幼苗根、茎和叶硝态氮含量变化可以看出,钨酸钠处理对茎和叶硝态氮含量有显著降低作用,且浓度越大,硝态氮含量下降越明显,但导致根系硝态氮积累,随着浓度越大,根系硝态氮含量越多,高浓度的钨酸钠溶液虽然可显著降低茎和叶片中硝态氮的含量,但植物生长受到一定影响。结合植物生长状况及各部位干质量变化,确定最佳钨酸钠浓度为1.0 mmol/L,处理时间为28 d。
3 结论与讨论
不同植物的硝酸还原酶活性对钨酸钠的响应不同, 即达到抑制效果所需的浓度不尽相同。水稻根系应用的最佳钨酸钠浓度为0.15 mmol/L[11],小白菜应用的最佳浓度是0.8 mmol/L[12],而油菜应用的最佳浓度是1.0 mmol/L[10]。本研究中枳幼苗各个部位生长状况及干质量变化和不同部位的硝态氮含量变化表明,钨酸钠对枳各个部位硝酸还原酶活性同样有显著的抑制作用,以1.0 mmol/L浓度,处理28 d为宜,此时对植物生长无明显影响且有效降低茎与叶的硝态氮含量,说明枳对于钨酸钠对硝酸还原酶结构的抑制不如水稻、小白菜等草本植物敏感,但当浓度增加到一定程度,处理一定时间后同样可以达到较好的抑制效果。
有研究表明,植物根系内硝酸还原酶活性被抑制后会造成根系硝态氮的大量积累[13-15]。本试验中,一定浓度钨酸钠处理下,根系中有积累的硝态氮,但茎叶中硝态氮含量未增加,说明根系硝酸还原酶活性受抑制后,根系中积累的硝态氮并没有被运输到地上部分。这可能是植物对硝态氮的吸收和向上运输是主动运输过程,需提供能量所致[16];也可能是因为植物根系硝酸还原酶活性被抑制后,硝态氮的还原无法正常进行,则氮代谢下游的氨基酸无法产生,所以阻碍下游信号的传递,使植株无法对氮素进行正常的分配和转移[17]。而根系中硝态氮的过度积累导致根系弱化,吸收能力显著下降,可以有效减少对氮肥的摄入。
外源钨酸钠在一定浓度水平处理下降低植株体内NO3-含量可能是由于NO3-由阴离子通道进入液泡遭受到WO42-的竞争性抑制;而WO42-在一定浓度范围内可替代NO3-向细胞质转移,从而提高作物的氮素同化;而随着外源钨酸钠溶液水平的增加,逐渐构成较强的渗透胁迫,使硝酸盐同化受阻,因而表现根系细胞中硝酸盐含量上升的现象;同时叶片中硝酸盐含量下降,植株生长受到显著抑制。故在柑橘生产中氮肥过量时,可配施含一定浓度钨酸钠的肥料,降低植株体内硝酸盐含量,从而提高氮素利用效率,同时改善作物品质。而这个推测的各个过程及机制还需进一步研究和验证。
参考文献:
[1] Santa M P, Eliaa, S.Fertilization strategies for lowering nitrate contents in leafy vegetable: chicory and rocket salad cases [J].J Plant Nutr, 1998, 21(9):1791-1803.
[2] Crawford N M.Nitrate: nutrient and signal for plant growth [J].Plant Cell, 1995,7 (7): 859-868.
[3] Heidari B, Matre P, Nemie-Feyissa D,et al.Protein phosphatase 2A B55 and a regulatory subunits interact with nitrate reductase and are essential for nitrate reductase activation[J].Plant Physiol,2011,156 (1): 165-172.
[4] Yu M, Hu CX, Sun XC,et al.Influences of Mo on nitrate reductase, glutamine synthetase and nitrogen accumulation and utilization in Mo-ef fi cient and Mo-inef fi cient winter wheat cultivars [J].Agr Sci Chin, 2010,9 (3): 355-361.
[5] Moura J J G, Brondino CD, Trincao J,et al.Mo and W bis-MGD enzymes: nitrate reductases and formate dehydrogenases[J].J Biol Inorg Chem, 2004, 9(7): 791-799.
[6] 吕伟先,葛 莹,吴建之,等.植物中硝态氮、氨态氮、总氮测定方法的比较研究[J].光谱学与光谱分析, 2004, 24(2):204-206.
[7] 刘广平.栗树果实发育过程中氮、磷、钾含量变化的研究[J].经济林研究,2005, 23 (1):50-51.
[8] 于冬梅,盖素芬.核桃主要器官氮素含量及分配的动态变化规律[J].经济林研究, 2006,24(1):49-51.
[9] 吴建之,葛 莹,王晓月,等.过硫酸钾氧化吸光光度法测定植物总氮[J].理化检验:化学分册, 2000,36(4): 166-167.
[10] 杨 荣,邱炜红,王朝辉,等.硝酸还原酶抑制剂钨酸钠对油菜硝态氮积累的影响[J].植物生理学报, 2012,48(1):51-56.
[11] 司江英,汪晓丽,陈 平,等.硝酸还原酶抑制剂和NH4+对不同基因型水稻苗期NO3-吸收的影响[J].扬州大学学报:农业与生命科学版, 2004, 25(1): 59-62.
[12] 梁 亮,陈 洁,苏小俊,等.根系硝酸还原酶对小白菜硝酸盐吸收和代谢的影响[J].江苏农业科学, 2008,(3): 153-155.
[13] Deng M, Moureaux T, Caboche M.Tungstate, a molybdate analog inactivating nitrate reductase, deregulates the expression of the nitrate reductase structural gene[J].Plant Physiol,1989,91(1): 304-309.
[14] 韩文萍,丁贵杰,鲍 斌.不同种源马尾松对干旱胁迫的生理生态响应[J].中南林业科技大学学报,2012,32(5):25-29.
[15] 陈建华,晏存育,王艳梅,等.6种不同变异类型毛竹叶片的生理特性研究[J].中南林业科技大学学报, 2011, 31(4): 70-73.
[16] Hansch R, Fessel DG, Witt C,et al.Tobacco plants that lack expression of functional nitrate reductase in roots show changes in growth rates and metabolite accumulation[J].J Exp Bot,2001,52 (359): 1251-1258.
[17] Krouk G, Crawford NM, Coruzzi GM,et al.Nitrate signaling:adaptation to fl uctuating environments[J].Curr Opin Plant Biol,2010,13(3): 265-272.
