山杏嫩枝扦插生根过程中插穗内源激素含量的变化
2013-04-03董胜君刘明国吴月亮单守田丁瑞军
董胜君,刘明国,戴 菲,吴月亮,单守田,丁瑞军
(1.沈阳农业大学 林学院,辽宁 沈阳 110866;2.阜新市林业科技实验示范园区,辽宁 阜新 123000)
山杏Armeniaca sibirica为我国三北地区重要的生态经济型树种,杏核产量低而不稳的问题成为制约山杏产业发展的主要“瓶颈”[1],从2002年以来,本课题组即开始了山杏良种选育工作,挖掘出数量众多的优良类型,在连续观测和生产中表现良好。为了较大规模的实现良种化,有必要对这些优良类型开展快速繁殖技术方面的研究。在快繁技术中,只有无性繁殖方式才能可靠地保持选育出来的优良无性系母本的优良特性[2]。而在无性繁殖中,嫁接繁殖成本较高,组培繁殖技术较为复杂,不适宜应用于山杏大面积荒山良种造林。扦插繁殖具有保持母本优良特性、缩短育种周期、操作简单、效率高、成本低等优点,扦插繁殖中嫩枝扦插生根率较高[3-4],可作为树种快繁和推广的可靠繁殖方法。但山杏为扦插难生根树种,有关该树种扦插繁殖技术的研究鲜见报道。2012年,董胜君等提出以IBA 900 mg/L+NAA 600 mg/L混合激素处理山杏嫩枝插穗30 s生根效果最好,生根率为83.1%,且不同山杏无性系嫩枝扦插生根效果差异显著[5]。在山杏扦插生根过程中,有哪些内在因素会影响到扦插生根率和生根效果,即关于山杏扦插生根机理方面的研究也鲜见报道。2012年,董胜君等研究了山杏扦插生根过程中营养物质及酶活性的变化,提出植物生长调节剂处理能够引起插穗可溶性总糖、蛋白质、全氮含量及相关酶(POD、PPO、IAAO)活性的变化,从而促进插穗生根[6]。而在关于山杏扦插生根机理中,内源激素对生根的影响未见报道。笔者以山杏嫩枝为试验材料,研究插穗生根过程中内源激素的变化对生根的影响,旨在探讨其扦插生根机理,为该树种的无性繁殖提供理论依据和技术支撑。
1 试验地概况
试验地设于阜新蒙古族自治县的阜新市林业科技实验示范园区,该地区属温带半干旱季风型大陆性气候,年平均温度7.2 ℃,无霜期158 d,平均降水500 mm左右。四季分明,夏短、湿热多雨,冬长、寒冷干旱。土壤类型多为褐土,棕壤次之,其它土壤类型(包括风沙土及轻度盐碱土)也有少量分布。
2 材料与方法
2.1 试验材料
在2011年6月下旬,于试验地选取生长健壮、无病虫害的普通山杏当年生嫩枝作为试验材料,将其制成8~12 cm长、带有2~3片叶的插穗,插穗两端切口平滑,下端呈斜面状。
2.2 试验方法
2.2.1 扦插试验
本试验采用完全随机区组设计,选择2种植物生长调节剂或组合、2种浓度处理插穗,共计4个处理,每处理3次重复,每次重复50个插穗。4个处理分别是IBA(900 mg/L)+NAA(600 mg/L)、IBA(700 mg/L)、NAA(700 mg/L)以及清水,插穗形态学下端2~3 cm处在其中速蘸30 s,清水为对照(CK)。另于扦插当日每个处理多加250个插穗,用于插穗内源激素测定。
2.2.2 内源激素含量的测定
共取样5次,从扦插当日开始,之后每隔10 d取样1次,每次取样随机抽取20~30根插穗,用蒸馏水将插穗清洗干净,在插穗下切口至下切口上端1 cm处取韧皮部,每处理共计10 g,现场采用液氮速冻,之后放于-70 ℃超低温冰箱中保存。采用高效液相色谱法(HPLC)测定4种内源激素ZT、GA3、IAA、ABA的含量。
2.2.3 生根形态观察及统计
扦插10 d后进行生根形态观测,间隔期为3 d,观测内容包括愈伤组织出现期、不定根出现期、不定根发生部位、根系的生长过程以及根系生长指标,40 d后统计扦插生根率。
3 结果与分析
3.1 插穗生根情况
经观测发现,植物生长调节剂处理的插穗生根活跃,愈伤组织和不定根形成的时间要早于对照。山杏插穗不定根的形成可划分为3个阶段,即诱导阶段、表达阶段、伸长阶段;其中诱导期为0~10 d,表达期为11~20 d,伸长期为21~40 d。观察插穗的生根部位,既有皮部生根类型,也有愈伤组织生根类型,其中愈伤组织生根数量居多,因此提出山杏扦插生根类型为愈伤组织生根类型。皮部生根型形态过程变化如图1~3所示,愈伤组织生根型形态过程变化如图4~6所示。
在不同处理中插穗生根率见表1,其中IBA(900 mg/L)和NAA (600 mg/L)混合激素处理的插穗生根率最高,为74.1%,IBA(700 mg/L)的生根率为66.8%,NAA(700 mg/L)的生根率为52.5%,生长调节剂处理的生根率均高于对照(28.1%),经方差分析和多重比较,3种处理与CK均存在极显著差异。

图1 根的诱导期(皮部生根型)Fig.1 Introduction period of rooting (phloem rooting type)

图2 根的表达期(皮部生根型)Fig.2 Expression period of rooting (phloem rooting type)

图3 根的伸长期(皮部生根型)Fig.3 Elongating stage of rooting (phloem rooting type)

图4 根的诱导期(愈伤组织生根型)Fig.4 Introduction period of rooting (callus rooting type)

图5 根的表达期(愈伤组织生根型)Fig.5 Expression phase of rooting(callus rooting type)

图6 根的伸长期(愈伤组织生根型)Fig.6 Elongation stage of rooting (callus rooting type)
3.2 生根过程中内源激素的变化
3.2.1 IAA含量的变化
在生根过程中,不同处理插穗内源激素IAA的含量见表2。从表2和图7可以看出,在3种处理的插穗中,其IAA含量有相近的变化规律,均呈“升高—降低—升高”的变化趋势,峰值均在扦插后10 d和40 d,即在根的诱导和伸长阶段出现,而CK在扦插后20 d出现峰值。同一时期各处理IAA含量比较,差异较大的时期出现在扦插后10 d和40 d,扦插后10 d时IBA+NAA、IBA和NAA处理的插穗IAA含量比CK分别提高53.3%、34.7%和25.8%,扦插后40 d时比CK分别提高65.7%、56.6%和28.2%,诱导和伸长阶段处理插穗的IAA含量与CK均存在极显著差异,且3种处理的生根率均高于CK,IAA含量(10 d)与生根率的相关系数为0.979,在0.05水平呈显著正相关,表明生长调节剂处理有利于促进山杏插穗IAA的合成,缩短诱导时间,且IAA对根原基的形成有重要作用。

表1 不同处理中插穗生根率Table 1 Rooting rate of cuttings in different treatments %
3.2.2 ABA含量的变化
在生根过程中,不同处理插穗内源激素ABA的含量见表3。由表3和图8可知,3种处理与CK的ABA含量变化趋势一致,均在诱导阶段下降,表达阶段有回升,伸长阶段再下降,总体呈现波动下降的趋势,且在诱导阶段下降明显。比较图7可以看出,在诱导阶段和表达阶段,3种处理的ABA含量与IAA含量此消彼长,变化趋势相反。各处理依ABA含量由高到低排列依次为CK、NAA、IBA、IBA+NAA,诱导阶段处理插穗的ABA含量与CK均存在极显著差异,ABA含量与生根率的相关系数为-0.994,在0.01水平呈极显著负相关,这表明高水平的ABA能抑制不定根的形成和生长。

表2 不同处理插穗生根过程中内源激素IAA含量Table 2 Content of endogenous hormone IAA during cutting rooting process in different treatments μg/g
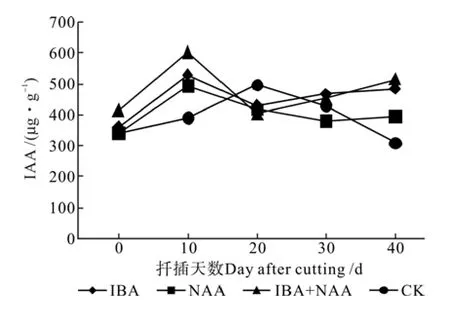
图7 山杏插穗IAA含量的变化Fig.7 Changes of IAA content in cuttings of Armeniaca sibirica

表3 不同处理插穗生根过程中内源激素ABA含量Table 3 Content of endogenous hormone ABA during cutting rooting process in different treatments μg/g
3.2.3 ZT含量的变化
在生根过程中,不同处理插穗中内源激素ZT的含量见表4。由表4和图9可以看出,各处理插穗中ZT含量均呈现先升高、后降低的变化趋势,且在根的表达阶段末期(20 d)出现峰值。IBA+NAA、IBA和NAA处理的ZT含量峰值比CK分别低34.2%、27.3%和9.1%,且与CK均存在极显著差异。各处理按ZT含量由高到低排列依次为CK、NAA、IBA、IBA+NAA,ZT含量(20 d)与生根率的相关系数为-0.989,在0.05水平呈显著负相关。在诱导阶段和表达阶段,生根率最高的混合处理插穗的ZT含量最低,与CK存在极显著差异,表明此期高水平的ZT含量对生根起抑制作用。在生根的每个阶段,混合处理的ZT含量均为最低的,且与对照均存在极显著差异。

图8 山杏插穗ABA含量的变化Fig.8 Changes of ABA content in cuttings of Armeniaca sibirica

图9 山杏插穗ZT含量的变化Fig.9 Changes of ZT content in cuttings of Armeniaca sibirica

表4 不同处理插穗生根过程中内源激素ZT含量Table 4 Content of endogenous hormone ZT during cutting rooting process in different treatments μg/g
3.2.4 GA3含量的变化
在生根过程中,不同处理插穗内源激素GA3的含量见表5。由表5和图10可以看出,在诱导阶段和表达阶段,处理的GA3含量变化趋势与CK相反,呈连续降低趋势。CK的GA3含量明显高于其它3组处理,而其生根率最低;3种处理生根率较高,整个生根过程中其GA3含量总体呈波动降低的趋势,生根的各阶段GA3含量均低于CK,且与CK均存在极显著差异,表明处理可以调节植株体内GA3含量,且低水平的GA3可促进生根。

表5 不同处理插穗生根过程中内源激素GA3含量Table 5 Content of endogenous hormone GA3 during cutting rooting process in different treatments μg/g
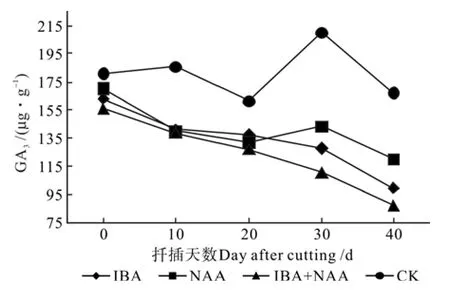
图10 山杏插穗GA3含量的变化Fig.10 Changes of GA3 content in cuttings of Armeniaca sibirica
3.2.5 IAA/IBA与IAA/ZT的变化
在生根过程中,不同处理插穗内源激素IAA与ABA和ZT含量的比值见表6、图11和图12。由表6和图11可知,在诱导阶段和伸长阶段,3种处理插穗的IAA/ABA值均高于CK,在扦插后10 d时差异最大,各处理的IAA/ABA值分别比CK提高100.3%、51.4%和41.1%,与CK均存在极显著的差异,且3种处理的生根率也均显著高于CK,IAA/ABA含量(10 d)与生根率呈正相关关系,相关系数为0.878,由此表明插穗生根率随IAA/ABA值升高而升高。不同处理的IAA/ABA值差异较大的2个时期分别为诱导阶段和伸长阶段,而此期也是扦插生根的关键阶段,因此可以推断IAA/ABA值对扦插生根影响明显,且IAA/ABA值高有利于根原基的形成,这与本研究中关于IAA和ABA含量变化的结论一致。
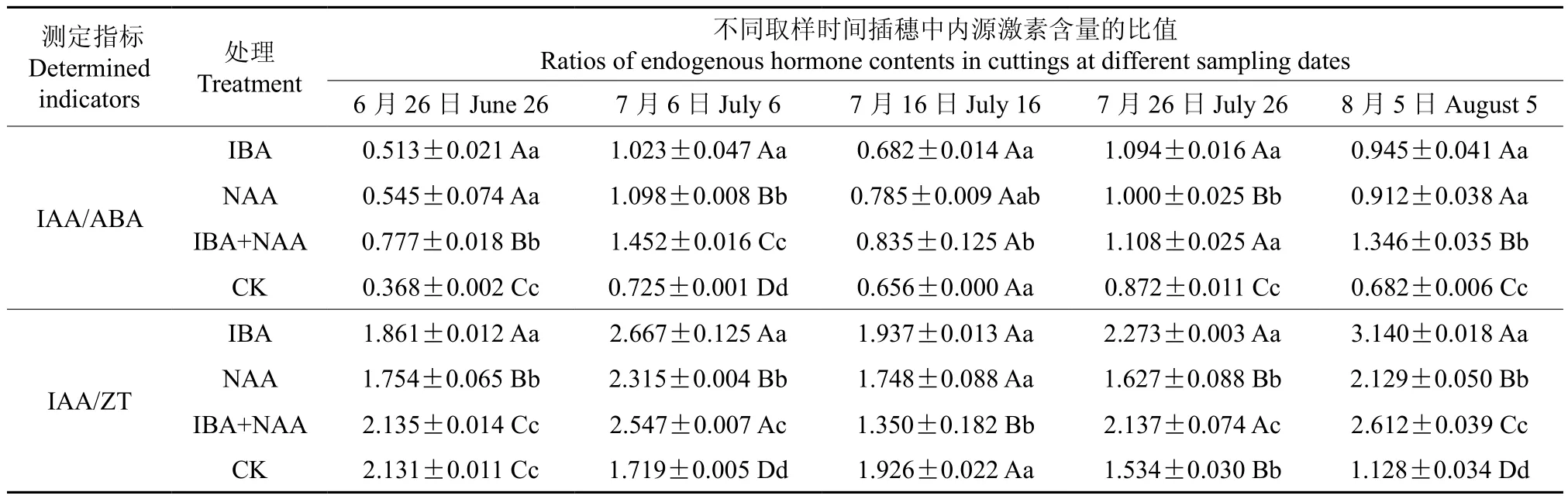
表6 不同处理插穗生根过程中内源激素含量比值Table 6 Ratios of endogenous hormone contents during cutting rooting process in different treatments
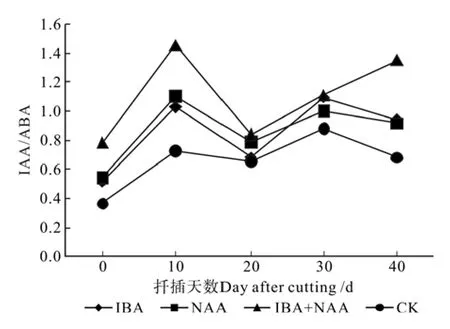
图11 山杏插穗IAA/ABA的变化Fig.11 Changes of IAA/ ABA in cuttings of Armeniaca sibirica
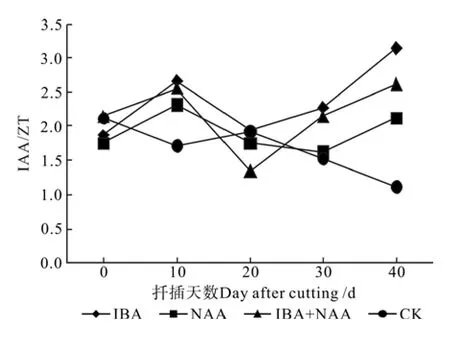
图12 山杏插穗IAA/ZT的变化Fig.12 Changes of IAA/ ZT in cuttings of Armeniaca sibirica
由表6和图12可知,3种处理的IAA/ZT值变化趋势相同,均表现为“升高—降低—升高”的变化趋势,CK变化趋势较平缓,总体呈下降趋势。各处理的IAA/ZT值在伸长阶段末期均高于CK,按照比值由高到低依次为IBA、IBA+NAA、NAA、CK,各处理的IAA/ZT值比CK分别提高178.4%、131.6%和88.7%,与CK均存在极显著差异,各处理的插穗生根率也明显高于CK,IAA/ZT值与生根率呈正相关关系,相关系数为0.92,表明处理可以调节插穗IAA/ZT水平,从而影响插穗生根。
4 结论与讨论
山杏嫩枝插穗生根的类型以愈伤组织生根为主,插穗生根过程包括3个阶段:即诱导阶段、表达阶段和伸长阶段;各阶段的天数分别为诱导期0~10 d,表达期11~20 d,伸长期21~40 d。插穗生根过程中,植物生长调节剂处理影响内源激素含量的变化,从而促进插穗生根;各处理的生根率显著高于对照,以IBA+NAA混合激素处理生根率最高,为74.1%。
处理组的IAA含量在根的诱导期和伸长期出现明显峰值,而对照峰值出现较晚,扦插10 d后IBA+NAA、IBA和NAA处理的插穗IAA含量比对照分别提高53.3%、34.7%和25.8%,扦插40 d后比对照分别提高65.7%、56.6%和28.2%,表明插穗IAA含量对根原基的诱导和伸长有重要作用。处理和对照的ABA含量变化总体呈波动下降的趋势,且在诱导阶段下降明显,各处理的ABA含量均低于对照,说明ABA能抑制不定根的形成和生长。各处理的ZT含量均呈现先升高、后降低的变化趋势,且在根的表达阶段末期出现峰值;ZT含量与生根率呈负相关,对生根起抑制作用。各处理的GA3含量总体呈波动降低的趋势,其中生根率高的IBA+NAA处理呈连续降低趋势,低水平的GA3可促进根原基的发生。在诱导阶段和伸长阶段,各处理的IAA/ABA值在诱导和伸长阶段出现2次峰值,在扦插后10 d时差异最大,分别比对照提高100.3%、51.4%和41.1%,且与生根率呈正相关,高IAA/ABA值有利于根原基的形成。各处理的IAA/ZT值表现出明显的“升高—降低—升高”的变化趋势,CK变化趋势较平缓,总体呈下降趋势;各处理的IAA/ZT值在扦插后40 d时与对照差异最大,分别提高178.4%、131.6%和88.7%。
近年来,很多学者把不定根形成的研究重点转向生根过程中内源激素含量的动态变化。徐佩贤在对东方杉嫩枝扦插的研究中强调IAA对不定根发生具有重要作用[7]。扈红军在榛子扦插研究中提到,经处理的欧榛嫩枝扦插生根过程中IAA含量的变化趋势为“升高—降低—升高”,说明植株体内的IAA是促进生根因子之一[8]。刘明国在北美香柏插穗生根过程中内源激素的变化和詹亚光在白桦大树伐根萌条扦插试验中均说明IAA含量的高峰与根原基出现的高峰相一致[9-10]。本试验的研究结果与上述观点一致,即IAA含量在不定根的诱导阶段升高显著,在山杏插穗生根前期作用明显。詹亚光和张晓平等关于脱落酸ABA的动态变化研究中认为,ABA含量变化呈现“下降—上升—下降”的变化趋势[10-11]。关于ABA的动态变化有研究表明,ABA含量变化呈现持续下降趋势[7,12],本研究中结果表明,ABA含量在生根过程中总体呈下降趋势,在生根前期表现得比较突出,且ABA含量与生根率成反比,表明高水平ABA能抑制不定根的形成和生长,这与上述研究结果基本一致。赤霉素和细胞分裂素类物质对多种植物不定根的产生具有抑制作用[13-14]。齐永顺等在比较同源四倍体玫瑰香与二倍体玫瑰香扦插生根过程中发现,四倍体玫瑰香插穗皮层内的根原基诱导期GA3、ZT含量明显高于二倍体,可能是导致其生根能力下降的原因[15]。这与本研究结果一致,但也有研究表明,ZT对插穗不定根形成的影响不明显[16]。有研究认为,IAA含量的动态变化与ABA是此消彼长的关系,IAA/ABA值高有利于根原基的形成,促进生根[17-18]。此外,很多学者也认为生长素与ABA、生长素与CTK的比值越高,对不定根形成的促进作用越明显[19-20],这与本试验中研究结果一致。
由于不同内源激素共存于同一植物体中,它们出现的时间和含量不同,还受外界条件的影响,各种激素综合作用的结果就会产生一种平衡状态[21-22],山杏嫩枝插穗生根过程中如何达到这种平衡,有待于以后进一步的研究。
参考文献:
[1] 刘明国,王 威,贺 江,等.山杏混交林花果期小气候特点及其对坐果率的影响[J].东北林业大学学报, 2010, 38(6): 28-30.
[2] 申 展,李铁华,文仕知,等.不同因素对闽楠嫩枝扦插生根的影响[J].中南林业科技大学学报, 2013,33(1):63-67.
[3] 赵 坤,吴际友,程 勇,等.楸树无性系嫩枝扦插繁殖的研究[J].中南林业科技大学学报, 2010,30(7):66-69.
[4] 王海南,沈海龙,杨立学.紫椴嫩枝扦插繁殖技术研究[J].经济林研究, 2012,30(3):106-110.
[5] 董胜君,刘明国,戴 菲,等.山杏嫩枝扦插繁殖试验[J].经济林研究, 2013,31(1):176-180.
[6] 董胜君,刘明国,戴 菲,等.2种激素处理的山杏插穗生根过程中营养物质及酶活性的变化[J].西部林业科学,2012, 41(6):26-30.
[7] 徐佩贤.东方杉嫩枝扦插繁殖技术及其生根机理研究[D].南京:南京林业大学,2009.
[8] 扈红军.榛子扦插生根机理与繁殖技术的研究[D].泰安:山东农业大学,2008.
[9] 刘明国,王 玲,董胜君,等.北美香柏插穗生根过程中内源激素的变化[J].沈阳农业大学学报,2010,41(5):555-559.
[10] 詹亚光,杨传平,金贞福,等.白桦扦插生根的内源激素和营养物质[J].东北林业大学学报,2001,29(4):1-4.
[11] 张晓平,方炎明,黄绍辉.杂种鹅掌楸扦插生根过程中内源激素的变化[J].南京林业大学学报,2004,28(3):79-82.
[12] 秦新民,梁倩华.白花泡桐不定根发生过程中内源激素和RNA的变化[J].热带亚热带植物学报,1995,4(1):52-56.
[13] Hartung W, Ohl B, Kummer V.Abscisic acid and the root formation[J].Lantbruskhogskolans Annaler,1980,32:109-244.
[14] Fabijan D, Taylor J S, Reid D M.Adventitious rooting in hypocotyls of sunflower (Helianthus annus) seedlingsⅡ[J].Action of gibberellins, cytokinins, auxins and ethylene Physiolojia Plantarum, 1981,53:589-597.
[15] 齐永顺,张志华,王同坤,等.同源四倍体玫瑰香葡萄嫩枝扦插不定根发生过程中内源激素的变化[J].园艺学报,2009,36(4): 565-570.
[16] 何桢祥.杉木无性系扦插繁殖生根机理[J].浙江林学院学报,1994,11(1):38-44.
[17] 刘 涛,张华新,庞晓慧.翅果油树年龄与内源激素含量及嫩枝扦插生根[J].经济林研究, 2009,27(4):26-30.
[18] 马振华,王吉斌,李才文,等.四倍体刺槐硬枝扦插生根过程中内源激素的变化[J].中南林业科技大学学报, 2013, 33(6):26-32.
[19] Brian P W, Radley M.A physiological comparison of gibberellic acid with some auxins[J].Physiologia Plantarum,1955, (8): 899-912.
[20] 郭素娟,凌宏勤,李凤兰.白皮松插穗生根的生理生化基础研究[J].北京林业大学学报,2004,26(2):43-47.
[21] 何 见,陈卫军,蒋丽娟,等.光皮树花中内源激素和碳水化合物含量的变化[J].中南林业科技大学学报, 2009, 29(1):15-19.
[22] 邓文韬,张日清,袁德义.植物生长调节剂对菲油果嫩枝扦插生根的影响[J].中南林业科技大学学报, 2011, 31(3):160—163.
