杜仲α-亚麻酸生物合成相关基因的差异表达
2013-04-03李铁柱杜红岩刘攀峰
李铁柱,杜红岩,刘攀峰
(1.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003;2.国家林业局 杜仲工程技术研究中心,河南 郑州 450003)
杜仲Eucommia ulmoidesOliv.是我国特有名贵药用树种[1-4],杜仲种仁中富含油脂脂肪酸,主要成分组成为豆蔻酸、棕榈酸、硬脂酸、油酸、亚油酸和α-亚麻酸等6种脂肪酸组分[5]。α-亚麻酸(α-linolenic acid,ALA)在杜仲翅果种仁中含量高达66.4%[6],是目前发现的植物中α-亚麻酸含量最高的木本植物之一,具有极大的开发潜力[7-11]。研究发现0.25~1.00 g/kg剂量的杜仲籽油可显著降低大鼠血清甘油三酯及胆固醇含量[12-14]。
亚麻酸可分为α-亚麻酸(α-linolenic acid,ALA)和γ-亚麻酸(γ-linolenic acid,GLA)2种,它们均是18个碳原子3个双键直链脂肪酸,相对分子质量为278[15-16]。其中,α-亚麻酸结构为顺9,顺12,顺15十八碳三烯酸,简记为9,12,15-18:3;γ-亚麻酸结构为顺6,顺9,顺12十八碳三烯酸,简记为6,9,15-18:3[17]。二者差异仅在于其中1个双键位置不同。在天然油脂中,根据多不饱和脂肪酸甲基端距离最近双键碳原子数的不同,将不饱和脂肪酸分为3个系列:以油酸为主的n-9系列;以亚油酸、亚油酸、花生四烯酸为主的n-6系列;以α-亚麻酸、EPA、DHA为主的n-3系列。这3个系列的脂肪酸在体内不能相互转换。n-3系列亚麻酸可在体内代谢为EPA和DHA,所以α-亚麻酸具有类似EPA、DHA的生理功能和化学特性[18]。α-亚麻酸ALA 的生物合成途径:硬脂酸在Δ9-脂肪酸脱氢酶的催化下生成油酸(oleic acid,OA),油酸在Δ12-脂肪酸脱氢酶的催化下生成亚油酸(linoleic acid,LA),随后,亚油酸进入多不饱和脂肪酸代谢的n-3 途径或直接进入n-6 途径(见图1)。在n-3途径中,LA在Δ15-脂肪酸脱氢酶的催化下转化成α-亚麻酸;而在n-6 途径中,LA经Δ6-脂肪酸脱氢酶的催化生成γ-亚麻酸。在上述2个反应中,Δ15-脂肪酸脱氢酶控制总反应的反应速度和方向,是ALA代谢途径的关键酶[19]。文中在杜仲果实和叶片转录组测序的基础上,比较分析α-亚麻酸合成途径中的系列基因在不同器官不同时期的表达差异,旨在为杜仲α-亚麻酸生物合成的分子调控机制研究提供理论依据。

图1 α-亚麻酸的生物合成的途径Fig.1 The pathway of α-linolenic acid biosynthesis
1 材料与方法
分别于2010年5月28日和10月28日,在国家林业局泡桐研究开发中心采集“华仲6号”杜仲优良品种叶片和果实,提取RNA,送至深圳华大基因公司进行转录组测序和基因功能注释[20-21]。
转录组测序得到的Unigene,利用NCBI网站上的BLAST工具,和其它物种已知的α-亚麻酸相关CDS序列进行在线比较,用相似性得分比较高的已知基因确定并命名杜仲转录组中的α-亚麻酸合成相关基因。基因确定后,分析该基因(或基因家族)在杜仲叶片和果实(幼嫩果实和成熟果实)中的表达量差异。
2 结果与分析
2.1 杜仲α-亚麻酸生物合成途径中注释的Unigene
2.1.1 杜仲幼果和成果中α-亚麻酸生物合成途径中注释的Unigene
杜仲幼果和成果转录组数据中α-亚麻酸合成途径,从硬脂酸起始,共涉及3个代谢位点(见图2)。位点3.1.2.2注释有Unigene1258、Unigene18404、Unigene9145等 3条 Unigene, 其中差异表达基因有4条;位点1.14.19.1注释有Unigene6936等4条Unigene,成熟果实特异表达有3条;位点1.14.19.-注释有Unigene1906等6条Unigene,幼果和成果中表达水平显著差异的有Unigene1条。
2.1.2 杜仲叶片和幼果中α-亚麻酸生物合成途径中注释的Unigene
杜仲叶片和幼果转录组数据中,α-亚麻酸合成途径共涉及3个代谢位点。位点3.1.2.2注释有Unigene19869、Unigene40659、Unigene40822等 3条Unigene,且均有显著的差异表达;位点1.14.19.1注释有Unigene6936;位点1.14.19.-注释有Unigene63、Unigene12834等2条Unigene,其中Unigene63在杜仲叶片和幼果中表达水平有显著差异。
2.2 杜仲α-亚麻酸生物合成关键酶基因的确定
2.2.1 杜仲幼果和成果中α-亚麻酸生物合成关键酶基因的确定
杜仲幼果和成果的转录组数据经过进一步BLAST分析后发现,Unigene1906、Unigene14989、Unigene18329等6条Unigene与茄子等植物的δ-15脂肪酸脱氢酶相似性达到55%~86%,其中Unigene14989为δ-15脂肪酸脱氢酶全长cDNA;Unigene6936、Unigene47927等 4条 Unigene与 油桐等植物的δ-9脂肪酸脱氢酶相似性达到71%~91%,其中Unigene47927为δ-9脂肪酸脱氢酶全长cDNA;Unigene1258、Unigene18404、Unigene9145与拟南芥等植物的酰基CoA硫酯酶相似性达到69%~81%,Unigene18404为酰基CoA硫酯酶全长cDNA(见表1)。
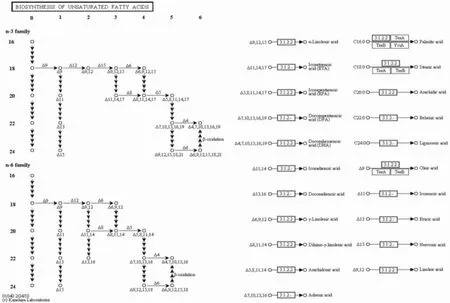
图2 KEGG数据库中的亚麻酸生物合成途径Fig.2 The KEGG pathway of α-linolenic acid biosynthesis

表1 杜仲幼果和成熟果α-亚麻酸合成途径中相关酶基因和对应Unigene相似度信息Table 1 The related enzyme genes and of corresponding Unigene similarity information in α-linolenic acid synthesis pathway in Eucommia ulmoides young fruit and mature fruit
2.2.2 杜仲幼果和叶片中α-亚麻酸生物合成相关酶基因的确定
杜仲幼果和叶片的转录组数据经过进一步BLAST分析后发现,Unigene63、Unigene12843与其它植物种的δ-15脂肪酸脱氢酶基因相似性分别达到79%和55%;Unigene10591与其它植物种的δ-9脂肪酸脱氢酶相似性达到73%;Unigene19869与其它植物种的酰基CoA硫酯酶相似性达到70%(见表2)。
2.3 杜仲EuFatA基因的表达差异
转录组分析结果表明,杜仲幼果和成熟果实中FatA获得3个拷贝,但序列比对后发现,3条FatA基因Unigene序列与葡萄的acyl-coenzyme A thioesterase 8 完全相同(见表3),故命名为EuFatA8。
基因表达量差异分析结果表明,3条FatA基因的Unigene表达量差异未达到显著水平,见表4和图3。

表2 杜仲幼果和叶片α-亚麻酸合成途径中相关酶基因和对应Unigene相似度信息Table 2 The related enzyme genes and of corresponding Unigene similarity information in α-linolenic acid synthesis pathway in Eucommia ulmoides young fruit and leaf

表4 EuFatA相关Unigene在杜仲幼果和成熟果中的表达量Table 4 Expression of related EuFatA Unigene in young fruit and mature fruit
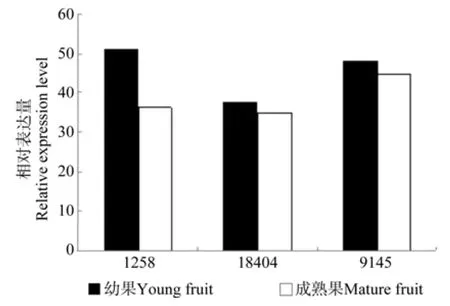
图3 EuFatA相关Unigene在杜仲幼果和成熟果中的表达差异Fig.3 Expression difference of related EuFatA Unigene in young fruit and mature fruit
2.4 杜仲EuSAD基因的表达差异
硬脂酰-ACP去饱和酶(stearoyl-ACP desaturase,SAD),它是唯一一个可溶的去饱和酶,存在于质体中。在脂肪酸形成甘油脂之前,SAD催化引入第1个双键[22-23]。在杜仲的幼果和成熟果实中有被注释为SAD基因的Unigene共4有条,分别命名为EuSAD1~EuSAD4(见表5)。

表5 杜仲δ-9脂肪酸脱氢酶基因的多样性Table 5 Diversity of EuSAD genes
表达差异分析结果表明,EuSAD1~EuSAD4在成熟果实中均有表达,但只有EuSAD1的表达量较高,其它3个微量表达;而在幼果中只有EuSAD1表达,且表达量较高。EuSAD1在幼果中的表达量高于成熟果实,见表6和图4。推断杜仲幼果和成熟果实的SAD基因均以EuSAD1为主。

表6 SAD相关Unigene在杜仲幼果和成熟果中的表达量Table 6 Expression of related EuSAD Unigene in young fruit and mature fruit
2.5 杜仲EuFAD2基因的表达差异
在杜仲幼果和成熟果实中δ-12脂肪酸脱氢酶(FAD2)有5个拷贝(见表7),分别命名为EuFAD2-1~EuFAD2-5。

图4 SAD相关Unigene在杜仲幼果和成熟果中的表达差异Fig.4 Expression difference of related SAD Unigene in young fruit and mature fruit

表7 杜仲δ-12脂肪酸脱氢酶基因的多样性Table 7 Diversity of EuFAD2 genes
EuFAD2-1和EuFAD2-2这2条FAD2基因在杜仲幼果和成熟果实中的表达量差异达到显著水平,其余3条EuFAD2基因的表达量无显著差异;幼果中EuFAD2-4、EuFAD2-5的表达量超过成熟果实。
FAD2基因根据其在成熟果实中表达量由大到小排列依次为EuFAD2-1、EuFAD2-2、EuFAD2-3、EuFAD2-4、EuFAD2-5,根据其在幼果中的表达量由大到小依次为EuFAD2-2、EuFAD2-1、EuFAD2-4、EuFAD2-3、EuFAD2-5(见表8和图5)。

表8 δ-12脂肪酸脱氢酶相关Unigene在杜仲幼果和成熟果中的表达量Table 8 Expression of related EuFAD2 Unigene in young fruit and mature fruit
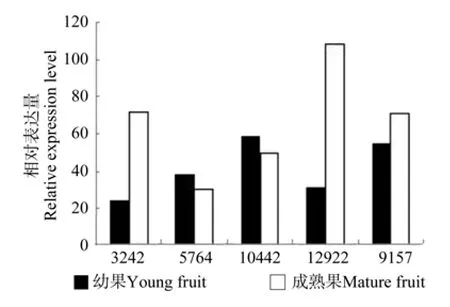
图5 EuFAD2相关Unigene在杜仲幼果和成熟果中的表达差异Fig.5 Expression difference of related EuFAD2 Unigene in young fruit and mature fruit
2.6 杜仲 EuFAD3基因的多样性和表达调控规律
转录组分析结果表明,在杜仲成熟果实和幼果中α-亚麻酸生物合成关键酶基因FAD3共有6个拷贝,分别命名为EuFAD3-1-EuFAD3-6(见表9)。

表9 杜仲ω-3脂肪酸脱氢酶基因的多样性Table 9 Diversity of EuFAD3 genes
对表达差异的研究结果表明,6个FAD3基因中只有EuFAD3-6在成熟果实和幼果中具有显著的表达差异(见表10)。而且在成熟果实中表达量比幼果高出3.56倍(见图6);而EuFAD3-1~EuFAD3-5的表达量均未达到显著水平。
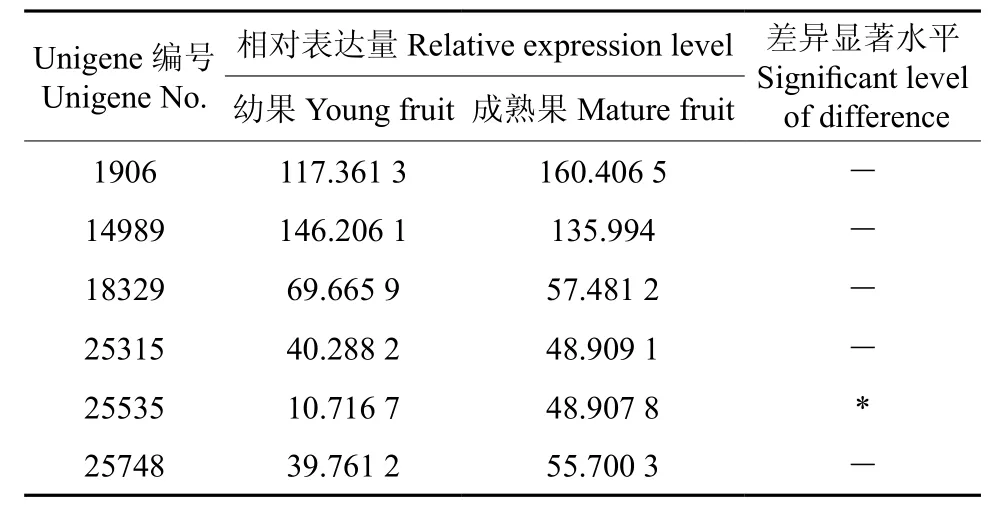
表10 δ-15脂肪酸脱氢酶相关Unigene在杜仲幼果和成果中的表达量Table 10 Expression of related EuFAD3 Unigene in young fruit and mature fruit
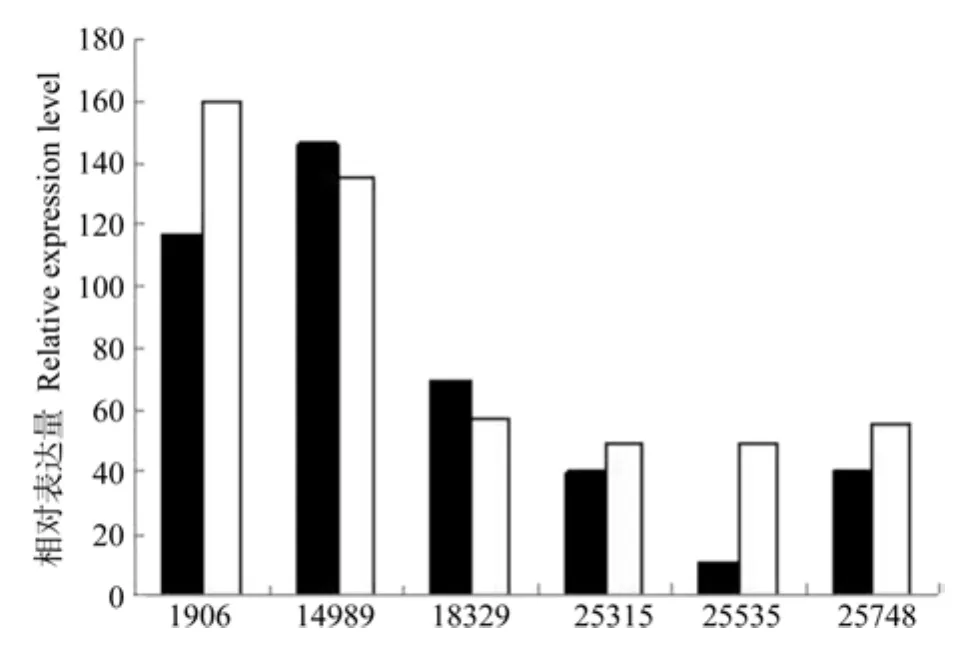
图6 δ-15脂肪酸脱氢酶相关Unigene在杜仲幼果和成果中的表达差异Fig.6 Expression difference of related EuFAD3 Unigene in young fruit and mature fruit
EuFAD3-1~EuFAD3-6根据其在幼果中的表达量由大到小排序依次为:EuFAD3-2、EuFAD3-1、EuFAD3-3、EuFAD3-5、EuFAD3-4、EuFAD3-6;依据其在成熟果实中的表达量由大到小排序依次为:EuFAD3-1、EuFAD3-2、EuFAD3-3、EuFAD3-4、EuFAD3-5、EuFAD3-6;在成熟果实中EuFAD3-1、EuFAD3-4、EuFAD3-5、EuFAD3-6等4个EuFAD基因的表达量均超过幼果,这与成熟果实的α-亚麻酸含量远超过幼果的情况基本一致。
3 结论与讨论
文中研究了杜仲α-亚麻酸合成途径重要基因的遗传多样性和表达规律,并鉴定了全长cDNA。在幼果和成熟中获得α-亚麻酸合成相关酶13条,其中差异表达基因6条,叶片和幼果获得6条基因,差异表达3条;酰基ACP硫脂酶(FatA)基因在幼果和成熟果实表达量无显著差异;硬脂酰-ACP去饱和酶(SAD)基因由4个家族成员(EuSAD1-EuSAD4)组成,在成熟果实中均有表达,而幼果中只有EuSAD1表达,EuSAD1在幼果和成熟果实中表达量无显著差异,但幼果表达量较高,幼果还是成熟果实均以EuSAD1为主;δ-12脂肪酸脱氢酶(FAD2)基因遗传多样性较高,由5个家族成员(EuFAD2-1-EuFAD2-5)组成,EuFAD2-1和EuFAD2-2在幼果和成熟果实中表达量达到显著水平,EuFAD2-1-EuFAD2-3的表达量果实高于叶片,而EuFAD2-4和EuFAD2-5幼果高于成熟果实,作用机理较复杂;ω-3脂肪酸脱氢酶(FAD3)基因家族由6个成员组成(EuFAD3-1-EuFAD3-6),只有EuFAD3-6表达量具有显著差异,且成熟果实比高出3.56倍,而EuFAD3-1~EuFAD3-5表达量均未达到显著水平,成熟果实EuFAD3-1、EuFAD3-4-EuFAD3-6等4个基因表达量超过幼果,这可能与成熟果实α-亚麻酸含量远高于幼果的情况一致。
杜仲籽油不饱和脂肪酸含量达91.18%,其中α-亚麻酸高达67.60%,α-亚麻酸被世界卫生组织确定为人体自身不能合成的必需脂肪酸,具有促进脑发育、增强智力,保护视力,降血脂,降血压,抑制血栓性疾病,预防心肌梗塞和脑梗塞,抑制过敏,抑制癌症的发生和转移、抗衰老等多种功能;α-亚麻酸ALA的生物合成途径:硬脂酸在Δ9-脂肪酸脱氢酶的催化下生成油酸,油酸在Δ12-脂肪酸脱氢酶的催化下生成亚油酸,随后,亚油酸进入多不饱和脂肪酸代谢的n-3途径或直接进入n-6途径。在n-3途径中,LA在Δ15-脂肪酸脱氢酶的催化下转化成α-亚麻酸;而在n-6途径中,LA经Δ6-脂肪酸脱氢酶的催化生成γ-亚麻酸。α-亚麻酸合成过程中的关键酶基因中FatA的遗传多样性较低,不同植物中保守性较强,而SAD、FAD2和FAD3遗传多样性都较高,如杜仲中SAD至少包含4个成员,FAD2至少包含5个家族成员,FAD3至少包含6个成员,而且这些家族成员的表达模式及不同器官中的表达特异性均不一致,表现出了亚麻酸合成过程中的多样化及复杂性。如杜仲成熟果实中3个SAD基因均表达,而幼果中只有EuSAD1表达,FAD2的5个家族成员EuFAD2-1和EuFAD2-2在幼果和成熟果实中表达量达到显著水平,EuFAD2-1-EuFAD2-3的表达量果实高于叶片,而EuFAD2-4和EuFAD2-5幼果高于成熟果实,作用机理较复杂,FAD3基因家族由6个成员组成,仅有EuFAD3-6表达量具有显著差异,且成熟果实比幼果高,成熟果实中大部分基因如EuFAD3-1、EuFAD3-4-EuFAD3-6等基因表达量超过幼果,这可能与成熟果实α-亚麻酸含量远高于幼果的情况一致,另一方面表现出了该基因在亚麻酸合成过程的调控的复杂性,需要进一步研究。
参考文献:
[1] 李时珍.本草纲目[M].北京:北京出版社,1995:1590-1596.
[2] 贺义昌.杜仲叶中绿原酸和芦丁的提取分离及纯化[D].长沙:中南林业科技大学,2012.
[3] 杜红岩,李 钦,傅建敏,等.杜仲雄花茶的食品安全性毒理学[J].中南林业科技大学学报,2008,28(2):91-94.
[4] 杜红岩,李 钦,刘攀峰,等.不同变异类型杜仲皮及再生皮中木脂素类成分含量比较[J].中南林业科技大学学报,2010,30(7): 38-42.
[5] 段小华,邓泽元,朱 笃.杜仲种子脂肪酸及氨基酸分析[J].食品科学,2010,(4):214-217.
[6] 赵德义,徐爱遐,张博勇,等.杜仲籽油与紫苏籽油脂肪酸组成的比较研究[J].西北植物学报,2005,(1):191-193.
[7] 李丽萍,韩 涛.富含α-亚麻酸植物资源的开发与利用[J].食品科学,2007,(11):614-618.
[8] 吴丽雅,黄 群,余 佶,等.杜仲籽油混合脂肪酸制备工艺优化及脂肪酸组成分析[J].食品工业科技,2013,(14):287-291.
[9] 欧阳辉.从杜仲翅果中提取果仁油、桃叶珊瑚苷和杜仲胶的工艺研究[D].长沙:湖南中医药大学,2012.
[10] 杜红岩.我国的杜仲胶资源及其开发潜力与产业发展思路[J].经济林研究,2010,28(3):1-3.
[11] 杜红岩, 胡文臻, 俞 锐.中国杜仲橡胶资源与产业发展报告[R].北京:社会科学文献出版社,2013:133-134.
[12] 郭美丽,周燕平.杜仲籽油辅助降血脂作用实验研究[J].中国预防医学志,2008,9(7):677-678.
[13] 薛程远,曲范仙,刘 辉,等.杜仲叶乙醇提取物对小鼠免疫功能的影响[J].甘肃中医学院学报,1998,15(3):50-52.
[14] San Giovanni J P, Chew E Y.The role of omega-3 long-chain polyunsaturated Fatty acids in health and disease of the retina [J].Progress in Retina and Eye Research,2005,24(1): 87-138.
[15] 蔡双莲,李 敏.多不饱和脂肪酸的研究进展[J].生命科学研究,2003,(4):289-292,304.
[16 Shark A H, Crawford M A, Reifen R.Update on alpha-linelic acid[J].Nutrition Reviews,2008,66(6):326-332.
[17] 周同永,任 飞,邓 黎,等.γ-亚麻酸及其生理生化功能研究进展[J].贵州农业科学,2011,(3):53-58.
[18] 陶国琴,李 晨.α-亚麻酸的保健功效及应用[J].食品科学,2000,(12):140-143.
[19] 范文洵.α-亚麻酸及其代谢产物EPA和DHA[J].生理科学进展,1988,(2):110-113.
[20] 李铁柱,杜红岩,刘慧敏,等.杜仲果实和叶片转录组数据组装及基因功能注释[J].中南林业科技大学学报,2012,32(11):122-130.
[21] 李铁柱,杜红岩,刘慧敏,等.杜仲幼果和成熟果实转录组数据组装及基因功能注释[J].中南林业科技大学学报,2012,32(10): 9-17.
[22] 张党权,谭晓风,谢禄山,等.油茶EST文库中不饱和脂肪酸合成关键酶基因的序列分析(英文)[J].经济林研究,2007,25(2):5-8.
[23] 卢善发.植物脂肪酸的生物合成与基因工程[J].植物学通报,2000,(6):481-491.
