苹果属无融合生殖相关SERK4基因表达载体的构建
2013-04-03张丽杰董文轩
张丽杰,董文轩
(沈阳农业大学 园艺学院,辽宁 沈阳 110866)
植物的生殖发育阶段是其整个生命过程中非常重要的阶段。由于植物的无融合生殖习性具有重要的生物学意义,并在缩短育种周期、固定杂种优势等方面具有重大潜力,因此,植物无融合生殖研究已是生物学研究的热点之一。SERK(Somatic Embryogenesis Receptor-like Kinase)基因,全称为“体细胞胚胎发生相关类受体蛋白激酶基因”[1],是体胚发生过程中最重要的基因,通常认为,SERK基因与无融合生殖习性密切相关。SERK基因最初为Schmidt等人[2]在胡萝卜Daucus carota的下胚轴中发现。随后,有关研究者又在拟南芥Arabidopsis thaliana[3]、玉米Zea may[4]、苜蓿Medicago truncatula[5]等植物中克隆和鉴定了SERK基因。目前,科学家们已经从向日葵Helian thusannuus[6]、 鸭 茅Dactylis glomerata[7]、 可 可Theobroma cacao[8]、 蜜 柑Citrus unshiu[9]、 草 地 早熟禾Poa pratensis[10]等植物中分离到不同的SERK基因。有关研究结果证明,SERK基因广泛存在于双子叶植物、单子叶植物及裸子植物中,组成了一个新的基因家族[11]。
无融合生殖现象在苹果属多倍体植物中普遍存在。无融合生殖后代是母本的复制品,不含有来自父本的遗传物质,保持了母本的全部特征。平 邑 甜 茶Malus hupehensis(Pamp.)Rehd.varpingyiensisJiang是苹果属Malus湖北海棠Malus hupehensisRehd.的一个变种,是典型的无融合生殖型三倍体植物。平邑甜茶具有非常高的无融合生殖能力,其无融合生殖率在95%以上;但其杂交后代四倍性皱叶矮生株系的无融合生殖能力却显著降低。
为了探索SERK4基因在苹果属平邑甜茶及其杂交后代33#无融合生殖习性上的功能与作用,阐明该基因在植物胚胎发育过程中的表达特性,以平邑甜茶及其杂种后代33#株系的cDNA为模板,扩增出MhSERK4和MhdSERK4基因cDNA全长,再将其克隆到植物表达载体pBI121中,获得了MhSERK4和MhdSERK4基因的植物表达载体pBI121-MhSERK4和pBI121-MhdSERK4,旨在将其转化到番茄中,为进一步研究SERK基因影响无融合生殖的机理提供理论依据。
1 材料与方法
1.1 植物材料
供试的植物材料为苹果属三倍体无融合生殖型平邑甜茶Malus hupehensis(Pamp.) Rehd.var.pingyiensisJiang及其与扎矮山定子M.baccata杂交的后代四倍体皱叶矮生株系33#的花期子房。
1.2 菌株与质粒
克隆载体PGM-T购自天根生物公司,植物表达载体pBI121和农杆菌由沈阳农业大学张志宏教授馈赠。
1.3 试 剂
限制性内切酶XbaI和SmaI、T4DNA连接酶、AMV反转录酶等试剂购自TAKARA生物公司,DNA Marker购于北京天根生化科技有限公司,质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒均购于上海生物工程公司。
1.4 方 法
1.4.1 引物设计与合成
根据已获得的平邑甜茶及其与扎矮山定子杂交获得的杂种后代33#株系无融合生殖基因MhSERK4和MhdSERK4基因的CDS编码区设计引物,在开放读码框两端分别设计上游引物和下游引物,上游引物引入XbaI酶切位点,下游引物引入SmaI酶切位点。引物由赛百盛生物公司合成。
MhSERK4和MhdSERK4引物设计如下:
上游引物SF为 5’GGTCTAGAATGACGTCTT CCACCTCTGTTTC 3’;
下游引物SR为 5’ACCCCGGGTCATCTAGG ACCGGACAACTCAT 3’。
1.4.2 平邑甜茶及其杂交后代皱叶矮生33#株系RNA的提取及RT-PCR扩增
采用常规CTAB法提取平邑甜茶及其杂交后代皱叶矮生33#株系的子房RNA,在20 μL的反应体系中加入RNA样品,在AMV反转录酶作用下合成cDNA第一链。其反应程序为:65 ℃水浴5 min,立即置于冰上2~3 min,在PCR仪中37 ℃ 2.5 h,70 ℃ 15 min,使酶失活,反转录合成cDNA。
1.4.3 目的基因的扩增
目的基因的扩增采用20 μL反应体系。上下游 引 物 各 1 μL,dNTP 2.0 μL,ExTaq 0.25 μL,10×Buffer 2.5 μL,cDNA 1.0 μL,ddH2O 补 足 至20 μL。PCR 反应程序为:94 ℃预变性 5 min(94 ℃变性40 s,60 ℃退火40 s,72 ℃延伸2 min);30个循环;72 ℃后延伸10 min。PCR产物用1.0%琼脂糖凝胶进行电泳纯化,去除引物及引物二聚体,试剂盒回收目标条带。
1.4.4 pBI121-MhSERK4和pBI121-MhdSERK4的构建
将平邑甜茶及其杂种后代33#株系进行PCR扩增获得的cDNA全长序列测序正确的PGM-MhSERK4和PGM-MhdSERK4克隆载体与CaMV35S组成型启动子驱动的pBI121植物表达载体分别用限制性内切酶XbaI和SmaI进行双酶切,XbaI的识别位点为TCT AGA,SmaI的识别位点为CCC GGG。酶切体系为20 μL:XbaI和SmaI各 1 μL,BSA 2 μL,10×Buffer 2 μL,目的基因质粒14 μL。用琼脂糖凝胶电泳检测目的片段;使用AxyPrep胶回收试剂盒回收目的片段,并利用NEB公司生产的T4DNA连接酶将MhSERK4和MhdSERK4基因定向插入pBI121表达载体中报告基因的位置,然后连接转化,挑取单克隆进行PCR鉴定,将以PCR法鉴定出的阳性克隆送北京华大生物有限公司测序。
2 结果与分析
2.1 RNA质量检测
取3 μg所提平邑甜茶和杂交后代33#株系的RNA,在1%的琼脂糖凝胶上进行电泳检测,结果如图1所示。图1显示,RNA条带清晰且完整。使用美国Beckman 公司生产的核酸蛋白分析仪检测RNA 的含量和质量,结果表明:OD260/OD280的比值分别为1.916 1和1.926 3,说明RNA的纯度较高,无蛋白污染,可以用于后续的试验。
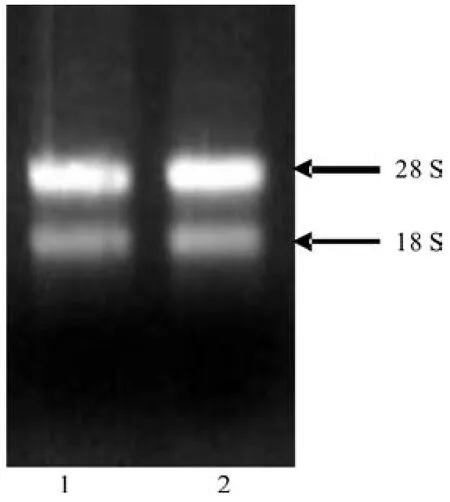
图1 RNA质量检测结果Fig.1 Result of RNA quality detection
2.2 目的基因的PCR扩增
以平邑甜茶和杂种后代33#子房cDNA为模板,采用设计的引物序列进行PCR扩增,结果如图2所示。由图2可知,扩增出约1 836 bp的片段,其大小与预期的结果一致,可以用于下一步的试验。

图2 PCR扩增结果Fig.2 Result of PCR ampli fi cation
2.3 pBI121-MhSERK4载体的鉴定
用回收试剂盒回收PCR产物,并且用XbaI和SmaI酶切PCR产物,用限制性内切酶XbaI和SmaI酶切载体pBI121,鉴定结果如图3所示。然后连接转化,挑取单克隆作PCR鉴定,鉴定结果见图4。最后选取该阳性菌送往华大生物有限公司进行测序分析,分析结果表明,其与PCR扩增的cDNA序列的同源性达99.69%,说明是我们需要的目的基因。这一结果与预期结果一致。
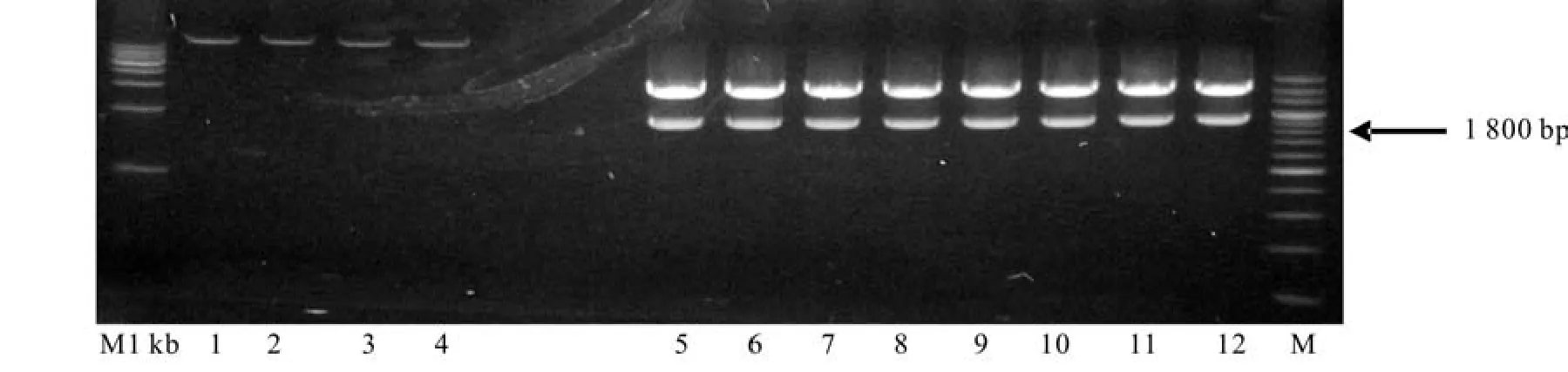
图3 双酶切鉴定结果Fig.3 Identi fi cation result of double enzyme digestion
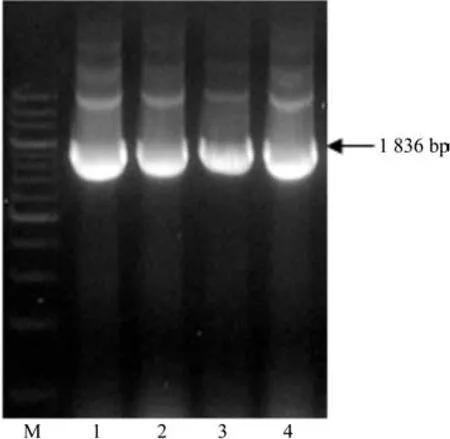
图4 PCR鉴定结果Fig.4 PCR identi fi cation result
3 讨 论
成功构建载体是进行转基因研究的前提。植物表达载体pBI121是从根癌农杆菌双元质粒衍生而来的,属组成型的表达载体,其大小为14 753 bp,带有多个克隆位点,上游带有CaMV35S启动子,下游带有GUS报告基因[12];因此,pBI121是常用的植物表达载体[13]。在载体构建过程中会受到多种因素的影响,不同的基因及不同的载体需要不同的反应条件和体系。此外,基因序列的大小和载体的不同也是影响载体构建的重要因素。为了分析从苹果属分离出来的MhSERK4基因的生物学功能,通过DNA测序和序列酶切位点分析,以XbaI和SmaI限制性内切酶双酶切带有目的基因全长片段的克隆载体和pBI121植物表达载体,经1%琼脂糖凝胶电泳分析回收后,成功构建了MhSERK4和MhdSERK4植物遗传转化载体,目前正在进行转基因的研究。
参考文献:
[1] Zhang X R, Choi J H, Heinz Josephine,et al.Domain-speci fi c positive selection contributes to the evolution ofArabidopsisleucine-rich repeat receptor-like kinase (LRRRLK) genes[J].J Mol Evol, 2006, 63: 612-621.
[2] Schmidt E D, Guzzo F, Toonen M A J,et al.A leucine-rich repeat containing receptor-like kinase marks somatic plant cell competent to form embryos[J].Development, 1997,124(10):2049-2062.
[3] Hecht V, Calzada J P V, Hartog M V,et al.The Arabidopsis somatic embryogenesis receptor kinase 1 gene is expressed in developing ovules and embryos and enhances embryogenic competence in culture[J].Plant Physiol, 2001,127(3):803-816.
[4] Baudino S, Hansen S, Brettschneider R,et al.Molecular characterization of two novel maize LRR receptor-like kinases,which belong to the SERK gene family [J].Planta, 2001, 213(1):1-10.
[5] Nolan K E, Irwanto R R, Rose R J.Auxin up-regulates MtSERK1 expression in both Medicago teuncatula root-forming and embryogenic cultures [J].Plant Physiol, 2003, 33:218-230
[6] Thomas C, Meyer D, Himber C,et al.Spatial expression of a sun fl ower SERK gene during induction of somatic embryogenesis and shoot organogenesis [J].Plant Physiol Biochem, 2004, 42:35-42.
[7] Somleva M N, Schmidt E D L, de Vries S C.Embryogenic cells inDactylis glomerataL (Poaceae) explants identified by cell tracking and by SERK expression[J].Plant Cell Rep, 2000,19(1): 718-726.
[8] Santos M D O, Romano E, Yotoko K S C,et al.Characterisation of the cacao somatic embryogenesis receptor-like kinase (SERK)gene expressed during somatic embryogenesis[J].Plant Sci,2005, 168(3):723-729.
[9] Shimada T, Hirabayashi T, Endo T,et al.Isolation and characterization of the somatic embryogenesis receptor-like kinase gene homologue (CitSERK1) fromCitrus unshiu[J].Marc Sci Hortic, 2005, 103:233-238.
[10] Albertini E, Marconi G, Reale L,et al.SERK and APOSTART candidate genes for apomixis inPoa pratensis[J].Plant Physiol,2005, 138:2185-99.
[11] Santos MDO, Romano E, Yotoko KSC,et al.Characterisation of the cacao somatic embryogenesis receptor-like kinase (SERK)gene expressed during somatic embryogenesis[J].Plant Sci,2005, 168(3): 723-729.
[12] 张 莉,苏曼琳.植物抗旱基因HDCS1的克隆和表达载体的构建[J].中南林业科技大学学报,2012,32(6):115-117.
[13] 徐刚标,申响保,鲍时来,等.LTP4基因超表达载体的构建及其遗传转化[J].中南林业科技大学学报,2011,31(3):21-25.
