杜仲MEP途径系列基因的基因结构预测
2013-04-03刘慧敏乌云塔娜杜红岩
刘慧敏,乌云塔娜,杜红岩
(1.中南林业科技大学a.经济林育种与栽培国家林业局重点实验室;b.林学院,湖南 长沙 410004;2.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003;3.国家林业局 杜仲工程技术研究中心,河南 郑州 450003)
杜仲又名丝连皮、扯丝皮、丝棉皮、玉丝皮、思仲等,属落叶乔木。杜仲是我国特有树种,经济价值很高,被确定为国家二级珍贵保护树种,也是世界上适应范围最广的重要胶原植物,中国是现存杜仲的唯一原产地[1-4]。千百年来,杜仲以去皮入药而著称,为中药上品。近20年来,随着杜仲胶特殊性能的不断发现,杜仲资源在全国各地区迅速发展[5]。杜仲胶是普通天然橡胶(三叶橡胶)的同分异构体,其化学结构为反式-聚异戊二烯(C5H8)n,是一种特殊的天然高分子材料[6]。杜仲胶具有低温可塑、形状记忆、投雷达波、耐磨、耐腐蚀、减震、隔音等特性,并将与相关材料的共混、集成、改性等多功能集于一身,其产业前景十分广阔[2,7-9]。
2-甲基-D-赤藓醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate,MEP)途径是植物萜类生物合成上游重要的调控路径之一。萜类在植物的多种生命活动如光合与呼吸代谢、激素调节、生长发育调节、细胞信号转导、植物通讯及与环境互作等过程中都发挥着重要作用[10-13]。
内含子(intron)为真核细胞基因DNA中的间插序列,这些序列被转录成RNA,但随即被剪辑除去而不翻译。大约80%~85%的高等植物含有内含子,不同基因的内含子数目各异。长期以来,人们普遍认为内含子没有功能作用,随着分子生物技术的发展,人们发现内含子在基因表达调控中有很重要的作用,内含子会影响基因表达模式,可以增强基因表达水平,还能驱动基因表达[14]。随着对内含子功能认识的逐步深入,内含子将会成为精确地调控目的基因表达的有力工具,在基因工程领域发挥更大的作用[15]。
1 材料与方法
1.1 数据资料
本研究采用的数据全部来自杜仲胶合成时期转录组数据和杜仲基因组测序数据。
1.2 分析方法
用在线软件GSDS(http://gsds.cbi.pku.edu.cn/index.php),分析MEP途径系列基因的内含子和外显子[16]。
2 结果与分析
2.1 杜仲MEP途径EuDXS基因内含子和外显子预测
将转录组数据1-脱氧-D-木酮糖-5-磷酸合成酶基因(EuDXS2)的全长cDNA和EuDXS2的基因组数据提交到在线软件GSDS中,绘制出EuDXS2基因结构示意图,如图1所示。分析发现,EuDXS2基因5′端非编码区的长度为1 853 bp,3′端非编码区的长度为2 000 bp,包含9个内含子和10个外显子,内含子的相位有7处为“0”,2处为“1”,无“2”相位(见图1,表1)。
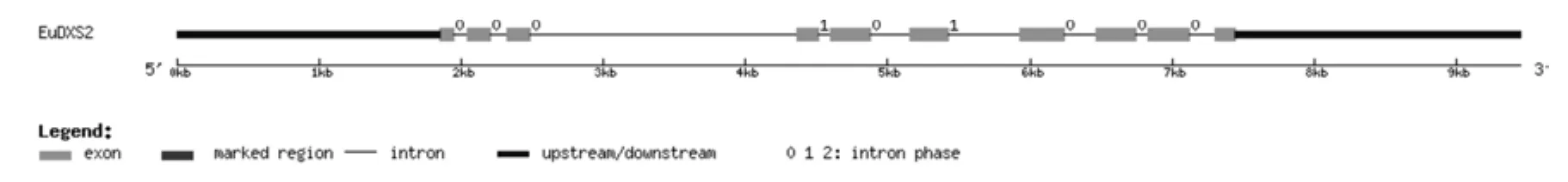
图1 EuDXS2基因内含子和外显子的分布Fig.1 Distribution of the introns and exons in EuDXS2
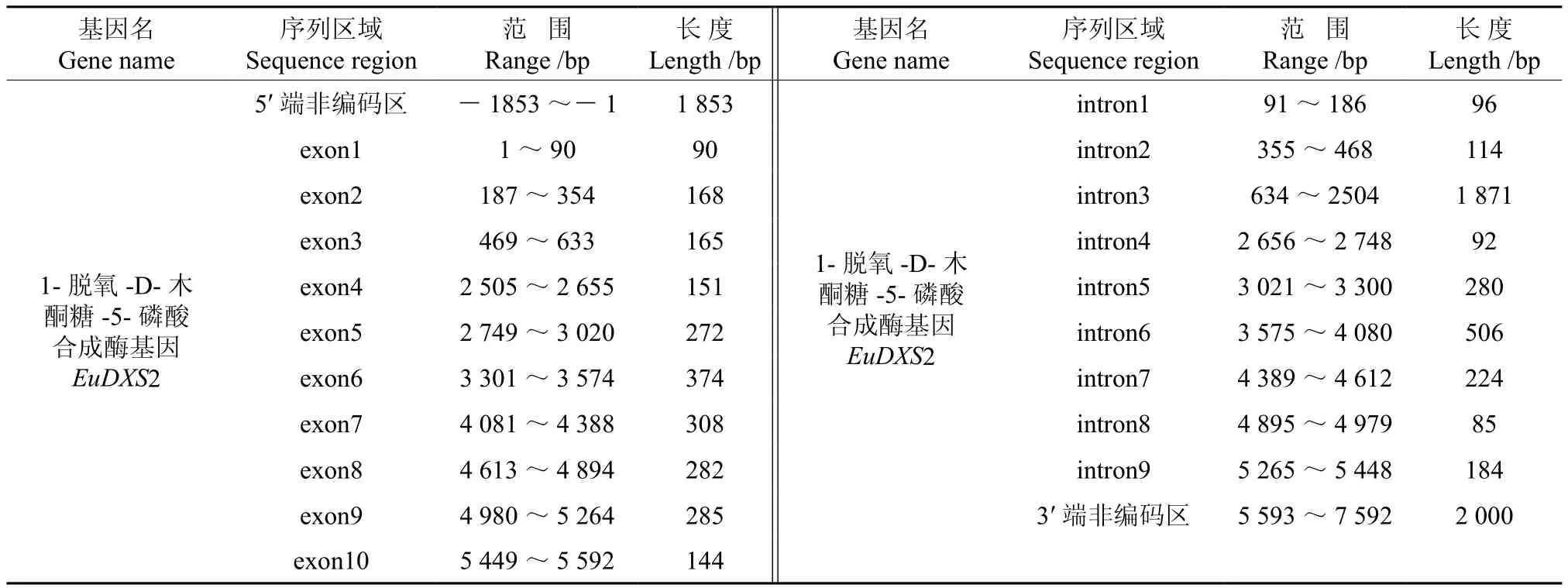
表1 EuDXS2基因内含子和外显子的分布Table 1 Distribution of the introns and exons in EuDXS2
2.2 杜仲MEP途径EuDXR基因内含子和外显子预测
将转录组数据1-脱氧-D-木酮糖-5-磷酸还原异构酶基因(EuDXR)的全长cDNA和EuDXR的基因组数据提交到在线软件GSDS中,绘制出EuDXR基因结构示意图(见图2)。分析发现,EuDXR基因5′端非编码区的长度为1 120 bp,3′端非编码区的长度为2 163 bp,包含11个内含子和12个外显子,内含子的相位有7处为“0”,1处为“1”,2处为“2” (见图2,表2)。
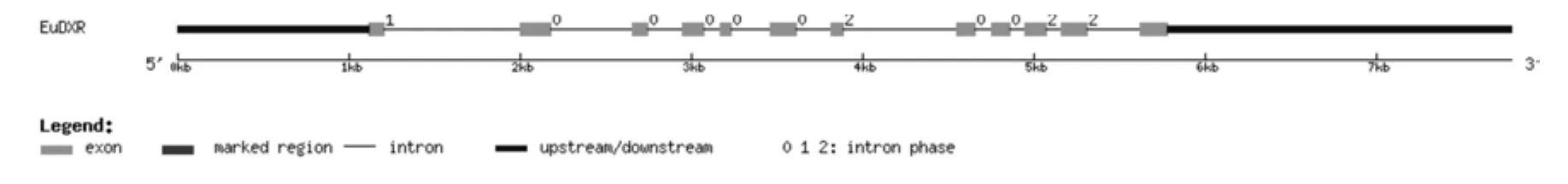
图2 EuDXR基因内含子和外显子的分布Fig.2 Distribution of the introns and exons in EuDXR
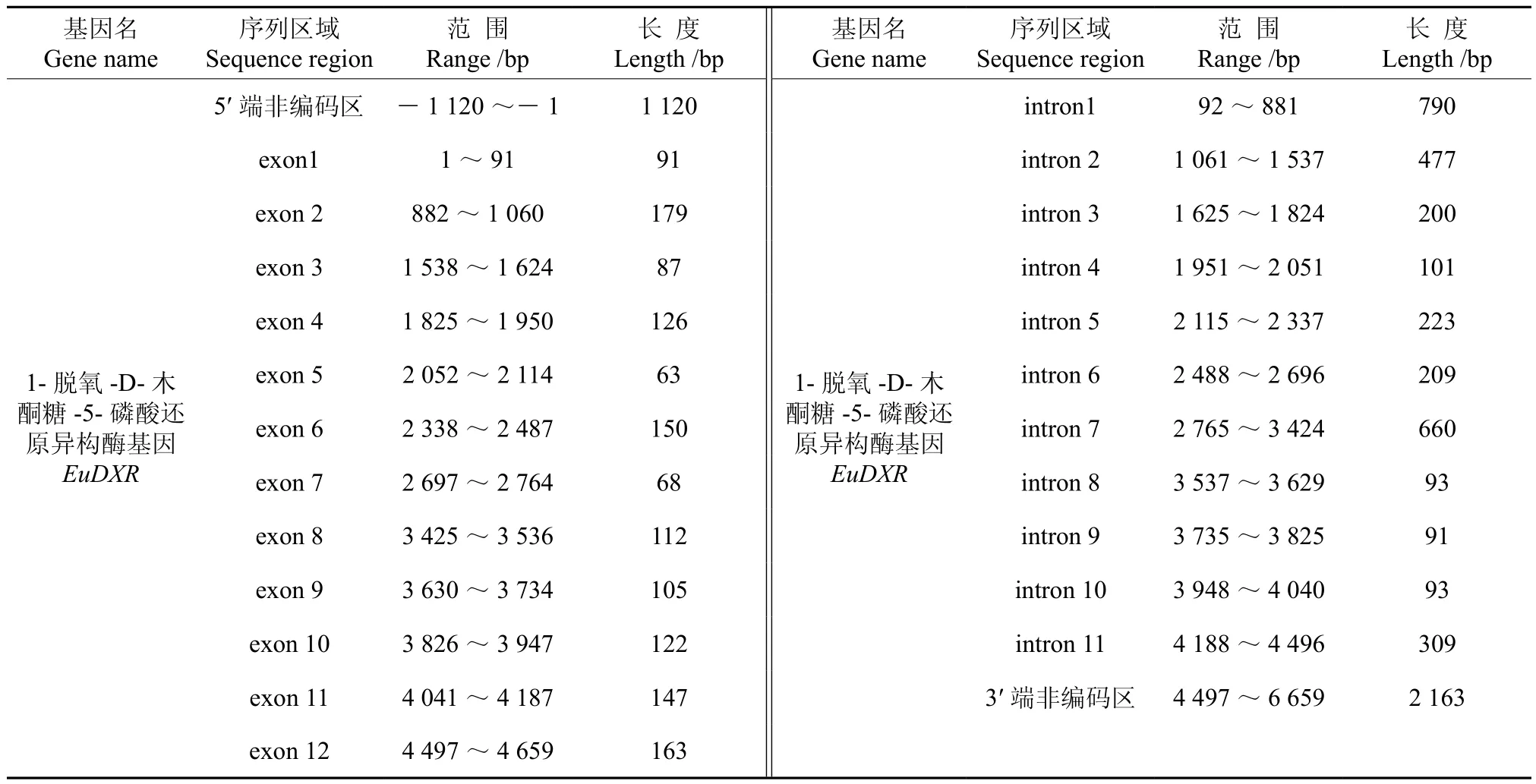
表2 EuDXR基因内含子和外显子的分布Table 2 Distribution of the introns and exons in EuDXR
2.3 4-杜仲MEP途径EuCMK基因内含子和外显子预测
将杜仲转录组数据中4-(5′-焦磷酸胞苷)-2-C-甲基-D-赤藓醇激酶基因(EuCMK)基因的全长cDNA和基因组序列中EuCMK的序列提交到在线软件GSDS中,绘制出EuCMK基因结构示意图(见图3)。分析发现,EuCMK基因5′端非编码区的长度为5 000 bp,3′端非编码区的长度为424 bp,包含10个内含子和11个外显子,内含子的相位有7处为“0”,2处为“1”,1处为“2”(见图3,表3)。

图3 EuCMK基因内含子和外显子的分布Fig.3 Distribution of the introns and exons in EuCMK
2.4 杜仲MEP途径EuMDS基因内含子和外显子预测及分析
将转录组数据2-甲基-D-赤藓醇-2,4-环焦磷酸合酶基因(EuMDS)的全长cDNA和EuMDS的基因组数据提交到在线软件GSDS中,绘制出EuMDS基因结构示意图(见图4)。分析发现,EuMDS基因5′端非编码区的长度为5 000 bp,3′端非编码区的长度为5 000 bp,包含2个内含子和3个外显子,内含子的相位有1处为“0”,1处为“1”(见图4,表4)。

表3 EuCMK基因内含子和外显子的分布Table 3 Distribution of the introns and exons in EuCMK
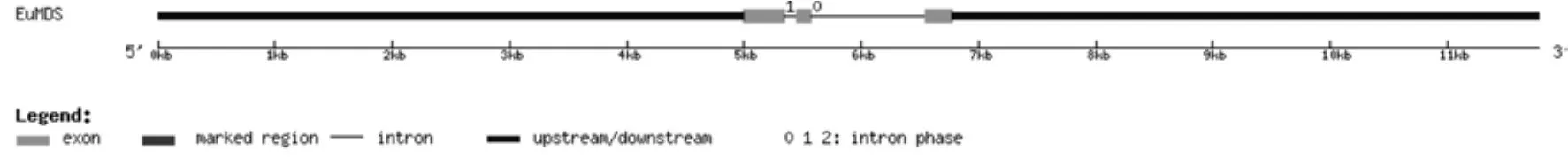
图4 EuMDS基因内含子和外显子的分布Fig.4 Distribution of the introns and exons in EuMDS
表4 EuMDS基因内含子和外显子的分布Table 4 Distribution of the introns and exons in EuMDS
2.5 杜仲MEP途径EuHDS基因内含子和外显子预测及分析
将转录组数据1-羟基-2-甲基-2-E-丁烯基-4-焦磷酸合酶基因(EuHDS)的全长cDNA和EuHDS的基因组数据提交到在线软件GSDS中,绘制出EuHDS基因结构示意图(见图5)。分析发现,EuHDS基因5′端非编码区的长度为2 000 bp,3′端非编码区的长度为2 000 bp,包含18个内含子和19个外显子,内含子的相位有12处为“0”,3处为“1”,3处为“2”(见图5,表5)。
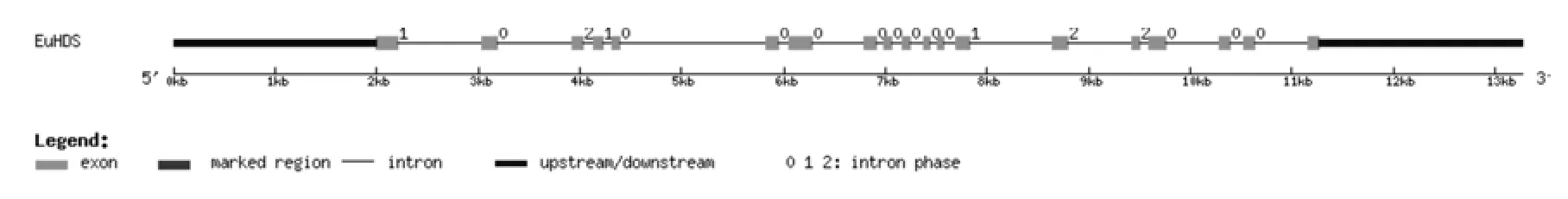
图5 EuHDS基因内含子和外显子的分布Fig.5 Distribution of the introns and exons in EuHDS
2.6 杜仲MEP途径EuHDR基因内含子和外显子预测及分析
将转录组数据1-羟基-2-甲基-2-E-丁烯基-4-焦磷酸还原酶基因(EuHDR)的全长cDNA和EuHDR的基因组数据提交到在线软件GSDS中,绘制出EuHDR基因结构示意图(见图6)。分析发现,EuHDR基因5′端非编码区的长度为1 347 bp,3′端非编码区的长度为3 000 bp,包含8个内含子和9个外显子,内含子的相位有5处为“0”,3处为“2”(见图6,表6)。
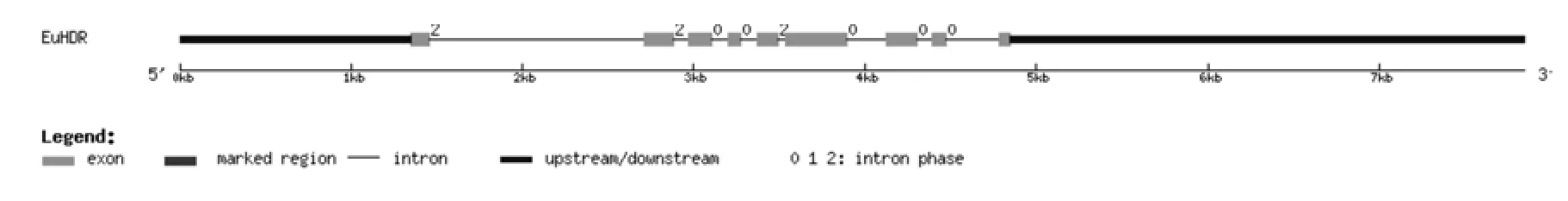
图6 EuHDR基因内含子和外显子的分布Fig.6 Distribution of the introns and exons in EuHDR
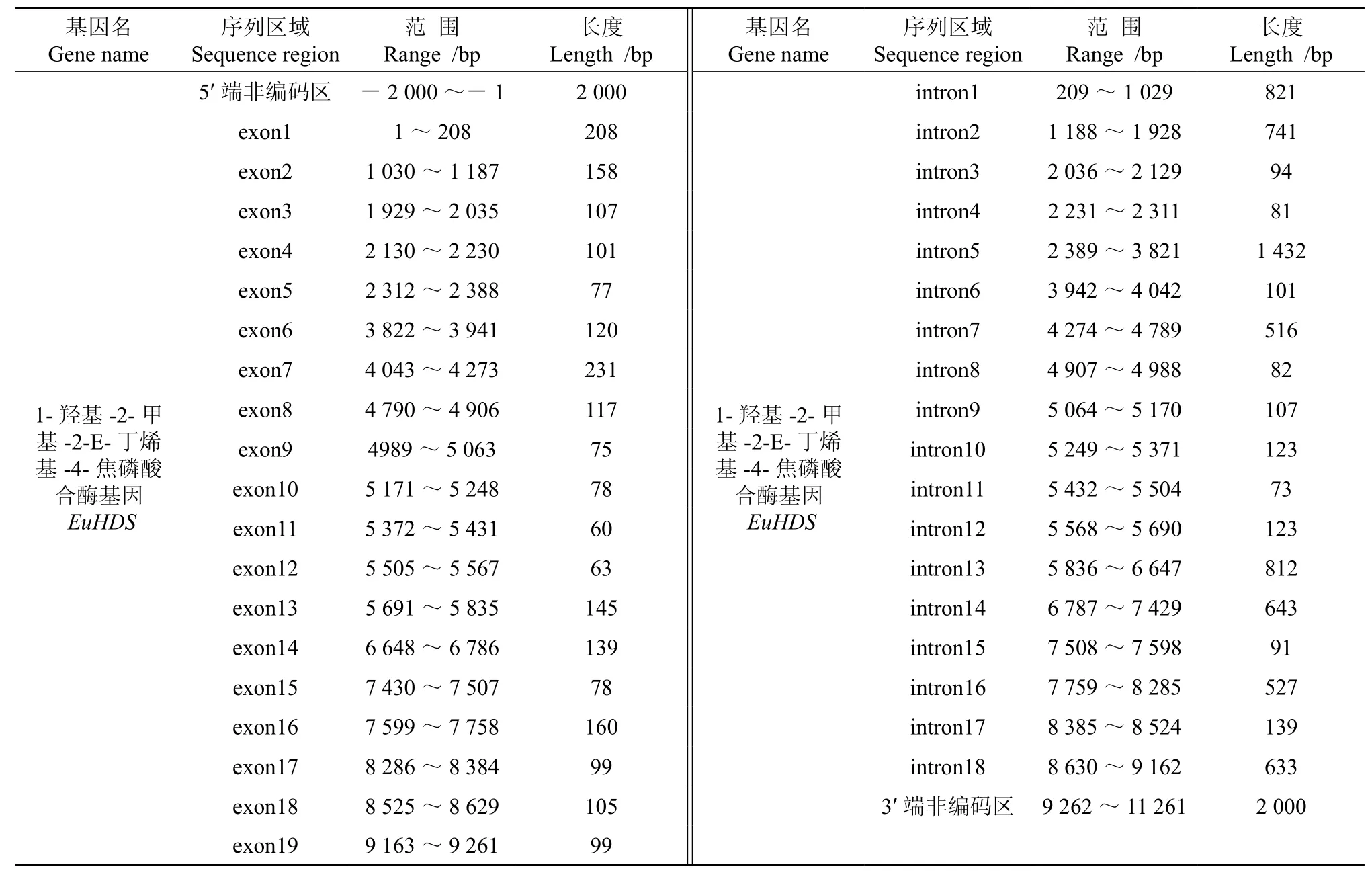
表5 EuHDS基因内含子和外显子的分布Table 5 Distribution of the introns and exons in EuHDS

表6 EuHDR基因内含子和外显子分布表Table 6 Distribution of the introns and exons in EuHDR
3 结论与讨论
以杜仲转录组和基因组数据为基础,预测了杜仲MEP途径6条酶基因的基因结构。EuDXS是MEP途径的第1个限速酶,EuDXS2基因5′端非编码区的长度为1 853 bp,3′端非编码区的长度为2 000 bp,包含9个内含子和10个外显子,内含子的相位有7处为“0”,2处为“1”,无“2”相位;EuDXR是MEP途径的第2个关键酶,EuDXR基因5′端非编码区的长度为1 120 bp,3′端非编码区的长度为2 163 bp,包含11个内含子和12个外显子,内含子的相位有7处为“0”,1处 为“1”,2处 为“2”;EuCMK催化MEP途径的羧基磷酸化反应,EuCMK基因5′端非编码区的长度为5 000 bp,3′端非编码区的长度为424 bp,包含10个内含子和11个外显子,内含子的相位有7处为“0”,2处为“1”,1处为“2”;EuMDS催化MEP途径的第5步酶促反应,EuMDS基因5′端非编码区的长度为5 000 bp,3′端非编码区的长度为5 000 bp,包含2个内含子和3个外显子,内含子的相位有1处为“0”,1处为“1”;EuHDS为MEP途径的第6个作用酶,EuHDS基因5′端非编码区的长度为2 000 bp,3′端非编码区的长度为2 000 bp,包含18个内含子和19个外显子,内含子的相位有12处为“0”,3处为“1”,3处为“2”;EuHDR是MEP途径的第3个关键酶,EuHDR基因5′端非编码区的长度为1 347 bp,3′端非编码区的长度为3 000 bp,包含8个内含子和9个外显子,内含子的相位有5处为“0”,3处为“2”。此次结果为预测数据,基因的具体结构还需要在理论的指导下通过试验验证。
目前,国内有关植物MEP途径酶基因的内含子生物信息学分析尚处于空白阶段,大都停留在转录组水平。2012年刘攀峰[17]分离鉴定了杜仲MEP途径系列基因的全长cDNA,并对其序列特征进行了研究, 在杜仲中发现2个DXS酶基因家族成员,EuDXS1和EuDXS2,2个DXR酶基因家族成员,EuDXR1和EuDXR2,分离出1个MCT酶基因,1个CMK酶基因,1个MDS酶基因,1个HDS酶基因,1个HDR酶基因和1个IPI基因。
2012年张祖荣[18]等人克隆获得了黄花蒿MEP途径的关键酶HDS,并进行生物信息学分析和功能互补分析研究,得到1条长2 324 bp的HDScDNA序列,生物信息学分析结果显示,黄花蒿HDS基因与其它种子植物来源的HDS高度同源。
参考文献:
[1] 杜红岩,刘昌勇,李 钦,等.杜仲叶中3种主要活性成分含量的季节变化[J].中南林业科技大学学报,2011,31(8):6-7.
[2] 杜红岩.我国的杜仲胶资源及其开发潜力与产业发展思路[J].经济林研究,2010,28(3):1-2.
[3] 叶生晶,乌云塔娜,田大伦,等.杜仲MVA途径相关酶基因的鉴定及荧光定量PCR引物筛选[J].中南林业科技大学学报,2013, 33(8):50-51.
[4] 李铁柱,杜红岩,刘慧敏,等.杜仲果实和叶片转录组数据组装及基因功能注释[J].中南林业科技大学学报,2012, 32(11):122-123.
[5] 王 征,金晓玲,刘雪梅,等.杜仲成熟胚器官发生途径的研究[J].中南林业科技大学学报,2013,33(6):79-80.
[6] 杜红岩,谢碧霞,邵松梅.杜仲胶的研究进展与发展前景[J].中南林学院学报,2003,23(4):95-96.
[7] 严瑞芳.杜仲胶研究进展及发展前景[J].化学进展,1995,(1):65-71.
[8] 杜红岩,胡文臻,俞 锐.杜仲产业绿皮书:中国杜仲橡胶资源与产业发展报告[M].北京:社会科学文献出版社, 2013:1-5.
[9] 薛 萍.杜仲研究现状与发展前景[J].经济林研究,1995,13(3): 56-57.
[10] Bohlmann J, Meyer-Gauen G, Croteau R.Plant Terpenoid synthases: Molecular Biology and Phylogenetic Analysis[J].Proc Nati Acad sci,1998,95:4126-4133.
[11] Bohlmann J, Keeling C.Terpenoid Biomaterials[J].Plant J,2008,54:656-669.
[12] Cheng AX, Lou YG, Mao YB,et al.Plant Terpenoids:Biosynthesis and Ecological Functions[J].J Integr Plant Biol,2007,49(2):179-186.
[13] Buchanan BB, Gruissem W, Russell LJ,et al.Biochemistry and Molecular Biology of Plants[M].Rockville: Am Soc of Plant Physiologists, 2000:1250-1318.
[14] 谢先芝,吴乃虎.高等植物基因的内含子[J].科学通报,2002,47(10):731-732.
[15] 陈 兵,文建凡.内含子在生物信息学研究和基因工程中的应用[J].生命的化学,2010,30(1):59-62.
[16] 丛 郁,杨顺瑛,宋志忠,等.葡萄AMT基因家族生物信息学分析[J].中国农学通报,2011,27(25):193-199.
[17] 刘攀峰.杜仲MEP途径系列基因全长cDNA分离鉴定及序列特征研究[D].北京:中国林业科学研究院,2012.
[18] 张祖荣,廖志华,彭梅芳.黄花蒿HDS基因的克隆与功能分析[J].中草药,2012,43(1):148-149.
