阿德福韦酯治疗失败的慢性乙型肝炎患者HBV反转录酶区新变异rtN236V的表型耐药特点分析
2013-04-01王晓刘妍思兰兰陈丽白文林刘立明王嫣许智慧戴久增姚增涛徐东平
王晓,刘妍,思兰兰,陈丽,白文林,刘立明,王嫣,许智慧,戴久增,姚增涛,徐东平
核苷(酸)类似物是目前临床慢性乙型肝炎抗病毒治疗的主要药物,可有效抑制病毒复制,改善肝功能,延缓肝脏疾病的进展,但其作用常因长期服药引发的耐药问题而部分甚至全部抵消[1-2]。阿德福韦酯(ADV)是继拉米夫定(LAM)之后第二种应用于临床的抗病毒药物,短期内可有效抑制野生株和LAM耐药株的复制,但长期服用易产生耐药,其5年耐药率可达29%[3]。经典的ADV耐药突变形式为rtA181V和rtN236T,关于rtN236位点的其他变异目前尚未见国内外文献报道。本研究采用克隆测序方法对1例ADV治疗失败患者血清病毒池中的HBV反转录酶(RT)区基因变异进行鉴定,在rtN236位点检出了新变异形式rtN236V,并对其表型耐药特点进行分析,以期丰富临床对ADV耐药变异的认识,并为临床及时调整治疗方案提供依据。
1 材料与方法
1.1 主要试剂 病毒DNA提取试剂盒购自北京天恩泽公司;XhoⅠ、SphⅠ内切酶和T4DNA连接酶购自大连宝生物公司;pGEM-Teasy载体购自美国Promega公司;pTriEx-HBV 1.1倍载体由法国里昂大学Zoulim教授惠赠;FuGENE HD转染试剂购自美国Roche公司;DMEM细胞培养基购自Gibco公司;荧光定量PCR检测试剂盒购自上海复星公司。克隆测序由北京天一辉远公司完成。
1.2 研究对象 解放军302医院2010年1月收治的1例48岁男性慢性乙型肝炎患者,HBsAg、HBeAg、HBcAb阳性,无重叠或混合感染。诊断标准按2000年9月(西安)全国会议修订的《病毒性肝炎防治方案》[4]执行,常规检测项目由本院临检中心完成。该患者于2008年10月首次接受ADV抗病毒治疗,15个月后出现病毒学突破和生化学突破,血清HBV DNA载量由阴性上升为2.41×105U/ml,ALT由29U/L上升为66U/L。
1.3 方法
1.3.1 HBV RT区基因突变及基因型分析 取冻存于-20℃的患者血清,提取HBV DNA,采用巢式PCR方法扩增HBV RT基因[5]。对PCR产物进行DNA双向测序,对rt173、rt180、rt181、rt184、rt202、rt204、rt236和rt250位的经典LAM、ADV、恩替卡韦(ETV)相关耐药位点进行分析[6]。胶回收纯化上述PCR产物,与pGEM-Teasy载体连接,转化JM109感受态细胞,挑选34个菌落PCR鉴定阳性的样品送测序并分析耐药突变。按文献[7]中的方法进行HBV基因分型。
1.3.2 pTriEx-HBV 1.1倍重组载体构建及鉴定 提取含rtN236V、rtN236T和rtA181V+N236V突变形式的质粒及野生型质粒,经XhoⅠ/SphⅠ双酶切后连接至经同样酶切后的pTriEx-HBV 1.1载体,连接产物转化JM109感受态细胞,接种至LB固态琼脂板(含100μg/ml氨苄西林),37℃温箱培养过夜。随机挑取克隆测序,对重组质粒进行鉴定,制备转染阳性质粒备用。
1.3.3 细胞转染及表型耐药分析 分别提取野生病毒株和突变株重组载体质粒,用FuGENE HD转染试剂按每孔0.25μg质粒转染入人肝癌细胞系HepG2细胞中,转染4h后分别加入不同浓度的LAM(0、0.01、0.1、1、10、100μmol/L),ADV(0、0.033、0.1、0.33、1、3.3μmol/L),ETV(0、0.001、0.01、0.1、1、10μmol/L)和替诺福韦(TDF)(0、0.01、0.1、1、10、100μmol/L),隔天换液,换液2次后即转染第4天收集细胞培养上清,采用实时荧光定量PCR法检测上清中HBV DNA含量(反映病毒复制力),计算药物半数有效剂量IC50及耐药倍数(突变株与野生株IC50的比值)。
2 结 果
2.1 HBV RT区基因突变检测及基因分型结果 测序分析显示该患者HBV RT区耐药突变为rtN236V/T共存,在34个阳性克隆中,20个(58.8%)为rtN236V变异株,11个(32.4%)为rtN236T变异株,2个(5.9%)为野生株,1个(2.9%)为rtA181V+N236V变异株。分型结果显示该患者为C2基因亚型HBV感染。
2.2 pTriEx-HBV 1.1倍重组载体的构建及鉴定 如图1所示,电泳结果显示2个条带,即约7000bp的载体片段和1000bp的HBV RT区片段,测序进一步证实载体构建成功。
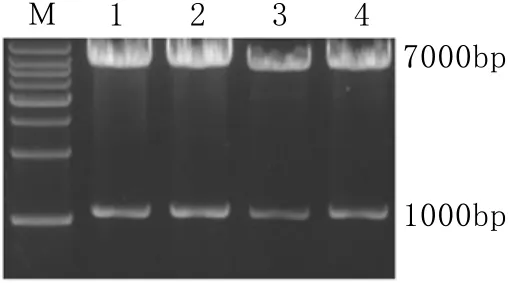
图1 4种重组载体的XhoⅠ/SphⅠ双酶切鉴定Fig.1 Identification of four recombinant plasmids by XhoⅠ/SphⅠ dual-enzyme digestionM. Marker (1kb); 1. rtWT; 2. rtN236T; 3. rtN236V; 4. rtA181V+N236V
2.3 变异HBV复制力测定 实时荧光定量PCR法检测结果显示,野生株病毒复制力为(4.00±2.36)×107U/ml,rtN236T、rtN236V和rtA181V+N236V变异株的病毒复制力均有所降低,分别为野生株的89.43%、83.60%和75.44%。
2.4 表型耐药结果分析 与野生株比较,rtN236T、rtN236V、rtA181V+N236V变异株对LAM、ETV、TDF三种药物均敏感,而对ADV显示出不同水平耐药性。rtN236T株对ADV敏感性降低,其耐药倍数(变异株EC50/野生株EC50)是野生株的4.75倍;rtA181V+N236V株的耐药倍数为野生株的5.10倍;rtN236V株对ADV的敏感性介于rtN236T和野生株之间,其耐药倍数为野生株的3.10倍(表1)。

表1 HBV各变异株及野生株对4种药物的敏感性Tab.1 Susceptibility of wild-type and mutant HBV to LAM, ADV, ETV and TDF in vitro
3 讨 论
核苷(酸)类似物是当前临床抗HBV治疗最常用的药物,其抗病毒作用靶位是HBV RT区,而对病毒复制初始模板细胞核内的cccDNA没有直接抑制作用,因此需要长期用药才可达到持久抑制病毒的目的[8]。HBV是高变异的DNA病毒,可在长期药物和机体免疫压力下发生适应性变异,或因预存的极少量变异株获得选择性扩增,使耐药病毒逐渐成为优势种群,最终导致耐药,而随后的病毒学和生化学突破又加速了肝病的进展,严重者甚至可引起肝衰竭[9]。ADV是继LAM之后第二种应用于临床的核苷酸类药物,因其可在短期内有效抑制野生病毒及LAM耐药病毒的复制而在临床广泛使用,但长期使用仍可引发耐药。初治患者ADV的5年耐药率为29%,针对LAM耐药患者长期单药ADV治疗后ADV耐药率明显增加,4年累积可达43%[2,10-12]。
本例研究对象为2010年1月解放军302医院收治的48岁男性慢性乙型肝炎患者,服用ADV 15个月后出现病毒学突破,血清HBV DNA载量由阴性上升为2.41×105U/ml,ALT由29U/L上升为66U/L,克隆测序显示病毒准种池中含有大量rtN236V变异株,同时伴有rtN236T、rtA181V+N236V及野生株。已知rtA181V和rtN236T是经典的ADV耐药变异形式[3],而目前国内外未见有关rtN236位点其他变异的文献报道,为鉴定新的rtN236V变异是否与ADV耐药相关,我们进一步分析了rtN236V变异株的体外病毒复制力及表型耐药特点。
体外实验结果显示,与野生株相比,rtN236V、rtN236T、rtA181V+N236V变异株的复制力均有不同程度下降。表型耐药结果显示rtN236T、rtA181V+N236V和rtN236V变异株的EC50分别是野生株的4.75、5.10倍和3.10倍。临床通常将抗病毒药物的耐药分为3个级别:耐药倍数2~9倍为低水平耐药,10~99倍为中等水平耐药,大于100倍为强耐药。但是这一划分范围在体外表型耐药实验中也存在例外,体外实验中ADV敏感性小幅度的增长(2~9倍)即可导致耐药[13]。该患者病毒池中大量存在的rtN236V变异株虽然单独对ADV耐药的贡献较小(3.10倍),但与经典的rtA181V和rtN236T变异株共同存在时,会协同增加变异株对ADV的耐药性(5.10倍),最终导致患者对ADV耐药,进而出现后续的病毒学和生化学突破。
新的耐药变异形式鉴定一般要满足以下几个过程:首先在临床病例中发现与药物应用相关的变异;其次体外实验证实突变株的病毒适应力;然后表型耐药实验分析突变株对抗病毒药物的耐药倍数;最后通过长期大样本的临床观察得出最终结论[14-15]。总之,本研究从1例ADV治疗失败的慢性乙型肝炎患者病毒池中鉴定的与rtN236T和rtA181V共同存在的rtN236V变异,可能是一个新的ADV耐药变异形式。核苷酸类药物治疗过程中及时监测耐药基因变异,对于及时调整临床治疗方案、提高抗病毒疗效具有重要意义。
[1] Zoulim F. Are novel combination therapies needed for chronic hepatitis B[J]? Antiviral Res, 2012, 96(2)∶ 256-259.
[2] Chen CW, Chen CX, Chen SJ. Drug resistance and administration of nucleoside(s) on the treatment of chronic hepatitis B[J]. Chin J Pract Intern Med, 2013, 33(1)∶ 82-91. [陈成伟, 陈从新, 陈士俊, 等. 核苷和核苷酸类药物治疗慢性乙型肝炎的耐药及其管理[J]. 中国实用内科杂志, 2013, 33(1)∶82-91.]
[3] Segovia MC, Chacra W, Gordon SC. Adefovir dipivoxil in chronic hepatitis B∶ history and current uses[J]. Expert Opin Pharmacother, 2012, 13(2)∶ 245-254.
[4] The Chinese Society of Infectious Diseases and Parasitology,and the Chinese Society of Hepatology of the Chinese Medical Association. Viral hepatitis management scheme[J]. Chin J Hepatol, 2000, 8(6)∶ 324-329. [中华医学会传染病与寄生虫学分会、肝病学分会. 病毒性肝炎防治方案[J]. 中华肝脏病杂志, 2000, 8(6)∶ 324-329.]
[5] Xu DP, Liu Y, Cheng J, et al. Multiple-site analysis of HBV drugresistant mutations in 340 patients with chronic hepatitis B [J].Chin J Hepatol, 2008, 16(10)∶735-738. [徐东平, 刘妍, 成军,等. 340例慢性乙型肝炎患者乙型肝炎病毒多位点耐药相关突变分析[J]. 中华肝脏病杂志, 2008, 16(10)∶ 735-738.]
[6] Liu Y, Li QH, Li L, et al. Genotypic analysis of Entecavirresistant mutation of hepatitis B virus (HBV) in patients with chronic HBV infection[J]. Med J Chin PLA, 2010, 35(6)∶ 621-624. [刘妍, 李庆虹, 李乐, 等. 慢性HBV感染患者恩替卡韦基因型耐药突变特征分析[J]. 解放军医学杂志, 2010, 35(6)∶621-624.]
[7] Liu Y, Zhong Y, Zou Z, et al. Features and clinical implications of Hepatitis B virus genotypes and mutation in basal core promoter/precore region in 507 Chinese patients with acute and chronic hepatitis B[J]. J Clin Virol, 2010, 47(3)∶ 243-247.
[8] Xu L, Li DY, Wu XY, et al. The changes of the levels of IL-12 and IL-6 in serum of the patients with Chronic Hepatitis B treated with auto-dendritic cell and Adefovir Dipivoxil unionly and clinical significance[J]. Acta Acad Med CPAF, 2011, 20(3)∶ 193-198. [徐丽, 李冬严, 吴晓燕, 等. 自体树突状细胞联合阿德福韦酯治疗慢性乙型肝炎IL-12和IL-6的水平变化及临床效应[J]. 武警医学院学报, 2011, 20(3)∶ 193-198.
[9] Kim JW, Lee HS, Woo GH, et al. Fatal submassive hepatic necrosis associated with tyrosine-methionine- aspartateaspartate-motif mutation of hepatitis B virus after long-term lamivudine therapy[J]. Clin Infect Dis, 2001, 33(3)∶ 403-405.
[10] Peters MG, Hann HW, Martin P, et al. Adefovir dipivoxil alone or in combination with lamivudine in patients with lamivudineresistant chronic hepatitis B[J]. Gastroenterology, 2004, 126(1)∶91-101.
[11] Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, et al. Longterm therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B for up to 5 years[J]. Gastroenterology, 2006, 131(6)∶1743-1751.
[12] Chen CH, Wang JH, Lu SN, et al. Characteristics of adefovir resistance in patients with or without lamivudine-resistant hepatitis B virus treated with adefovir∶ a 4-year experience[J].Liver Int, 2011, 31(2)∶ 206-214.
[13] Lok AS, Zoulim F, Locarnini S, et al. Antiviral drug-resistant HBV∶ standardization of nomenclature and assays and recommendations for management[J]. Hepatology, 2007, 46(1)∶254-265.
[14] Xu DP, Liu Y. A novel insight of understanding of mechanism of hepatitis B virus drug resistance by combining genotype resistant mutation detection and phenotype resistance analysis[J]. Med J Chin PLA, 2012, 37(6)∶ 535-538. [徐东平, 刘妍. 结合基因型耐药突变检测与表型耐药分析探索乙肝病毒耐药的新认识[J]. 解放军医学杂志, 2012, 37(6)∶ 535-538.]
[15] Ji D, Liu Y, Li L, et al. The rtL229 substitutions in the reverse transcriptase region of hepatitis B virus (HBV) polymerase are potentially associated with lamivudine resistance as a compensatory mutation[J]. J Clin Virol, 2012, 54(1)∶ 66-72.
