(2R,4S)-4-甲基-2-哌啶甲酸乙酯的合成*
2013-03-26张伟萍史海健
刘 兵,杲 婷,张伟萍,史海健
(南京工业大学化学化工学院,江苏南京 210009)
阿加曲班【(2R,4R)-4-甲基-1-{N2-[(R,S)-3-甲基-1,2,3,4-四氢-8-喹啉磺酰基]-2-精氨酰基}-2-哌啶羧酸(Ⅰ,Chart 1)】是一种选择性的直接凝血酶抑制剂,并具有调节内皮细胞的功能、抑制血管收缩、下调各种导致炎症和血栓的细胞因子[1~3],可用于缺血性脑梗死急性期病人的抗凝治疗等。
Ⅰ由L-精氨酸衍生化而成,包含精氨酸(A),哌啶B),喹啉(C)的三脚架结构。其中的结构片段哌啶环衍生物的合成研究非常重要[5,6],尤其是羧基和甲基构型的构建对合成Ⅰ至关重要。目前,对单一构型的4-甲基-2-哌啶甲酸的合成主要集中在活性较强的两个中间体(4a和4b)及其衍生物的研究,并已成为国内外学者研究的重点和热点[7,8]。
本文以具有重要活性的Ⅰ的中间体(2R,4S)-4-甲基-2-哌啶甲酸乙酯(4a)为目标分子,设计了一条简短、易行的合成路线:首次以S-(-)-α-苯乙胺(1)为原料,3Å分子筛为除水剂,采用一锅法合成了 1-(1-苄基)-6-乙氧羰基-4-甲基-3,4-二氢哌啶(3),收率58.7%。以10%Pd/C为催化剂,对3进行催化氢化脱苄合成了4-甲基-2-哌啶甲酸乙酯(4,Scheme 1),收率96%;4通过减压分馏得 4a,含量 95%,d/e为 90%,其结构经1H NMR,IR和MS确证。
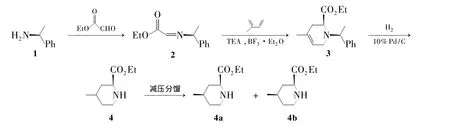
Scheme 1
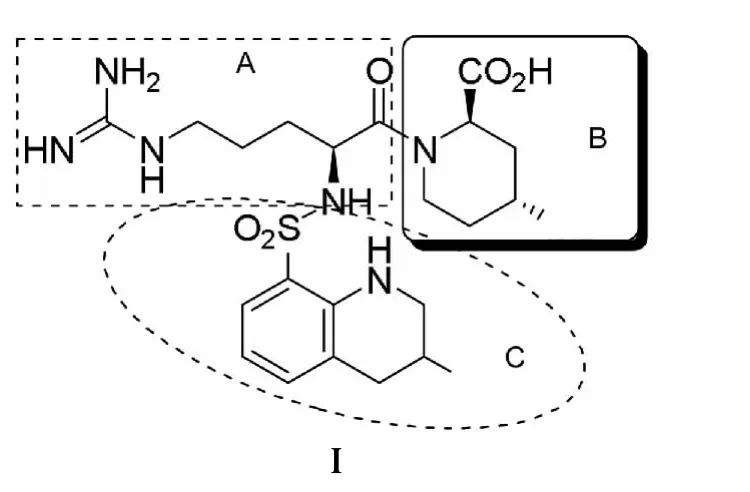
Chart 1
1 实验部分
1.1 仪器与试剂
X-4型显微熔点仪(温度未校正);Bruker MD 300(或500)MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet AVATAR-360型红外光谱仪(KBr压片);双聚焦 VG-ZAB-MS型质谱仪(70 eV)。
所用试剂均为分析纯,其中二氯甲烷用前经干燥除水。
1.2 合成
(1)3的合成
在三口烧瓶中加入乙醛酸乙酯6.6 g(63.6 mmol)和甲苯7.6 mL,搅拌下回流反应30 min。加入经活化的3Å分子筛14.8 g和二氯甲烷100 mL,于 0 ℃滴加 1 7.9 g(63.6 mmol),滴毕,于 0℃反应1 h(TLC监测)。加入异戊二烯8.8 g(127.2 mmol),于 -78℃ 依次滴加三氟醋酸(TEA)7.3 g(63.6 mmol)和三氟化硼乙醚 9.2 g(63.6 mmol),滴毕,于-78℃反应3 h。用饱和碳酸氢钠溶液调至 pH 7~8,用二氯甲烷(3×50 mL)萃取,合并有机相,用饱和食盐水洗涤,无水MgSO4干燥,减压蒸除溶剂后经快速硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=60∶1]纯化得白色固体 3 10.2 g,收率 58.7%,m.p.40℃ ~41℃,[α]- 2.6°(c1.0,CHCl3);1H NMR δ:7.18 ~ 7.35(m,5H),5.25(brs,1H),4.16(q,J=7.1 Hz,2H),4.04(dd,J=6.5 Hz,2.2 Hz,1H),3.96(q,J=6.7 Hz,1H),3.16 ~3.12(m,1H),2.93(d,J=16.5 Hz,1H),2.56 ~ 2.52(m,1H),2.32(d,J=16.9 Hz,1H),1.66(s,3H,CH3),1.34(d,J=6.7 Hz,3H,CH3),1.26(t,J=7.1 Hz,3H,CH3);IR ν:3 058,3 026(=CH),2 971,2 927,1 732(C=O),1 485,1 460(C=C),1 373(C -H),1 184,1 155(C -N),1 043,1 030,752,697 cm-1;MSm/z:274{[M+H]+,100%}。
(2)4的合成
在圆底瓶中加入3 50 mg(0.18 mmol)和乙酸乙酯10 mL,搅拌使其溶解;加入10%Pd/C 10 mg,于室温/101.4 kPa条件下加氢反应10 h。硅藻土助滤,滤饼用少量乙酸乙酯洗涤,合并滤液与洗液,减压除去溶剂得无色油状液体4 29 mg,收率96%,1H NMR验证4为trans/cis(13/87)的混合物。将其减压分馏(柱长40 cm,外温115℃),收集馏份1[(83℃ ~85℃)/0.933 kPa]和馏份2[(92 ℃ ~93 ℃)/0.933 kPa],经1H NMR 验证,馏份1中trans/cis=35/65,馏份2中trans/cis=5/95,即馏份2以4a为主。4a:[α]+14.0°(c5,EtOH);1H NMR δ:4.16(q,2H),3.29 ~3.27(m,1H),3.15 ~ 3.14(m,1H),2.62 ~2.60(m,1H),1.98 ~ 1.96(m,1H),1.87(s,1H),1.49 ~1.62(m,2H),1.27(t,3H),1.11 ~1.05(m,2H),0.95(d,J=6.6 Hz,3H);IR ν:2 959,2 927(C -H),2 846,1 735(C=O),1 456,1 380(变形 C -H),1 267,1 181(酯基C -O),1 127(C -N),1 098,1 024,793 cm-1;MSm/z172{[M+H]+,100%}。
2 结果与讨论
2.1 合成
采用两种方法合成3。按文献[9,10]方法分步由1合成2,再合成3;采用本文设计的一锅法直接由1合成3。两种方法的实验结果见表1。由表1可见,一锅法缩短了反应时间(由35 h缩短至3 h),提高了收率(由44%提高至58.7%),但反应温度则由室温降至-78℃。
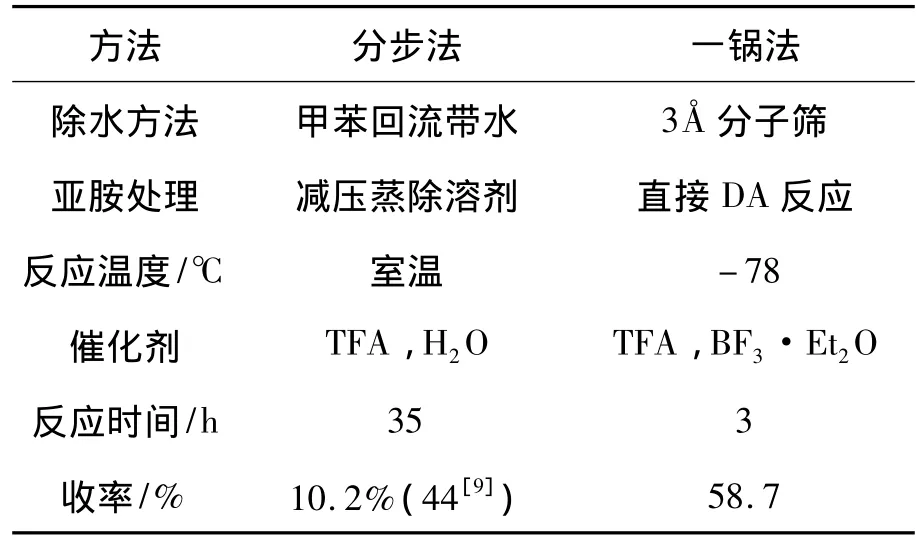
表1 两种方法的结果对比Table 1 Comparison of result of two methods
在合成4时,采用催化氢化反应,反应的立体化学为顺式加氢,所以主要得到顺式产物。通过1H NMR和IR分析可以看出,粗品4中,trans/cis=13/87。由于两个异构体的极性差异不大,经多次条件实验和工艺优化,选用了减压分馏的方法,可得到trans/cis=5/95(1H NMR分析),其[α]+14.0°(c=5,EtOH),而文献[16]值则为 +11.5°,由此可见分馏所得的的比旋光度较高,说明其中4a含量居多。当Ⅰ中4-甲基-2-哌啶甲酸的构型为(2R,4S)时,活性较高,其凝血酶抑制指数为 0.24 μM[11],仅次于 4b 的凝血酶抑制指数(0.019 μM)。
3 结论
(1)以S-(-)-α-苯乙胺为原料,3Å 分子筛为除水剂,一锅法合成了 1-(1-苄基)-6-乙氧羰基-4-甲基-3,4-二氢哌啶(3),简化了实验操作,收率由文献的44%提高至58.7%。
(2)以10%Pd-C为催化剂(用量为底物的20%),由 3 一步合成了 4-甲基-2-哌啶甲酸乙酯(4),trans/cis=13/87,收率96%。
(3)通过减压分馏的方法成功分离出了cis-4-甲基-2-哌啶甲酸乙酯,含量 95%;另外,经旋光度比较,其中主要异构体为(2R,4S)-4-甲基-2-哌啶甲酸乙酯。
该合成路线简短、经济、收率高。该方法易于放大生产。
[1]袁丽娟,刘爱民,刘蕾.新型凝血酶抑制剂阿加曲班[J].中国新药杂志,2005,14(2):230 -234.
[2]许俊堂.阿加曲班临床应用的进展[J].血栓与止血学,2007,12(4):180 -182.
[3]Kadouri P C,Comesse S.Recent advances in asymmetric synthesis of pipecolic acid and derivatives[J].Amino Acids,2005,29(2):101 -130.
[4]李振东,樊军,张宗伟.哌啶酸及其衍生物合成的研究进展[J].化学通报,2006,69:1 -7.
[5]Alegret C,Santacana F,Riera A.Enantioselective synthesis oftrans-4-methylpipecolic acid[J].J Org Chem,2007,72(20):7688 -7692.
[6]Shuman R T,Ornstein P L,Paschal J W,et al.An improved synthesis of homoproline and derivatives[J].J Org Chem,1990,55:738 -741.
[7]Cossy J,Belotti D.Direct diastereoselective synthesis of(± )-cis- and(± )-trans-4-methylpipecolic acid and derivatives[J].Tetrahedron Letters,2001,42:2119-2120.
[8]Cossy J,Belotti D.A short synthesis of argatroban:A potent selective thrombin inhibitor[J].Bioorganic &Medicinal Chemistry Letters,2001,11:1989 -1992.
[9]Bailey P D,Wilson R D,Brown G R.Enantio-and diastereo-selective synthesis of pipecolic acid derivatives using the Aza-Diels-Alder reaction of imines with dienes[J].J Chem Soc Perkin Trans 1,1991,62:1337 -1340.
[10]Bailey P D,Brown G R,Wilson R D.Asymmetric synthesis of pipecolic acid derivatives using the Aza-Diels-Alder reaction [J].Tetrahedron Asymmetry,1991,2(12):1263 -1282.
[11]Okamoto S,Kikumoto A H,Tonomura S,et al.Potent inhibition of thrombin by the newly synthesized arginine derivative No.805.The importance of stereostructure of its hydrophobic carboxamide portion[J].Biochemical and Biophysical Research Communications,1981,101(2):440 -446.
