苯甲酰氧基取代的2-吡喃酮的固相光二聚反应*
2013-03-26王卫东下茂徹朗
王卫东,下茂 徹朗
(1.吉林化工学院化工与材料工程学院,吉林长春 132022;2.鹿儿岛大学 工学部,日本 鹿儿岛 890-0065)
光化学接近于绿色化学范畴,在天然产物、医药、香料等精细有机合成中具有特别重要的意义[1]。2-吡喃酮是一类含有 α,β:γ,δ不饱和键的六元环内酯,广泛存在于很多天然产物中[2,3],其衍生物不仅具有重要的生理活性[4,5],而且还是非常重要的有机合成中间体[6]。由于共轭双键和酯基的存在,2-吡喃酮在光激发状态下不仅在溶液中,而且在固相都具有较强的光化学反应性。
我们曾报道过2-吡喃酮与顺丁烯二酰亚胺,2-吡喃酮与二苯酮类化合物异分子的固相[2+2]光化学环化加成反应[7~13]。本文报道在二苯甲酮的光敏化作用下,C4-位上苯甲酰氧基[或4-(4-甲氧基苯甲酰氧基]取代6-甲基-2-吡喃酮(1a或1b)的固相光二聚反应穿过1的C3-C4-位高选择性地发生[2+2]环加成获得1的分子间anti头-头二聚物(2a或2b)及其分解产物安息香酸(3)(Scheme 1),其结构经1H NMR,FI-IR,MS和元素分析表征。采用WINMOPAC PM5法通过计算分析对该反应的机理进行解释,并对二聚物的加成取向和立体构造进行了推定。
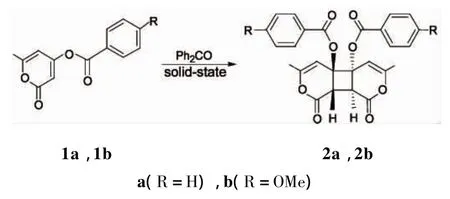
Scheme 1
1 实验部分
1.1 仪器与试剂
Yamagimoto型显微熔点仪(温度未经校正);JNM-GSX400 MHz型核磁共振仪(CDCl3为溶剂,TMS 为内标);IR-Report-100 型红外分光光度计(KBr压片);JEOLJMS-HX110A型质谱仪;Yanaco MT-5型元素分析仪。
4-苯甲酰氧基-6-甲基-2-吡喃酮(1a)和 4-(4-甲氧基苯甲酰氧基)-6-甲基-2-吡喃酮(1b)参照文献[13]方法合成;其余所用试剂均为化学纯。
1.2 2 的合成
将1a 260 mg(1.0 mmol)和二苯甲酮182 mg(1.0 mmol)用研钵研磨10 min使之呈细粉末状,平铺夹在两片Pyrex玻璃板间,室温和氮气保护下,用400 W高压水银灯照射5 h。经硅胶柱层析[洗脱剂:V(乙酸乙酯)∶V(正己烷)=1∶2]纯化后,用氯仿重结晶得2a。
用类似的方法合成2b。
2a:白色固体,m.p.215℃ ~217℃;1H NMR δ:2.04(s,3H,CH3),3.49(s,1H,CH),5.26(s,1H,=CH),7.49(t,J=8.0 Hz,4H,ArH),7.64(t,J=7.4 Hz,2H,ArH),8.04(d,J=7.6 Hz,4H,ArH);IR ν:1 781,1 709 cm-1;LR FABMSm/z:461(MH+);Anal.calcd for C26H20O8:C 67.82,H 4.39;found C 67.63,H 4.27。
2b:白色固体,m.p.285℃ ~287℃;1H NMR δ:2.03(s,3H,CH3),3.46(s,1H,CH),3.89(s,3H,OCH3),5.24(s,1H,=CH),6.95(d,J=8.8 Hz,4H,ArH),7.99(d,J=8.8 Hz,4H,ArH);IR ν:1 788,1 712 cm-1;LR FAB-MSm/z:521(MH+);Anal.calcd for C28H24O10:C 64.61,H 4.65;found C 64.34,H 4.58。
2 结果与讨论
2.1 光照射时间对合成2收率的影响
反应条件同1.2,考察光照射时间对2收率的影响,结果见表1。从表1可见,在二苯甲酮的光敏化作用下,1分子间的二聚反应属于快速光反应;光照2 h时,1a和1b的转化率分别达88%和74%。2的收率随光照时间的延长变化不大,这由于2随着光照时间的延长,发生了光分解反应生成3所致。

表1 固体状态下1的光敏化二聚反应*Table 1 Photosensitized[2+2]photocycloadditon reaction of 1 in the solid state
2.2 对比实验
为进一步探讨该体系光敏化二聚反应,本文分别考察了2 h光照射条件下1在溶液中的光敏化反应以及1单独固相和溶液中的单独反应,实验结果表明,在溶液1的光敏化反应中2的收率(<3%)较其固相光敏化反应(>23%)低得多;无敏化剂二苯甲酮的光照条件下,1无论是在固相还是在溶液中都不发生任何光化学反应。考察结果表明1只有在固体状态下才有利于光敏化二聚反应的快速进行。
2.3 2的配向、立体构造及反应机理
为了探索该反应的机理,以1a的反应为例,采用WINMOPAC PM5法计算跃迁状态(TS)的解析方法[12,14~17],推定加成二聚物的配向和立体构造,并对反应机理进行解释。
首先,1a的激发三重态1a*(1T)和基态1a(0S)之间的相对生成热(H.O.F.)为40.2 kcal·mol-1。在敏化剂的作用下,经历1a激发三重态后,反应配向选择性存在着形成头-头和头-尾激基缔合物两种可能。头-头(hh)结合时,两分子反应点距离为 γre(C1-C1)=2.2 Å,经历第一过渡态(TS1)形成头-头双自由基(BRhh)的TS1活化能为 7.8 kcal·mol-1(图 1)。头-尾(ht)结合时,两分子反应点距离为 γre(C1- C1)=2.15 Å,形成头-尾双自由基(BRht)的TS1活化能为13.0 kcal·mol-1(图2)。通过对比可推定该反应的路径为头-头加成反应过程。

图1 利用MOPAC PM5计算1a获得anti头-头二聚物(2a)的光二聚反应相对生成热(H.O.F.)Figure 1 Relative heat of formation(H.O.F.)of the photodimerization of 1a to give anti head-head dimer 2a)calculated by MOPAC PM5
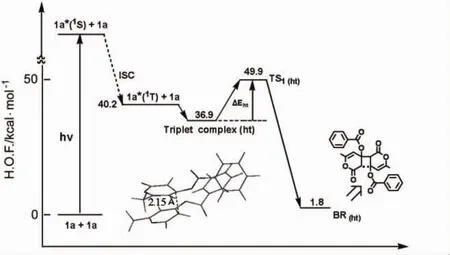
图2 利用MOPAC PM5计算1a头-尾获得二聚物的光二聚反应相对生成热(H.O.F)Figure 2 Relative heat of formation(H.O.F)of the photodimerization of 1a to give head-tail dimer calculated by MOPAC PM5
其次,双自由基BRhh经历第二过渡态(TS2)后,可能形成anti头-头和syn头-头两种类型加成产物。对比它们的TS2活化能可知,anti头-头加成(5.1 kcal·mol-1)比syn头-头加成(8.1 kcal·mol-1)低,因此可以推定该反应经历激基缔合物生成anti头-头[2+2]环加成二聚物2a。
此外,通过1H NMR和IR的谱图分析,对比香豆素[18~21]及 4-甲氧基-6-甲基-2-吡喃酮[22]的光二聚反应可知,该反应体系的目标产物亦可推定为anti头-头[2+2]环加成二聚物2a。
3 结论
本文对 C4-位苯甲酸基取代 6-甲基-2-吡喃酮的固相[2+2]光二聚反应进行了研究。反应机理可描述为在1的激发三重态与基态分子之间形成激基缔合物后,先后经历第一和第二过渡态,高配向选择性地生成anti-头-头[2+2]加成二聚物。
该反应具有反应条件温和、操作简单和对环境有好等优点。
[1]张宝文,程学新,刘勇勇,等.有机合成光化学及其研究现状[J].感光科学与光化学,2001,19(2):139-155.
[2]Li Y,Ye D,Chen X,et al.Breviane spiroditerpenoids from an extreme-tolerant penicillium sp.isolated from a deep sea sediment sample[J].J Nat Prod,2009,27(3):912 -916.
[3]Debbab A,Aly A H,Edrada-Ebel R,et al.Bioactive metabolites from the endophytic fungus stemphylium globuliferum isolated from mentha pulegium[J].J Nat Prod,2009,72(4):626 -631.
[4]Sunazuka T,Omura S.Total sysnthesis of α-pyrone meroterpenoids,novel bioactive microbial metabolites[J].Chem Rev,2005,105(12):4559 -4580.
[5]Mcglacken G P,Fairlamb I J S.2-Pyrone natural products and mimetics:Isolation,characterisation and biological activity[J].Nat Prod Rep,2005,22(3):369-385.
[6]周庆发,赵慎,王珣,等.2-吡喃酮衍生物合成研究进展[J].有机化学,2010,30(11):1652 -1663.
[7]Obata T,Shimo T,Yoshimoto S,et al.Peri-,Siteand stereocontrolled photocycloaddition of 4-methoxy-6-methyl-2-pyrone with maleimide Induced by the hydrogen bond and CT stacking in the dolid state[J].Chem Lett,1999,28(2):181 -182.
[8]Obata T,Shimo T,Yasutake M,et al.Remarkable interaction effects of molecular packing on site-and stereoselectivity in photocycloaddition of 2-pyrones with maleimide in the solid state[J].Tetrahedron,2001,57(8):1531-1541.
[9]Shimo T,Uezono T,Obata T,et al.X-ray and MO analysis of highly stereoselective solid-state photocycloadditions of 2-pyrones with maleimide[J].Tetrahedron,2002,58(30):6111 -6116.
[10]Shimo T,Yamaguchi R,Odo Y,et al.Efficient photochemical oxetane formation from 2-pyrones and benzophenones in the solid state[J].Heterocycles,2004,63(7):1541 -1545.
[11]Wang W W,Shimo T,Shinmyozu T,et al.Solidstate photocycloaddition of 6,6-dimethyl-4,4-polymethylenedioxy-di-2-pyrones to benzophenone[J].Heterocycles,2006,68(7):1381 -1392.
[12]Wang W,Shimo T,Hashimoto H,et al.Solid-state photocycloaddition of 6,6'-dimethyl-4,4'-[bis(methylenoxy)phenylene]-di-2-pyrones with benzophenone[J].Tetrahedron,2007:12367 -12372.
[13]Marcus E,Stephen J F,Chan J K.A study of the acylation of 4-hydroxy-6-methyl-2-pyrone and 4-hydroxy-6-phenyl-2-pyrone[J].J Heterocycl Chem,1969,6:13-22.
[14]Omar H I,Odo Y,Shigemitsu Y,et al.Transition state analysis on regioselectivity in[2+2]photocycloaddition reactions of substituted 2-cyclohexenone with cycloalkenecarboxylates[J].Tetrahedron,2003,59(41):8099-8105.
[15]Odo Y,Shimo T,Hori K,et al.Origin of regioselectivity in photocycloaddition reactions of 2-cyclohexenone with cycloalkenecarboxylates[J].Bul Chem Soc Jpn,2004,77(6):1209 -1215.
[16]Kiri S,Odo Y,Omar H I,et al.Origin of the endo/exo stereoselectivity and syn/anti aace-selectivity in Diels– Alder reactions,determined by transition state energy partitioning[J].Bull Chem Soc Jpn,2004,77(8):1499-1504.
[17]Omar H I,Shimo T,Somekawa K.Origin of regioselectivity in the intramolecular[2+2]photoreaction of α,β-unsaturated furanones to a terminal alkene[J].J Mol Struc(Theochem),2006,763(1 -3):115 -121.
[18]Anet R.The photodimers of coumarin and related coumpounds[J].Can J Chem,1962,40(7):1249 -1257.
[19]Yu X,Scheller D,Rademacher O,et al.Selectivity in the photodimerization of 6-alkylcoumarins[J].J Org Chem,2003,68(21):7386 -7399.
[20]Gnanaguru K,Ramasubbu N,Venkatesan K,et al.A study on the photochemical dimerization of coumarins in the solid state[J].J Org Chem,1985,50(13):2337-2346.
[21]Narasimha Moorthy J,Venkatesan K,Weiss Richard G.Photodimerization of coumarins in solid cyclodextrin inclusion complexes[J].J Org Chem,1992,57(12):3292-3297.
[22]Shimo T,Ueda S,Suishu T,et al.Intramolecular photocycloadditions of 6,6'-dimethyl-4,4'-polymethylenedioxy-di-2-pyrones[J].The Journal of Heterocyclic Chemistry,1995,32(3):727 -730.
