新型蒽衍生物
——9-[3,5-二(4′-N,N-二苯基)胺基]苯基蒽的合成及其光学性能
2013-11-19余黎明周学华朱伟为朱偲偲高希存
余黎明, 周学华, 朱伟为, 汪 苹, 朱偲偲, 高希存
(南昌大学 化学系,江西 南昌 330031)
自从Tang[1]首次报道了有机电致发光器件(OLEDs)以来,作为最有前景的下一代平板显示技术,在近二十年来得到了迅猛的发展[2~6]。在红、绿、蓝三基色的发光器件中,绿光OLEDs的研究已经很成熟,达到了实际应用的要求,而蓝光和红光OLEDs在发光效率、色纯度和寿命等方面还有待改进和提高,寻找性能优越的蓝色发光材料是蓝光OLEDs研究的重点。
蒽的衍生物都是好的蓝色发光材料[7,8],具有较好的成膜性、 稳定性和适当的载流子传输特性。但由于蒽分子的平面结构,分子之间容易产生结晶,从而大大降低了蒽在OLEDs的实际应用价值。三苯胺具有强的空穴传输性能、较大的空间结构、强的供电子效应等特点,从而成为空穴传输材料、有机电致发光材料等的重要原料[9~11]。通过把三苯胺引入到蒽分子中,使其衍生物具有两个基团的共性,又减少蒽分子之间的聚集,从而提高其光电性能。
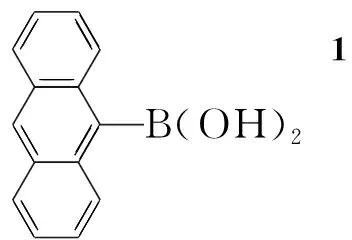
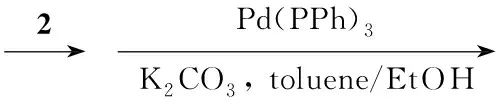
Scheme1
本文在文献方法[12~15]的基础上,以9-溴蒽,1,3,5-三溴苯,对溴碘苯和二苯胺为原料,经Ullmann反应、Suzuki偶联和硼酸化等反应合成了一种新型的蒽衍生物——9-[3,5-二(4′-N,N-二苯基)胺基]苯基蒽(5, Scheme 1),其结构经1H NMR和元素分析表征。并研究了9-(3,5-二溴苯基)-蒽(2)和5的荧光光谱和紫外吸收光谱。
由于5具有较大的空间结构、强的供电子效应和空穴传输能力,可以起到改善磷光材料的发光性能和简化器件结构的作用。器件的组装正在进行中。
1 实验部分
1.1 仪器与试剂
X-4型显微熔点仪(温度未校正);Bruker Avance-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Flash Ea 1112型元素分析仪;Lambda-35型紫外-可见光谱仪(UV-Vis);日立F-4500型荧光光谱仪(FL)。
9-蒽硼酸(1)[12],N,N-二苯基对溴苯胺(3)[13]和4-N,N-二苯基胺基苯硼酸(4)[14,15]按文献方法合成;对溴碘苯,二苯胺,氯化亚铜(98%),三甲基硼酸酯,正丁基锂,Alfa Aesa; 9-溴蒽,1,3,5-三溴苯,上海国药;四(三苯基磷)合钯[Pd(PPh3)4],北京盛维特公司;其余所用试剂均为分析纯。
1.2 合成
(1)2的合成
在反应瓶中依次加入14.44 g(20 mmol), 1,3,5-三溴苯18.84 g(60 mmol), Pd(PPh3)40.69 g(0.6 mmol),甲苯100 mL,乙醇15 mL及2 mol·L-1碳酸钾溶液30 mL,氮气保护,搅拌下缓慢升温至回流,反应7 h~8 h。冷却至室温,分液,水层用甲苯(3×30 mL)萃取,合并有机相,蒸除溶剂后经硅胶柱层析(洗脱剂:正己烷)纯化得白色固体,经升华得白色晶体2 6.43 g,收率78%, m.p.201 ℃~203 ℃; 1H NMRδ: 8.52(s, 1H), 8.05(d,J=8.4 Hz, 2H), 7.86(s, 1H), 7.59(d,J=8.7 Hz, 2H), 7.56(d,J=1.2 Hz, 2H), 7.47(t,J=4.0 Hz, 2H), 7.42(t,J=3.9 Hz, 2H)。
(2) 5的合成
在反应瓶中加入24.12 g(10 mmol),4)7.22 g(25 mmol), Pd(PPh)30.69 g(6 mmol),甲苯100 mL,乙醇15 mL和碳酸钾(8.29 g)的饱溶液,在氮气保护下缓慢升温至回流,反应24 h。冷却至室温,分液,水层用甲苯(3×30 mL)萃取,合并有机相,蒸除溶剂后经硅胶柱层析[洗脱剂:V(二氯甲烷) ∶V(石油醚)=1 ∶2]纯化得白色固体5 5.93 g,收率80%, m.p.253 ℃~255 ℃;1H NMRδ: 8.53(s, 1H), 8.06~8.08(d,J=8.8 Hz, 2H), 7.96(s, 1H), 7.81~7.84(d,J=8.8 Hz, 2H), 7.60~7.61(d,J=7.2 Hz, 6H), 7.46~7.49(t,J=7.6 Hz, 2H), 7.35~7.39(t,J=7.6 Hz, 2H), 7.24~7.28(t,J=7.8 Hz, 8H), 7.12~7.16(t,J=7.4 Hz, 12H), 7.01~7.04(t,J=7.2 Hz, 4H); Anal.cacld for C56H40N2: C 90.78, H 5.44, N 3.78; found C 90.24, H 5.45, N 3.56。
2 结果与讨论
2.1 合成
在合成1和4的反应中,反应冷却到-78 ℃下进行,缓慢加入正丁基锂 (1 mL/2 min),加入硼酸甲酯要快,否则低温容易导致其凝固在反应器壁上。在2和5的合成中,Pd(PPh3)4要在氧气排尽后再加入,否则容易导致催化剂中毒失效。
2.2 光学性质
图1为2和5在二氯甲烷溶液中(5×10-6mol·L-1) 的UV-Vis光谱图。由图1可见,2在255 nm, 348 nm, 367 nm和385 nm有较强的吸收;5在256 nm, 350 nm, 368 nm和388nm有较强的吸收。2和5在高能区的吸收峰是芳环上的电子π - π* 跃迁吸收产生。从图1还可以看出,与2相比,5的吸收波长发生红移。结果表明,5在2的基础上引入2个具有强共轭体系的三苯胺,加大了电子离域的范围,电子跃迁所需的能量减少,导致吸收波长轻微红移。

λ/nm图1 2和5的UV-Vis谱图*Figure 1 UV-Vis absorption spectra of 2 and 5*c 5×10-6 mol·L-1,二氯甲烷为溶剂
图2是2和5在二氯甲烷溶液中的FL谱图(激发波长为320 nm)。从图2可见,2的发射光谱波长在403 nm和421 nm处较强;5的发射光谱波长在414 nm和497 nm处较强。从图2中两者的比较来可以看出,由于5在2的基础上进一步引入三苯胺基团,共轭体系增大,降低了LUMO和HOMO的能垒,使发射峰的位置发生了红移。

λ/nm图2 2和5的荧光光谱图*Figure 2 Fluorescence spectra of 2 and 5*激发波长320 nm,二氯甲烷为溶剂
[1] Tang C W, Vanslyke S A. Organic eleetroluminescent diodes[J].Appl Phys Lett,1987,51:913-915.
[2] AdalcIli C, Tokito S, Tsutsui T. Electroluminescence in organic films witll three-layer structure[J].Jpn J Appl Phys Part 2,1988,27(2):269-271.
[3] 邵作叶,郑喜风,陈宇. 平板显示器中的0LED[J].液晶与显示,2005,20(1):52-56.
[4] Yasuhiko Shirota. Organic materials for electronic and optoelectronic devices[J].Mater Chem,2000,10(1):1-25.
[5] J G C Veinot, T J Marks. Toward the ideal organic light-emitting diode.The versatility and utility of interfacial tailoring by cross-linked siloxaneInterlayers[J].Acc Chem Res,2005,38:632-643.
[6] E Holder, B M W Langeveld, U S Schubert. New trends in the use of transition metal-ligand complexes for applications in electroluminescent devices[J].Adv Mater,2005,17:1109-1121.
[7] Shi J M, Tang C W. Anthracene derivatives for stable blue-emitting organic electroluminescence devices[J].App1 Phys Lett,2002,80(17):3201-3203.
[8] Kan Y, Wang L D, Duan L,etal. Highly-efficient blue electroluminescence based on two emitter isomersi[J].Appl Phys Lett,2004,84(9):1513-1515.
[9] Cheng S H, Hsiao S H, Su T H,etal. Novel aromatic poly(amine-imide)s bearing a pendent triphenylamine group:Synthesis,thermal,photophysical,electrochemical,and electrochromic characteristics[J].Macromolecules,2005,38:307-316.
[10] Jessica M H, Angela P G, Yan Z,etal.n-Type conjugated oligoquin-oline and oligoquinoxaline with triphenylamine endgroups:Efficient ambipolar light emitters for device applications[J].Chem Mater,2006,18:4924-4932.
[11] Jin S H, Kim M Y, Kim J Y,etal. High-efficiency poly(p-phenylenevinylene)-based copolymers containing an oxadiazole pendant group for ligh-emitting diodes[J].J Am Chem Soc,2004,126:2474-2480.
[12] R Pudzich, J Salbeck. Synthesis and characterization of new oxadiazoleamine based spiro-linked fluorescence dyes[J].Synthetic Metals,2003,138(1~2):21-31.
[13] Christopher L Cioffi, William T Spencer, Justin J Richards,etal. Generation of 3-pyridyl biaryl systems via palladium-catalyzed Suzuki cross-couplings of aryl halides with 3-pyridylboroxin[J].J Org Chem,2004,69(6):2210-2212.
[14] Leifang Liu, Yuhong Zhang, Bingwei Xin. Synthesis of biaryls and polyaryls by ligand-free Suzuki reaction in aqueous phase[J].J Org Chem,2006,71(10):3994-3997.
[15] Zhong Hui Li, Man Shing Wong. Synthesis and functional properties of end-dendronized oligo(9,9-diphenyl)fluorenes[J].Org Lett,2006,8(7):1499-1502.
