降钙素基因相关肽对低氧性肺动脉高压肺动脉胶原沉积的影响*
2013-03-25李先伟李元建
李先伟,杜 洁,李元建△
(1.皖南医学院药理学教研室,安徽 芜湖241002;2.中南大学药学院药理学系,湖南 长沙410078)
肺动脉高压是众多心肺血管疾病发生发展过程中的重要病理生理环节,血管重构是肺动脉高压(pulmonary arterial hypertension,PAH)的重要病理特征,肺小血管肌化可引起肺血管阻力增加,最终导致失代偿性心衰甚至死亡[1]。胶原作为细胞外基质的重要组成部分,在肺血管结构重建过程中发挥了极其重要的作用[2]。大量研究表明,降钙素基因相关肽(calcitonin gene related peptide,CGRP)在 PAH血管重构中起着重要的作用[3,4]。我们前期的研究发现,CGRP能够抑制低氧诱导的肺动脉血管平滑肌细胞(PASMCs)的增殖,其机制与其抑制细胞外信号调节蛋白激酶 1/2(ERK1/2)信号通路有关[5],但其对细胞外基质重构是否有作用尚不清楚。本研究首先通过低氧性PAH动物模型,研究内源性CGRP对低氧性PAH肺血管胶原代谢的影响。然后在培养的PASMCs中,观察外源性CGRP是否可以抑制低氧诱导的细胞胶原的表达,进而探讨CGRP对PAH血管重构的作用及其可能机制,希望能为低氧性PAH发病机制提供新的实验证据,并为寻找治疗低氧性PAH药物提供思路。
1 材料与方法
1.1 材料
雄性SD大鼠,体重180~220 g(湖南斯莱克)。小鼠抗大鼠 ERK1/2及 phospho-ERK1/2(p-ERK1/2)单克隆抗体(美国 cell signaling)。Masson染色试剂盒(南京凯基)。CGRP放射免疫试剂盒(北京东亚)。BrdU增殖检测试剂盒(美国 Roche);CGRP、CGRP8-37及 ERK1/2抑制剂 PD 98059(美国 sigma);PrimeScriptTM RT reagent Kit、Power SYBR Green PCR Master Mix(大连宝生物工程有限公司),引物设计合成(上海生物)。
1.2 方法
1.2.1 动物分组及模型的制备 大鼠适应性喂养一周,按体重随机分为 3组:(1)常氧组(Normoxia);(2)低氧组(Hypoxia);(3)Hypoxia+辣椒素(Capsaicin)组:低氧前4 d大鼠皮下注射辣椒素(50 mg/(kg·d)),耗竭内源性 CGRP。Hypoxia与 Hypoxia+Capsaicin组放入含10%氧气的低氧仓中,仓中用无水氯化钙吸收水分,钠石灰吸收二氧化碳。维持3周即可成模。
1.2.2 血流动力学指标的测定 造模后3周用2%戊巴比妥钠(60mg/kg)腹腔注射麻醉大鼠。将连有压力换能器的聚乙烯导管经右颈外静脉插入右心室及肺动脉,分别记录右心室收缩压(RVSP)和平均肺动脉压(mPAP)。
1.2.3 肺组织血管形态学观察及Masson染色 取大鼠左肺以4%多聚甲醛固定48 h,石蜡包埋切片,行HE染色。每只大鼠选1张肺结构完整的切片,利用Nikon&spot图像采集处理系统,每张切片随机计算20根管径50~100μm的肺小动脉管壁厚度(血管内膜和外膜之间距离)和外径,将肺小动脉管壁厚度占外径的百分比WT%(WT%=管壁厚度/外径×100%)作为肺血管重构的量化指标。肺组织Masson胶原染色按试剂盒说明书进行。
1.2.4 血浆CGRP浓度测定 颈动脉采血2 ml集中于含10%Na2EDTA 40μl和抑肽酶40μl的试管中,3 500 r/min,4℃离心 20 min,收集血浆,按 CGRP放免试剂盒说明书测定血浆中CGRP的浓度。
1.2.5 大鼠原代肺动脉平滑肌细胞(PASMCs)的培养及细胞实验分组 按文献采用组织贴块法制备PASMCs[6],经 alpha-smooth muscle actin(α-SMA)免疫荧光染色鉴定后3~8代用于实验。细胞实验分8组,每组9个样本:(1)Normoxia组:细胞用 21%O2处理 48 h;(2)Hypoxia组:细胞用 3%O2处理 48 h;(3)Hypoxia+二甲基亚砜(DMSO)组:细胞用PD98059溶媒DMSO预处理1 h,再低氧处理48 h;(4)Hypoxia+PD98059 1μmol/L组:细胞用 PD98059 1μmol/L预处理 1 h,再低氧处理 48 h;(5)Hypoxia+CGRP 1 nmol/L组:细胞用 CGRP(1 nmol/L)预处理 1 h,再低氧处理 48 h;(6)Hypoxia+CGRP 10 nmol/L组:细胞用 CGRP(10 nmol/L)预处理1 h,再低氧处理48 h;(7)Hypoxia+CGRP 100 nmol/L组:细胞用CGRP(100 nmol/L)预处理 1 h,再低氧处理 48 h;(8)Hypoxia+CGRP8-371μmol/L和 CGRP 100 nmol/L组:细胞用 CGRP8-37(1μmol/L)和 CGRP(100 nmol/L)预处理1 h,再低氧处理48 h。
1.2.6 BrdU法测定细胞增殖 细胞以6×103cells/well的密度种于96孔板,贴壁后用1%FBS的DMEM高糖培基处理24 h。细胞分别根据细胞实验设计进行处理,处理结束时,每孔加入10μl BrdU,正常培养条件下孵育4 h,固定液室温孵育30 min,室温孵育BrdU抗体90min,PBS洗涤5min×3,加入200μl底物室温反应 15 min,每孔加入 1 mol/L硫酸 25μl,2 min之内在450 nm波长下用酶标仪检测光密度值(OD值)。每组9个复孔。
1.2.7 Real Time PCR检测 CGRP、collagenⅠ和 collagenⅢmRNA的表达 用Trizol等试剂提取组织或细胞总RNA后,按逆转录试剂盒操作步骤进行RT反应。所得cDNA在实时荧光定量PCR仪(7300 Real Time PCR System,Applied Biosystem)上进行反应。按照说明,使用Power SYBR Green PCRMaster Mix试剂盒,以2μl cDNA为模板,以 GAPDH为内参照,PCR扩增基因片段(表1)。PCR反应参数:预变性95℃ 30 s,95℃变性 5 s,60℃退火和延伸 31 s,共 40个循环,在延伸的过程中搜集荧光信号。于每次扩增的同时设置无cDNA的阴性对照,将PCR产物做熔解曲线,以证实以上 PCR反应产物特异性良好。用7300 System SDS Software分析数据,统计ΔΔCt值,计算RQ值以比较各组mRNA的表达。
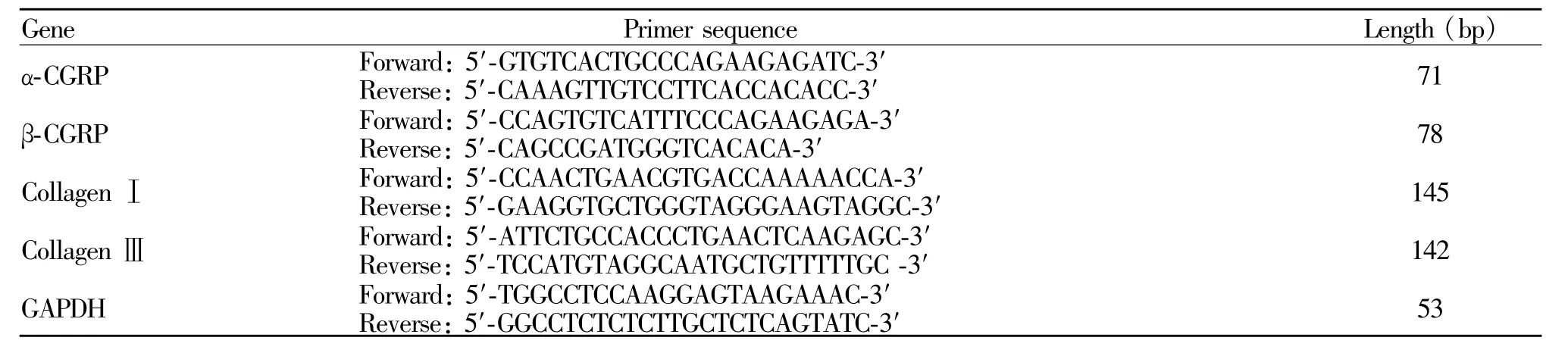
Tab.1 Primer sequences used for determination of CGRP、collagenⅠand collagenⅢgene expression
1.2.8 Western blot检测 ERK1/2及 p-ERK1/2蛋白表达 低温提取组织或细胞蛋白,BCA法测定蛋白浓度。每孔上样50μg蛋白,12%SDS-PAGE分离样品,转膜,封闭,一抗(1∶1 000)4℃过夜。洗膜,二抗(1∶2 000)室温孵育1 h。洗膜后将高灵敏的 LunimataTM Crescendo发光剂加到膜的正面,采用 Bio-Rad ChemiDoc XRS+成像系统进行拍照用,Image J 1.43(National Institutes of Health)软件进行灰度值分析并比较各组蛋白表达差异。
1.3 统计分析
所有数据均表示为平均值±标准差(±s),统计分析采用 SPSS l3.0软件。多组均数比较采用ANOVA及Newman-Keuls-Student多重比较t检验分析。
2 结果
2.1 Capsaicin对低氧诱导的 PAH大鼠 RVSP、mPAP及血管重构的影响
经过3周持续低氧,Hypoxia组 RVSP、mPAP均显著高于Normoxia组(P<0.01);HE染色显示Hypoxia组肺小血管显著增厚,WT%明显升高。而用辣椒素预先耗竭内源性CGRP后能够加重低氧诱导的上述改变(P<0.05,图 1,表 2)。
Tab.2 Effectof capsaicin on RVSP,mPAPandWT%in hypoxia-induced pulmonary arterial hypertension of rats(±s,n=8)
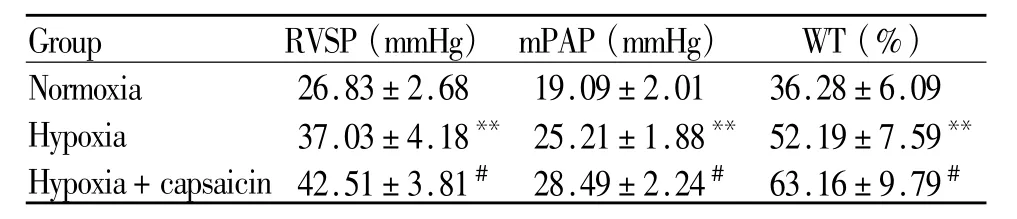
Tab.2 Effectof capsaicin on RVSP,mPAPandWT%in hypoxia-induced pulmonary arterial hypertension of rats(±s,n=8)
RVSP:Right ventricle systolic pressure;mPAP:Mean pulmonary arterial pressure;WT%:Wall thickness/external diameter×100%**P<0.01 vs Normoxia;#P<0.05 vs Hypoxia
Group RVSP(mmHg) mPAP(mmHg) WT(%)Normoxia 26.83±2.68 19.09±2.01 36.28±6.09 Hypoxia 37.03±4.18**25.21±1.88**52.19±7.59**Hypoxia+capsaicin 42.51±3.81# 28.49±2.24# 63.16±9.79#

Fig.1 Effect of capsaicin on pulmonary vascular remodeling in hypoxia-induced pulmonary arterialhypertension of rats(HE×200)
2.2 Capsaicin对低氧诱导的PAH大鼠肺动脉胶原表达的影响
Masson染色结果显示Normoxia组仅少数肺动脉外膜出现蓝染的胶原纤维,小动脉中膜和内膜层未见蓝染的胶原纤维;Hypoxia组小动脉中膜增厚、中膜和内膜层出现蓝染的胶原纤维沉积,而Capsaicin+Hypoxia组的这种病理变化进一步加重(图2)。与Normoxia组相比,Hypoxia组肺动脉Ⅰ型和Ⅲ型胶原mRNA表达水平明显增高(P<0.01),而辣椒素预处理组胶原的表达进一步增高(P<0.05,表3)。
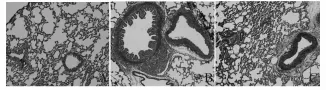
Fig.2 Effect of capsaicin on collagen accumulation of pulmonary arteries in hypoxia-induced pulmonary arterial hypertension of rats(Masson×200)
Tab.3 Effect of capsaicin on collagenⅠand collagenⅢ mRNA expression of pulmonary arteries in hypoxia-induced pulmonary arterial hypertension of rats(±s,n=8)

Tab.3 Effect of capsaicin on collagenⅠand collagenⅢ mRNA expression of pulmonary arteries in hypoxia-induced pulmonary arterial hypertension of rats(±s,n=8)
PA:Pulmonary artery**P<0.01 vs Normoxia;#P<0.05 vs Hypoxia
Group CollagenⅠmRNA level in PA(relative unit,RQ value)CollagenⅢmRNA level in PA(relative unit,RQ value )Normoxia 1.08±0.36 1.05±0.19 Hypoxia 3.16±0.67** 1.91±0.48**Hypoxia+capsaicin 4.23±0.84# 2.58±0.55#
2.3 Capsaicin对低氧诱导的PAH大鼠血浆CGRP含量的影响
与Normoxia组相比,低氧能明显降低大鼠血浆CGRP水平及肺组织 CGRP mRNA的表达(P<0.01);而用辣椒素预先耗竭内源性CGRP后能够进一步降低血浆CGRP水平肺组织CGRP的表达(P<0.05,表 4)。
2.4 Capsaicin对低氧诱导的 PAH大鼠肺组织CGRP表达的影响
与Normoxia组相比,低氧能明显降低大鼠血浆CGRP水平及肺组织 CGRP mRNA的表达(P<0.01);而用辣椒素预先耗竭内源性CGRP后能够进一步降低血浆CGRP水平肺组织CGRP的表达(P<0.05,表 4)。
2.5 Capsaicin对低氧诱导的PAH大鼠肺动脉p-ERK1/2蛋白表达的影响
Western blot检测发现,低氧能明显促进肺动脉p-ERK1/2的表达(P<0.01),而用辣椒素预先耗竭内源性CGRP后进一步增加p-ERK1/2的表达(P<0.05,表 4,图 3)。
Tab.4 Effect of capsaicin on CGRP level and p-ERK1/2 protein expression of pulmonary arteries in hypoxia-induced pulmonary arterial hypertension of rats(±s,n=8)

Tab.4 Effect of capsaicin on CGRP level and p-ERK1/2 protein expression of pulmonary arteries in hypoxia-induced pulmonary arterial hypertension of rats(±s,n=8)
PA:Pulmonary artery;CGRP:Calcitonin gene-related peptide;p-ERK1/2:Phosphorylated ERK1/2**P<0.01 vs Normoxia;#P<0.05 vs Hypoxia
Group CGRP concentration in plasma(pg/ml)α-CGRPmRNA level in lung(relative unit,RQ value) β-CGRPmRNA level in lung(relative unit,RQ value)p-ERK1/2 protein level in PA(p-ERK1/2/ERK1/2)Normoxia 69.95±9.63 1.02±0.23 1.01±0.25 0.99±0.11 Hypoxia 47.11±8.01** 0.68±0.11** 0.65±0.14** 1.98±0.12**Hypoxia+capsaicin 34.21±9.41# 0.44±0.12# 0.41±0.13# 2.41±0.22#
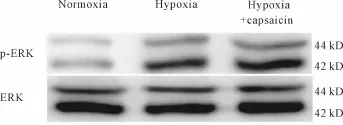
Fig.3 Effectof capsaicin on p-ERK1/2 protein expression of pulmonary arteries in hypoxia-induced pulmonary arterial hypertension of rats
2.6 CGRP对低氧诱导的PASMCs细胞增殖的影响
BrdU检测发现低氧可明显促进细胞增殖(P<0.01),而此作用可以明显的被 ERK1/2抑制剂PD98059所抵消(P<0.01)。CGRP(1,10,100 nmol/L)可剂量依赖性的抑制低氧诱导的细胞增殖,而CGRP的这些作用可以被CGRP阻断剂CGRP8-37所抵消(表 5)。
2.7 CGRP对低氧诱导大鼠PASMCs p-ERK1/2蛋白表达的影响
Western blot检测发现,低氧能明显促进PASMCs p-ERK1/2蛋白表达,而此作用可以明显的被ERK1/2抑制剂 PD98059所抵消(P<0.01)。CGRP(1,10,100 nmol/L)可剂量依赖性的抑制低氧诱导的 p-ERK1/2蛋白表达,而CGRP8-37可以抵消 CGRP的这些作用(表 5,图 4)。
2.8 CGRP对低氧诱导的大鼠PASMCs collagenⅠ和collagenⅢmRNA表达的影响
Real time PCR检测发现,低氧能明显促进细胞collagenⅠ和collagenⅢ mRNA的表达,而此作用可以明显的被ERK1/2抑制剂 PD98059所抵消(P<0.01)。CGRP(1,10,100 nmol/L)可剂量依赖性的抑制低氧诱导的collagenⅠ和collagenⅢ mRNA的表达,而CGRP8-37可以抵消CGRP的这些作用(表5)。
Tab.5 Effect of CGRP on hypoxia-induced proliferation of pulmonary artery smoothmuscle cells and expression of p-ERK1/2,collagenⅠand collagenⅢ(±s,n=9)
Tab.5 Effect of CGRP on hypoxia-induced proliferation of pulmonary artery smoothmuscle cells and expression of p-ERK1/2,collagenⅠand collagenⅢ(±s,n=9)
PASMCs:Pulmonary arterial smoothmuscle cells;p-ERK1/2:Phosphorylated ERK1/2**P<0.01 vs Normoxia;#P<0.05,##P<0.01 vs Hypoxia;△△P<0.01 vs CGRP(100 nmol/L)
Group BrdU incorporation(OD value)p-ERK1/2 protein level in PASMCs(p-ERK1/2/ERK1/2)CollagenⅠmRNA level in PASMCs(relative unit,RQ value)CollagenⅢmRNA level in PASMCs(relative unit,RQ value )Normoxia 0.29±0.09 1.03±0.10 1.02±0.15 1.04±0.17 Hypoxia 0.91±0.15** 4.48±0.20** 6.66±0.42** 4.75±0.45**Hypoxia+DMSO 0.94±0.19 4.51±0.18 6.68±0.54 4.73±0.36 Hypoxia+PD98059(1μmol/L) 0.37±0.13## 0.13±0.03## 2.80±0.18## 1.90±0.24##Hypoxia+CGRP(1 nmol/L) 0.63±0.12# 3.94±0.26# 4.85±0.36# 3.31±0.27#Hypoxia+CGRP(10 nmol/L) 0.58±0.16## 3.27±0.19## 4.36±0.42## 3.03±0.25##Hypoxia+CGRP(100 nmol/L) 0.44±0.14## 2.56±0.18## 3.46±0.27## 2.76±0.26##Hypoxia+CGRP8-37(1μmol/L) 0.89±0.12△△ 4.49±0.16△△ 6.55±0.62△△ 4.57±0.38△△
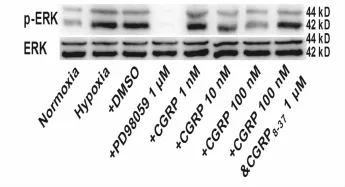
Fig.4 Effect of CGRP on expression of p-ERK1/2 in pulmonary artery smoothmuscle cells
3 讨论
肺血管重构是低氧性PAH形成过程中重要的病理基础,其主要特征包括肺动脉内皮细胞增生、肿胀,中膜平滑肌细胞增生、肥大和向合成表型转化,以及细胞外基质的异常沉积[1]。胶原是细胞外基质主要组成部分,胶原的增生、沉积在肺血管重构和肺动脉高压的发生发展中发挥重要而又直接的作用。肺血管壁的主要胶原成分是Ⅰ型和Ⅲ型胶原,Ⅰ型胶原与血管壁的韧性和抗张力有关,Ⅲ型胶原与血管壁的弹性有关[2]。CGRP是由37个氨基酸组成的感觉神经肽,广泛分布于中枢和外周神经系统及心血管及肺血管床内[7]。研究发现,新生大鼠持续低氧三周能够引起持续性PAH并伴随着血浆CGRP水平的下降[4],靶向敲除CGRP受体基因能够加重低氧诱导的PAH[8]。本研究结果提示大鼠低氧3周后大鼠RVSP、mPAP明显升高,肺小血管肌化程度明显增强,肺动脉中膜厚度明显增加,提示肺小血管发生重构。同时肺动脉Ⅰ型和Ⅲ型胶原的表达明显增强,提示胶原堆积在低氧性肺血管重构中发挥重要作用。胶原的堆积将导致肺动脉管壁增厚,管腔变小,血管顺应性下降,促进肺动脉高压的形成。同时我们还发现,在大鼠低氧性PAH形成的过程中伴随着CGRP表达的下调,而用大剂量辣椒素耗竭内源性CGRP后能够加重上述的病理变化,表明CGRP可能参与了低氧性PAH胶原沉积和血管重构的发生与发展。更重要的是我们还发现,外源性CGRP能够剂量依赖性地抑制低氧诱导的PASMCs增殖及Ⅰ型和Ⅲ型胶原的表达,而这种抑制作用能够被CGRP受体阻断剂CGRP8-37所抵消。提示 CGRP可能通过抑制肺动脉胶原异常堆积参与对低氧性PAH肺血管重构的调节作用。
目前低氧性PAH肺动脉胶原沉积的原因还不完全清楚。血管壁过多的胶原主要来自中膜平滑肌细胞和外膜成纤维细胞。丝裂原活化蛋白激酶(MAPKs)是细胞内的一类丝氨酸/苏氨酸蛋白激酶。MAPKs信号通路包括:ERK1/2信号通路、c-Jun氨基末端激酶(JNK)信号通路及p38 MAPK信号通路,其中ERK1/2在调节血管平滑肌细胞增殖和胶原合成过程中起着重要的作用[9]。我们前期的研究发现,CGRP能够抑制低氧诱导的肺动脉血管平滑肌细胞(PASMCs)的增殖,其机制与其抑制 ERK1/2信号通路有关[6]。本研究结果也显示在低氧性肺动脉高压大鼠肺动脉胶原堆积的同时,肺动脉ERK1/2磷酸化水平明显增高。同时我们还发现在低氧诱导PASMCs增殖的同时伴随着p-ERK1/2表达的上调,而外源性CGRP在抑制PASMCs胶原表达的同时也剂量依赖性的抑制p-ERK1/2蛋白表达,CGRP的这些作用与 ERK1/2的抑制剂 PD98059相似,也可以被CGRP受体阻断剂CGRP8-37所抵消。
综上所述,CGRP能够抑制低氧诱导的PAH血管重构,其机制可能与抑制ERK1/2的磷酸化,降低肺动脉胶原异常沉积有关。这将为临床防治低氧性肺动脉高压提供了新的思路和靶点。但是低氧性PAH只是肺动脉高压的一种,而CGRP是否通过上述的机制参与非低氧性肺动脉高压的发生与发展,目前还不清楚,有待进一步研究。
[1] Morrell NW,Adnot S,Archer S L,et al.Cellular and molecular basis of pulmonary arterial hypertension[J].J Am Coll Cardiol,2009,54(1 Suppl):S20-31.
[2] Ooi C Y,Wang Z,Tabima DM,etal.The role of collagen in extralobar pulmonary artery stiffening in response to hypoxia-induced pulmonary hypertension[J].Am J Physiol Heart Circ Physiol,2010,299(6):H1823-1831.
[3] Keith IM,Tjen-A-LooiS,Kraiczi H,et al.Three-week neonatal hypoxia reduces blood CGRP and causes persistent pulmonary hypertension in rats[J].Am JPhysiolHeartCirc Physiol,2000,279(4):H1571-1578.
[4] Chattergoon N N,D’Souza FM,DengW,et al.Antiproliferative effects of calcitonin gene-related peptide in aortic and pulmonary artery smoothmuscle cells[J].Am JPhysiol Lung CellMol Physiol,2005,288(1):L202-211.
[5] LiXW,Hu CP,WuW H,etal.Inhibitory effectof calcitonin gene-related peptide on hypoxia-induced rat pulmonary artery smoothmuscle cells proliferation:role of ERK1/2 and p27[J].Eur JPharmacol,2012,679(1-3):117-126.
[6] Li X H,Peng J,Tan N,et al.Involvement of asymmetric dimethylarginine and Rho kinase in the vascular remodeling in monocrotaline-induced pulmonary hypertension[J].Vascul Pharmacol,2010,53(5-6):223-229.
[7] Bell D,McDermott B J.Calcitonin gene-related peptide in the cardiovascular system:characterization of receptor populations and their(patho)physiological significance[J].Pharmacol Rev,1996,48(2):253-288.
[8] Qing X,Keith IM.Targeted blocking of gene expression for CGRP receptors elevates pulmonary artery pressure in hypoxic rats[J].Am J Physiol Lung Cell Mol Physiol,2003,285(1):L86-96.
[9] Li L F,Liao SK,Huang C C,et al.Serine/threonine kinase-protein kinase B and extracellular signal-regulated kinase regulate ventilator-induced pulmonary fibrosis after bleomycininduced acute lung injury:a prospective,controlled animal experiment[J].Crit Care,2008,12(4):R103.
