玉米赤霉烯酮生物降解研究进展
2013-03-20宾石玉张晓琳
史 競 汪 洋 鞠 星 宾石玉 张晓琳
(广西师范大学1,桂林 541004)
(国家粮食局科学研究院2,北京 100037)
自1961年英国科学家分离到了第一种真菌毒素——黄曲霉毒素以来,真菌毒素危害所造成的损失已引起人们的高度重视[1]。据联合国粮农组织估算,全球每年约有25%的农产品受到真菌毒素的污染,2%的农产品因污染严重而失去营养和经济价值,造成数百亿美元的经济损失[2]。玉米赤霉烯酮(Zearalenone,ZEN)又称F-2毒素,是世界上污染范围最广的一种镰刀菌毒素,在欧洲、非洲、亚洲、北美洲、南美洲以及大洋洲等世界各地的谷物以及农副产品中都检测到ZEN的存在[3]。
目前降解真菌毒素的方法主要包括:物理法、化学法以及生物法。传统的物理和化学方法虽然能部分清除真菌毒素,但是这些方法具有破坏营养、去毒不彻底及成本高等缺陷,实际应用具有一定的局限性[4]。而生物学方法具有反应条件温和、无化学试剂残留等优点,日益被科学界所关注[5]。
1 玉米赤霉烯酮结构及生物毒性
玉米赤霉烯酮是由禾谷镰刀菌(Fusarium graminearum)、黄色镰刀菌(Fusarium culmorum)、克地镰刀菌(Fusarium crookwellense)等多种镰刀菌产生并释放到环境中的真菌毒素[6]。1962年Stob从感染了禾谷镰刀菌的玉米中首次分离到玉米赤霉烯酮。1966年Urry用经典化学[7]、核磁共振和质谱技术确定了玉米赤霉烯酮的化学结构并正式确定其化学名称为:6-(10-羟基-6-氧代-反式-1-十-碳烯)-β-雷锁酸-内酯。分子式为C18H22O5,白色晶体,不溶于水。分子结构式如下:
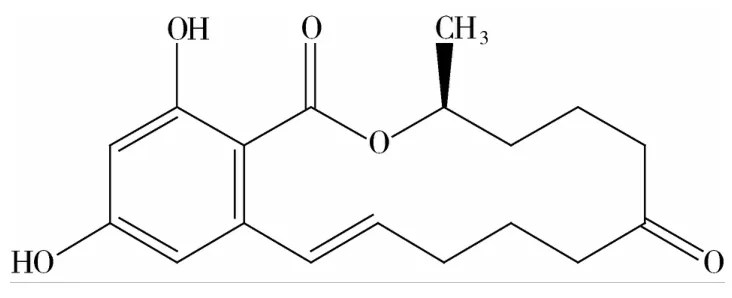
图1 玉米赤霉烯酮的化学结构式
在对小鼠、大鼠和豚鼠的急性毒性实验发现ZEN的急性毒性相对较低(LD50>2 000~20 000 mg/kg b.w.)[8]。ZEN的毒性主要表现为慢性毒性,包括对生殖系统的毒性以及基因毒性和内分泌系统的影响。ZEN在1~3 mg/kg时即能刺激雌激素受体转录,导致繁殖障碍[9];有研究表明在怀孕期间摄入ZEN过量会降低胚胎存活率[10]。若怀孕母猪食用一定量的ZEN则会出现流产,严重会产生畸形胎、死胎。ZEN摄入后会减少黄体生成素(LH)、孕激素分泌和子宫组织形态的改变,这些变化可能会影响子宫的功能[11]。
2 玉米赤霉烯酮生物降解研究
由于玉米赤霉烯酮的毒性,2002年世界卫生组织(WHO)和联合国粮农组织(FAO)已经将解决ZEN毒性作为全世界的当务之急[12]。已有研究指出一些高温、辐照、吸附作用及氧化剂处理已污染的作物能有效减少ZEN浓度,但这些物理、化学方法的最大不足之处是:去毒效果有限,并可能造成重要营养物质丢失,容易造成二次污染,并且成本较高[13],所以生物方法逐渐成为脱毒研究的重点。
早在20世纪80年代El-Sharkawy和Abul-Hajj发表了一系列关于真菌和放线菌转化ZEN的重要文章。他们在文章中描述了分枝珠霉(Thamnidium elegans)和班尼毛霉(Mucor bainieri)可将 ZEN转化为一种无雌激素效应的产物:ZEN-4-O-βglucoside[14]。另外由龟裂链霉菌(Streptomyces rimosus)和班尼小克银汉霉(Cunninghamella bainieri)转化的产物 8'-hydroxy-zearalenone和 2,4-dimethoxyzearalenone都未表现出雌激素毒性[15]。最值得注意的是,他们从150种真菌中筛选出了一株粉红黏帚霉(Gliocladium roseum,异名:粉红螺旋聚孢霉:Clonostachys rosea)NRRL 1859能将ZEN降解成一种雌激素作用远小于ZEN的降解产物。
Kakeya等[16]和 Takahashi等[17]筛选到了一株粉红螺旋聚孢霉(Clonostachys rosea)IFO7063可以将ZEN完全转化为没有雌激素活性的代谢产物,并依据降解酶氨基酸序列设计引物克隆了降解酶基因zhd101。Utermark等[18]利用插入失活试验证明了zhd101编码的碱性乳糖水解酶ZHD101是降解ZEN的功能性蛋白质。Takahashi等[19-20]进一步将zhd101转化酿酒酵母(Saccharomyces cerevisiae),在早期研究发现:虽然含有zhd101基因的重组酵母能够消除液体培养基中2μg/mL的ZEN,但将ZEN转化成一部分β-ZOL(β-玉米赤霉烯醇,与α-ZOL一样同为ZEN的衍生物)保留在培养基中。在之后的研究中他们利用含有酵母偏爱密码子的zhd101基因转化酵母,使该基因表达水平增加大约20倍,结果表明:含有酵母偏爱密码子的zhd101转基因酵母能完全降解培养基中2μg/mL的ZEN,并没有任何β-ZEN积累。研究还发现ZHD101蛋白能够降解ZEN、α和β-ZOL,但是降解效率不同。他们还将zhd101与增强绿色荧光蛋白基因(egfp)融合,形成egfp::zhd101,实验证明egfp::zhd101表达产物 EGFP::ZHD101与 ZHD101酶特性相近[19]。具有荧光的融合蛋白EGFP::ZHD101的成功表达,为后期的转基因实验奠定了基础。
另有一些国外报道也发现了一些对玉米赤霉烯酮有转化、降解作用的细菌和真菌。Abdulla等[21]报道,恶臭假单胞菌(Pseudomonas putida)能完全降解玉米赤霉烯酮,研究发现编码ZEN降解酶的基因位于质粒pZEA-1上,这个ZEN降解酶的最适pH和温度分别为 pH 7~8和30~37℃。Molna等[22]发现,解毒毛孢酵母(Trichosporon mycotoxinivorans)能成功地将1 mg/L ZEN降解成CO2或无荧光、无紫外吸收的物质,且代谢物中没有检测到α-ZOL、β-ZOL的存在。Varga等[23]报道了一些根霉菌(Rhizopus stolonifer,Rhizopus oryzae,Rhizopus microsporus)也能降解玉米赤霉烯酮。
国内近几年在玉米赤霉烯酮降解菌株筛选和基因克隆方面也取得了一些研究进展。中南大学分离获得了一株藤黄微球菌,发现该菌在含有0.05 mol/L MnCl2、初始 pH为 7.0的 LB培养基中,37℃,180 r/min,连续培养120 h,能降解99%的ZEN毒素(ZEN初始浓度为 2μg/mL)[24]。程波财等[25]从粉红螺旋聚孢霉中克隆到与zhd 101高度同源的基因ZEN-jjm,并进行原核表达得到ZEN降解酶。刘海燕等[26]从粉红黏帚霉中获得了与zhd101有11个碱基差异的基因zlhy-6,并在毕赤酵母中成功表达,HPLC检测经由zlhy-6基因表达的降解酶处理ZEN后没有残留,证明该降解酶对ZEN具有良好的降解能力。Yu等[27-29]报道了一种不动杆菌(Acinetobacter sp.)产生的胞外抗氧化酶可以降解ZEN,并克隆了这个酶的基因,研究发现,这种酶的最适pH和温度分别为pH 9.0和70℃。
3玉米赤霉烯酮降解基因的应用
目前为止,已被克隆的ZEN降解酶基因不多,zhd101作为研究最多的一个降解酶基因被应用于植物转基因,分别成功转化了水稻和玉米。
Takahashi等[19]报道将egfp::zhd101基因转化水稻胚盾片组织,在低pH液体培养条件下,转化细胞表现出了良好的荧光强度和ZEN降解能力,这个结果为转基因植物可以转化被污染谷物中的ZEN提供了理论依据。Higa A等[30-31]将egfp::zhd101转化水稻,融合基因能够在转基因植株T0叶片有效表达;当 T1叶片提取蛋白与 ZEN共同培育时,HPLC检测ZEN含量显著减少;而且在转基因T2种子内也检测到ZEN降解酶活性。Igawa T等[32]报道将玉米赤霉烯酮降解基因egfp::zhd101通过转基因技术在玉米中得到了表达,而且可以高效降解玉米赤霉烯酮。与非转基因玉米相比,zhd101转基因玉米植株的籽粒具有显著降解ZEN毒素的功能。试验发现转基因植株无论是在种子发育过程中还是在种子贮存过程中,都表现出对玉米赤霉烯酮的降解作用。
4 展望
真菌毒素的脱毒技术研究是保障我国粮食及饲料质量安全的一项重要而紧迫的任务。自从1966年发现ZEN以来,欧美和日本等国家对ZEN的研究从未间断过,并且受到越来越多的研究者重视,主要涉及ZEN的合成、降解、检测、毒理和防治措施等方面,近年来研究进展很快。
生物方法主要有微生物吸附和微生物降解。由于物理化学方法在应用上的弊端,生物降解ZEN已成为研究热点。目前玉米赤霉烯酮的生物降解技术研究尚存在许多不足之处:对于降解机理和降解代谢途径的研究不够深入,降解菌株存在降解能力不稳定和退化等问题。未来通过生物方法减少ZEN的危害主要将集中在以下几个研究方向:(1)深入研究ZEN生物合成途径,尤其有必要摸清ZEN在田间条件下怎样被合成,从而导致粮食污染,以从根源阻断ZEN污染;(2)筛选能将ZEN转化为无毒产物的微生物,直接应用于谷物脱毒或寻找微生物中ZEN降解基因;(3)利用微生物基因工程,将ZEN降解酶基因(如zhd101)转化大肠杆菌、酵母或其它微生物,大量生产ZEN降解酶,应用于被ZEN污染的谷物脱毒,或添加到饲料中饲养家畜,使其在动物胃肠道降解饲料中的ZEN;(4)利用植物基因工程,将ZEN降解酶基因转化禾谷类作物,使转基因种子直接降解ZEN。总之,随着人们对食品安全的日益关注,ZEN生物降解研究必将受到广泛重视。
[1]Schatzmayr G,Zehner F,Taubel M,et al.Microbiologicals for deactivating mycotoxins[J].Molecular Nutrition&Food Research,2006,50:543-551
[2]Bennett J W,Klich M.Mycotoxins[J].Clinical Microbiology Reviews,2003,16(3):497-516
[3]Zinedine A,Soriano J M,MoltóJ C,et al.Review on the toxicity,occurrence,metabolism,detoxification,regulations and intake of zearalenone:an oestrogenic mycotoxin[J].Food and Chemical Toxicology,2007,45:1-18
[4]孙长坡,代岩石,王松雪,等.利用生物技术防控、消减粮食及其制品中的真菌毒素[J].中国粮油学报,2009,24(11):97-101
[5]熊凯华,程波财,胡威,等.玉米赤霉烯酮降解的研究进展[J].中国粮油学报,2010,25(1):138-142
[6]Labuda R,Parich A,Berthiller F,et al.Incidence of trichothecenes and zearalenone in poultry feed mixtures from Slovakia[J].International Journal of Food Microbiology,2005,105:19-25
[7]Urry W H,Wehrmeister J L,Hodge E B,et al.The structure of zearalenone[J].Tetrahedron Letters,1966,27,3109-3114
[8]Flannigan B.Mycotoxins[M]//DMello J PF,Duffus C M,Duffus JH.Toxic Substances in Crop Plants.The Royal Society of Chemistry,Cambridge,1991:226-257
[9]Giuseppina A,Robert H.Assessing the zearalenone-binding activity of adsorbent materialsduring passage through a dynamic in vitro gastrointestinal model[J].Toxicity,2003,41:1283-1290
[10]D’Mello J P F,Placinta C M,Macdonald A M C.Fusarium mycotoxins:a review of global implications for animal health,welfare and productivity[J].Animal Feed Science and Technology,1999,80:183-205
[11]Etienne M,Dourmad J Y.Effects of zearalenone or glucosinolates in the diet on reproduction in sows:a review[J].Livestock Production Science,1994,44:99-113
[12]单妹,许梓荣,冯建雷.玉米赤霉烯酮对家畜繁殖性能和人体健康的影响[J].中国畜牧兽医,2006,33(1):3-5
[13]尹青岗,王锋,赵国华,等.谷物中玉米赤霉烯酮去毒方法的研究进展[J].粮食与饲料工业,2008(10):42-44
[14]El-Sharkawy S,Abul-Hajj Y.Microbial transformation of zearalenone.1.Formation of zearalenone 4-O-b-glucoside[J].Journal of Natural Products,1987,50:520-521
[15]El-Sharkawy S,Abul-Hajj Y.Microbial transformation of zearalenone.2.Reduction,hydroxylation,and methylation products[J].The Journal of Organic Chemistry,1987,53:515-519
[16]Kakeya H,Takahashi-Ando N,Kimura M,et al.Biotransformation of the mycotoxin,zearalenone,to a non-esrtogenic compound by a fungal strain ofClonostachyssp.[J].Bioscience Biotechnology and Biochemistry,2002,66(12):2723-2726
[17]Takahashi-Ando N,Kimura M,Kakeya H,et al.A novel lactonohydrolase responsible for the detoxification of zearalenone:enzyme purification and gene cloning.Biochem[J].Biochemical Journal,2002,365:1-6
[18]Utermark J,Karlovsky P.Role of zearalenone lactonase in protection ofGliocladium roseumfrom fungi toxic effects of the mycotoxin zearalenone[J].Applied and Environmental Microbiology,2007,75:637-642
[19]Takahashi Ando N,Ohsato S,Shibata T,et al.Metabolism of zearalenone by genetically modified organisms expressing the detoxification gene fromClonostachys rosea[J].Applied andEnvironmental microbiology,2004,70(6):3239-3245
[20]Takahashi Ando N,Yamaguchi I,Kimura M,et al.Efficient detoxification of zearalenone,the mycotoxin of cereal pathogen by transgenic yeasts through the expression of the synthetic lactonohydrolase gene[J].Applied Microbiology and Biotechnology,2005,67:838-844
[21]Altalhi A D,El-Deeb B.Localization of zearalenone detoxification gene(s)in pZEA-1 plasmid ofPseudomonas Putidasp strain ZEA-1 and expressed inEscherichia Coli[J].Journal of Hazardous Materials,2009,161(23):1166-1172
[22]Molnar O,Schatzmayr G,Fuchs E,et al.Trichosporon mycotoxinivoranssp.nov.,a new yeast species useful in biological detoxification of various mycotoxins[J].Systematic and Applied Microbiology,2004,27(6):661-671
[23]Varga J,Peteri Z,Tabori K,et al.Degradation of ochratoxin A and other mycotoxin by Rhizopus isolates[J].International Journal of Food Microbiology,2005,99:321-328
[24]程波财,姜淑英,汪孟娟,等.藤黄微球菌降解真菌毒素玉米赤霉烯酮的研究[J].中国生态学杂志,2010,22(5):389-392
[25]程波财,史文婷,罗洁,等.玉米赤霉烯酮降解酶基因(ZEN-jjm)的克隆、表达及活性分析[J].农业生物技术学报,2010,18(2):225-230
[26]刘海燕,孙长坡,伍松陵,等.玉米赤霉烯酮毒素降解酶基因的克隆及在毕赤酵母中的高效表达[J].中国粮油学报,2011,26(5):12-17
[27]Yu Y,Qiu L,Wu H,et al.Degradation of zearalenone by the extracellular extracts ofAcinetobacter sp.SM04 liquid culture[J].Biodegradation,2010,22:613-622
[28]Yu Y,Qiu L,Wu H,et al.Oxidation of zearalenone by the extracellular enzymes from Acinetobacter sp.SM04 into smaller estrogenic products[J].World Journal of Microbiology and Biotechnology,2011,27:2675-2681
[29]Yu Y,Wu H,Tang Y,et al.Cloning,expression of a peroxiredoxin gene from Acinetobacter sp.SM04 and characterization of its recombinant protein for zearalenone detoxification[J].Microbiological Research,2011,167(3):121-126
[30]Higa A,Kimura M,Mimori K,et al.Expression in cereal plants of genes that inactivate Fusarium mycotoxins[J].Bioscience,Biotechnology,and Biochemistry,2003,67:914-918
[31]Higa A,Takahashi-Ando N,Shimizu T,et al.A model transgenic cereal plant with detoxification activity for the estrogenic mycotoxin zearalenone[J].Transgenic research,2005,14(5):713-717
[32]Igawa T,Takahashi-Ando N,Ochiai N,et al.Reduced contamination by the Fusarium mycotoxin zearalenone in maize kernels through genetic modification with a detoxification gene[J].Applied and Environmental Microbiology,2007,73(5):1622-1629.
