基于酶解后乙醇萃取香草兰净油的GC-MS分析
2013-03-20谷风林谭乐和卢少芳赵建平
徐 飞 初 众 谷风林 谭乐和 卢少芳 赵建平
(中国热带农业科学院香料饮料研究所国家热带重要作物工程技术研究中心农业部香辛饮料作物遗传资源利用重点实验室,万宁 571533)
香草兰(Vanilla planifolia Andrews)是热带多年生大型肉质藤本攀援植物,素有“食品香料之王”的美誉,是我国重要的热带香薰作物之一[1]。原产于南美洲的墨西哥,现广泛种植于南、北纬20°之间的热带地区,种植国家涉及马达加斯加、科摩罗、留尼汪等国,总种植面积达3.3万~3.5万hm2。世界年总产量约2 500 t左右,总产值达100多亿元,在世界热带农业经济、国际贸易和人类生活中具有极其重要的作用。目前主要在海南、云南地区有加工,其加工需要经过清洗、发酵、干燥、陈化达4~6月以上才能具有浓郁的香味,豆荚经加工后的初产品香兰荚,俗称香兰豆,含有250多种挥发性香气成分。豆荚提取物为香草兰净油,具有沁人心脾的独特香气,广泛应用于调制高级香烟、名酒、各类糕点、化妆品等。此外,它还具有强心、补脑、健胃等药效[2]。
香草兰净油中主要香气成分为香兰素,而目前在国内外大部分食品、化妆品添加的为化学合成的香兰素,化学合成的香兰素大剂量可导致头痛、恶心、呕吐等症状,因此天然香兰素的提取能较好的解决以上问题。传统提取香草兰净油的方法主要有:溶剂浸提法、超临界CO2萃取法、程序增压萃取法等。但一般的有机溶剂浸提方法提取率较低,提取时间较长,而超临界CO2萃取方法与程序增压萃取法成本较高,因此本课题通过研究在不同的时间纤维素酶酶解作为预处理,结合溶剂萃取方法萃取香草兰净油,对所得的香草兰净油利用GC-MS分析其组分及其相对含量。为进一步制作香草兰高级调味品、化妆品提供一定的数据参考。
1 材料与方法
1.1 材料
香草兰由中国热带农业科学院香料饮料研究所提供,采收成熟后的香草兰豆荚经杀青、发酵、干燥、陈化生香后低温烘干,粉碎,过40目筛,得香草兰干粉,备用。纤维素酶(Cellulase,绿色木酶,酶活力>15 u/mg):上海伯奥生物科技有限公司。
1.2 仪器和设备
7890AGC-5975CMS气质联用仪:美国 Agilent公司;HS-100型自动进样器:瑞士 CTC公司;Z36HK型超速冷冻离心机:德国 Hermle;IKAWERKE磁力搅拌器:德国IKA公司;RV10型旋转蒸发仪:德国IKA公司。
1.3 香草兰净油提取方法
根据文献中报到的方法略作修改[3],称取香草兰干粉10 g(含水率12.4%)置于锥形瓶中,加入50 mL 0.2 mol/L pH=4.8醋酸-醋酸钠缓冲溶液(其1 000 mL醋酸-醋酸钠缓冲液中溶解酶量0.5 g)。酶解温度保持在45℃,磁力搅拌下酶解,酶解一定时间后加入一定量的乙醇,搅拌浸提过夜。所得浸提液过滤后旋转蒸发,直到乙醇溶液不再蒸出得到褐色浸膏,加入70℃热乙醇在-10℃以下冷冻3 h后过滤除去油树脂,再次蒸发到无乙醇流出为止,收集得到净油。所得净油加入2 mL乙醇和4 mL正己烷溶解后加少量无水硫酸钠除去水分,离心(6 000 r/min,15 min)。样品进行 GC-MS分析。
1.4 香草兰净油成分的GC-MS分析方法
GC/MS条件:进样口温度是270℃;柱初始温80℃,保持2 min,以10℃/min升温至160℃,然后以5℃/min程序升温到270℃,并保持50 min。载气为氦气;流量1.2 mL/min;不分流进样,进样量为1μL。毛细管柱:HP-5MS(Agilent19091S-433)30.0 m×250.0μm×0.25μm。质谱条件:离子源为EI源模式,电子轰击能量70 eV,离子源温度为250℃,接口温度280℃,扫描范围:40~450 amu。色谱库NIST08。积分开始时间为3.5 min,以避免溶剂峰。
2 结果与分析
2.1 不同酶解时间香草兰净油色谱图
不同酶解时间条件下预处理后乙醇萃取香草兰净油色谱图见图1,由图1可见,6 h酶解得到的化合物种类较多,且在不同的酶解时间下同一保留时间净油中主要化学成分较为相似[4]。随着时间的延长,其化合物种类逐渐的减少,可能由于在高温下,易挥发性的香味物质容易散失[5-6],因此想要得到较多的化学物质选择合适的酶解时间比较关键。因为试验是利用不同时间酶解后,再用乙醇萃取分级提纯得到净油,且植物中纤维质量分数达14.7%,故选用纤维素酶酶解,酶解时间的不同直接关系到成分变化的状况。
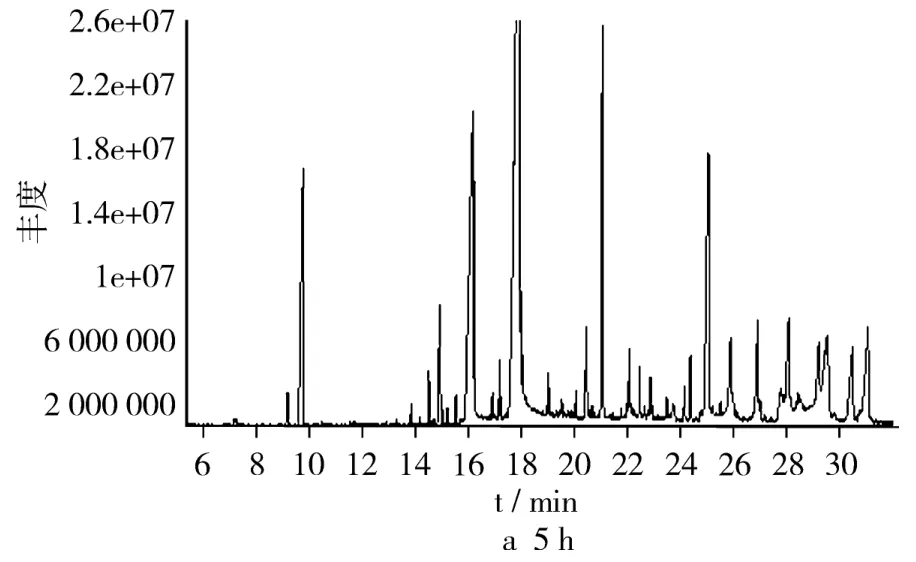
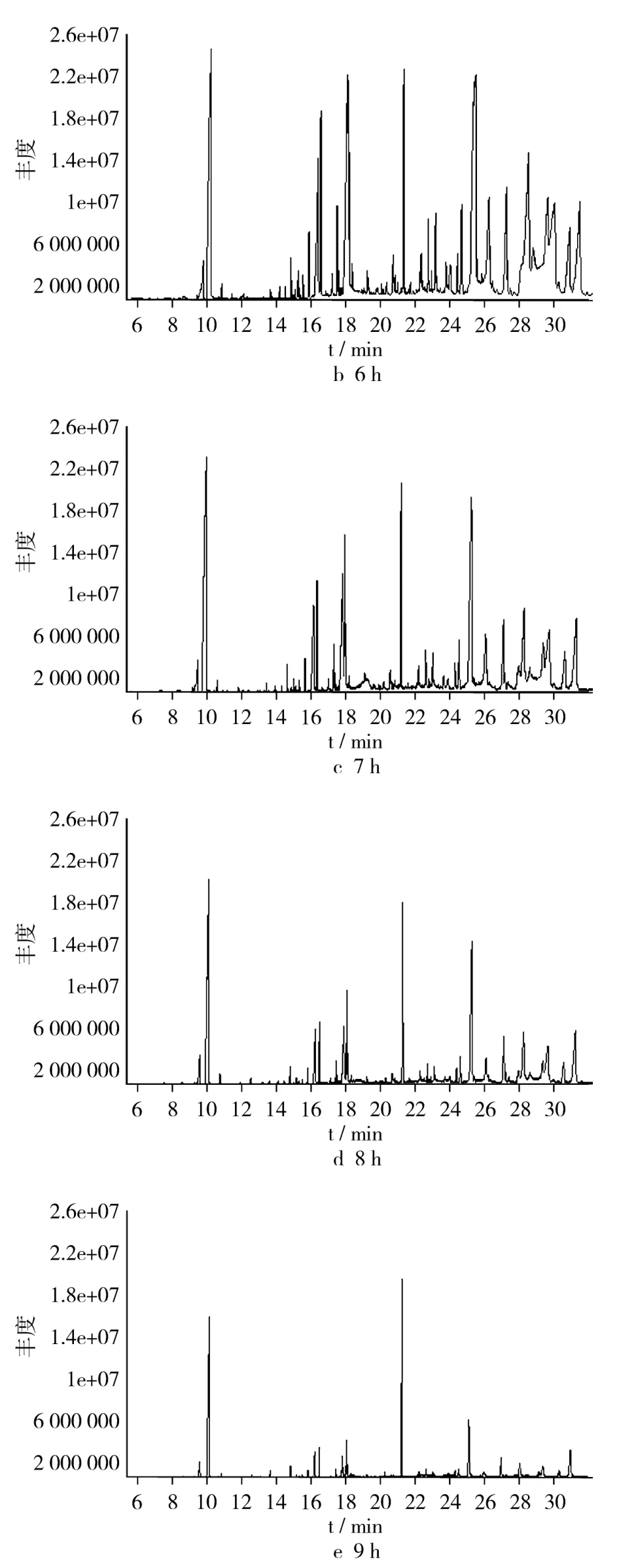
图1 不同酶解时间后萃取得到的香草兰净油色谱图
2.2 同酶解时间香草兰净油GC-MS分析
通过GC/MS图谱扫描,利用手动积分模式对各物质进行积分,将峰面积表示其含量,做y轴,用不同酶解时间作为x轴,表示香草兰净油中风味物质在不同酶解时间过程中含量变化趋势,各组样品中各物质峰面积累加,通过各物质峰面积之和变化,可以看出香草兰净油在不同酶解过程中其组分发生不同程度的变化,具体趋势见图2。

图2 不同酶解时间得到的香草兰净油峰面积变化
从图2中可以看出,香草兰在酶解6 h时其峰面积总和达到最高,之后随着时间的延长,物质含量逐渐下降,这可能是由于纤维素酶在酶解纤维时,其新物质产生的同时也存在一定的挥发性散失,当物质含量达到最大时,随着时间的延长其物质散失速度越快,因此在时间最长9 h的情况下得到的物质峰面积含量最少。
2.3 不同酶解时间下各物质检出数量
不同酶解时间下的各样品,经过正己烷萃取,添加无水硫酸钠去除所含水分,低温超速离心等工艺,利用GC/MS扫描分析,在30~450 amu的扫描范围下,采用自动积分模式,并用手动积分模式修正自动积分中存在的明显错误,各样品扫描出风味物质数量见图3。
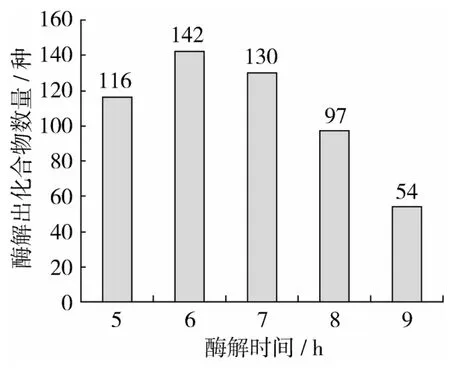
图3 不同酶解时间下各物质检出比较
酶解不同时间做预处理,溶剂萃取的净油检出化合物数量比较,发现在6 h时检查化合物数量最多,即表示在酶解6 h时香草兰净油中含量较多的风味物质,但是随着时间的延长净油中化合物逐渐减少,表明酶解时间越长,挥发性物质损失越多,几乎减少一半,说明香草兰净油中易挥发香气物质较多。因此,选择合适的酶解时间能更好的得到香味浓郁的净油。
2.4 不同酶解时间下峰面积比较及香兰素相对含量
香兰素是香草兰中主要香气物质之一,从图4可以看出,随着酶解时间的延长,香兰素含量呈现逐渐增加的趋势。而各时间下其峰面积总和却是在6 h之后呈现下降趋势,说明虽然随着酶解时间的延长,其物质含量有所减少,但是酶解时间对香兰素影响不大。
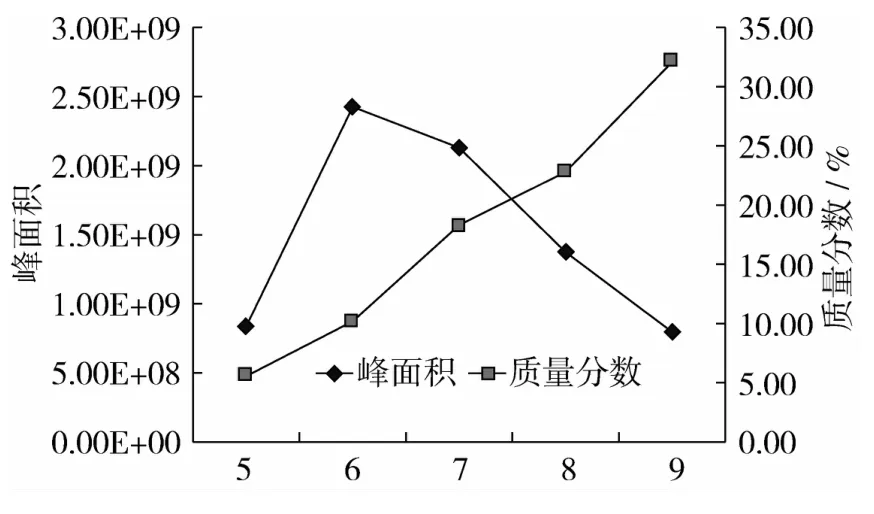
图4 不同酶解时间下峰面积比较及香兰素相对含量
2.5 不同时间酶解下主要化合物及相对含量
各净油样品经计算机检索、人工解析及与标准谱图对照,选出其中主要的14种风味成分。以面积归一化法测定其相对含量[7-8],结果见表1。
从表1中可以看出,不同酶解时间作为预处理,其他条件相同萃取得到的香草兰净油在相同保留时间下所含组分基本相同,选择了5种不同时间下相对含量较多的14种化合物成分进行分析,得到醛类:香兰素、环丙基甲醛,相对含量在8~9 h时相对含量较高;酸类:正十六酸、亚油酸,酸类在5 h时相对含量较高;酯类:正十六酸乙酯、亚油酸乙酯、1,2-苯二甲酸单(2-乙己基)酯、16-甲氧基-14-氧化十六碳-15烯酸甲酯、噻吩-2-甲酸-4甲基戊基酯;酯类物质没有统一的酶解时间,不同的时间下不同的物质相对含量具有一定的差别;烷烃类:十四烷基环辛烷;烷烃类在9 h时相对含量较高;醇类:芸苔甾醇;醇类在6 h时相对含量较高;杂环类:2,4-二羟基吡啶;杂环类在8 h时相对含量较高;酮类:2-噻酚环丙基甲酮、2,4-噻唑烷二酮。酮类在6 h时相对含量较高。利用不同酶解时间作为预处理,其他条件相同萃取得到的香草兰净油相同保留时间下所含组分基本相同,其中这14种化合物为香草兰净油中的主要化学组分,其相对含量占总含量的50%以上。但是不同的酶解时间下相对含量相差较大。
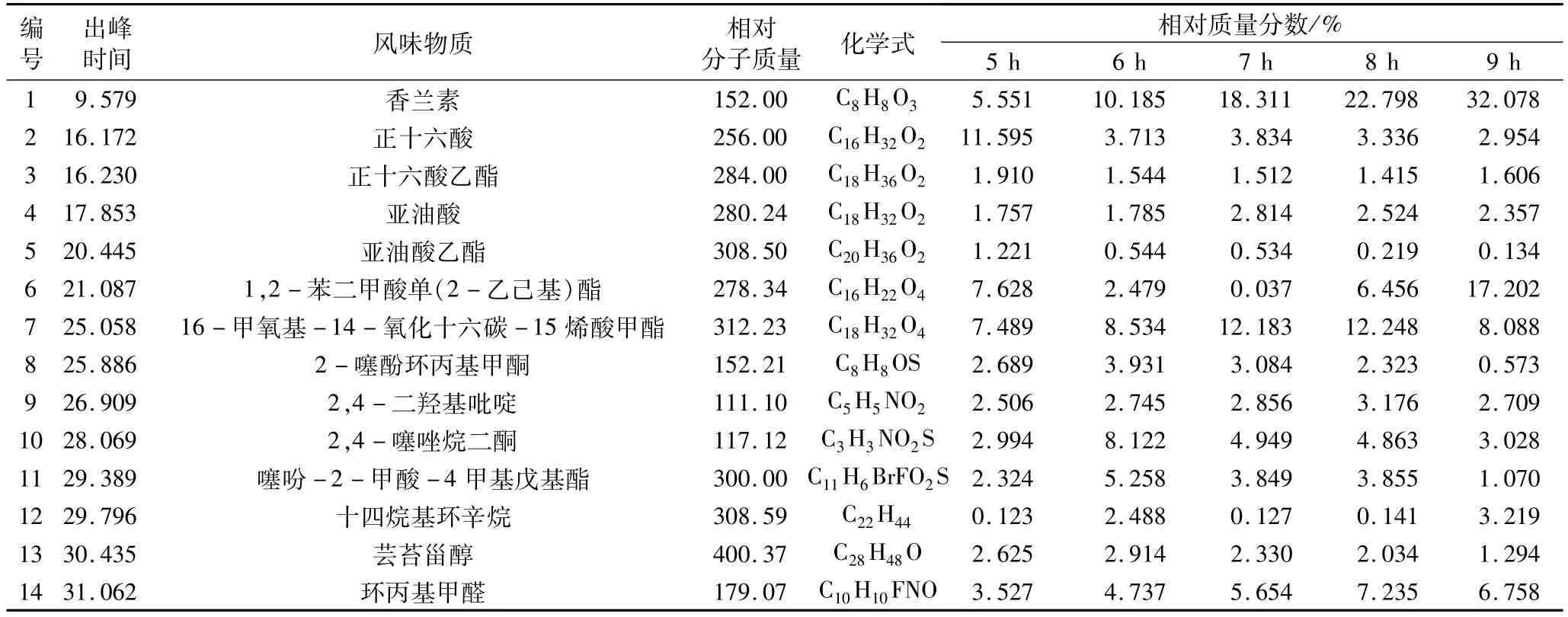
表1 不同酶解时间下香草兰净油风味物质及相对含量比较
本试验是应用酶法冷浸出法提油工艺,主要利用酶类对油料细胞的降解作用使细胞结构破坏而有利于油的提取,由于酶解条件温和、温度较低,因而不仅能耗明显低于传统方法,更主要的是油料中蛋白质等成分性能能很好的保持,达到同时利用油脂和蛋白质等有效成分的目的,油料不经高温处理,所提油脂的品质明显提高,得油率也高;另外,油料中存在脂蛋白和脂多糖,不仅阻碍油脂的提取,而且这些复合物本身会对油分子起包埋作用,传统的热处理难以打破这种包埋,而通过酶法能降解复合物,释放油脂;应用酶法还能解决油脂提取常规方法中的乳化问题,破坏其中起两性作用的物质[9]。如蛋白、果胶、磷脂等,使得主要成分保持较好,但所需酶量较大,必须考虑经济上切实可行,使用产量大、价格低的酶种是以后发展的趋势。
3 结论
3.1 采用纤维素酶酶解作为预处理,溶剂法萃取香草兰净油,改变酶解时间,其他条件相同时,所得到的5种香草兰净油进行GC-MS分析,5种香草兰净油在同一保留时间下组成成分基本一致。香草兰净油中含量最高的14种主要成分分别为:香兰素;正十六酸、正十六酸乙酯、亚油酸、亚油酸乙酯、1,2-苯二甲酸单(2-乙己基)酯、16-甲氧基-14-氧化十六碳-15烯酸甲酯、2-噻酚环丙基甲酮、2,4-二羟基吡啶、2,4-噻唑烷二酮、噻吩-2-甲酸-4甲基戊基酯、十四烷基环辛烷、芸苔甾醇、环丙基甲醛。
3.2 在不同酶解时间作为预处理,其他条件相同萃取得到的香草兰净油在相同保留时间下所含组分基本相同,其中这14种化合物为香草兰净油中的主要化学组分,其相对质量分数为50%以上。但是在不同的酶解时间下相对含量相差较大。
3.3 酶法具有条件温和、温度较低,不经高温处理,所提油脂的品质较高;另外,能降解复合物、释放油脂、解决油脂提取常规方法中的乳化问题,破坏其中起两性作用的物质如蛋白、果胶、磷脂等,使得主要成分保持较好,但所需酶量较大,必须考虑经济上切实可行,使用产量大、价格低的酶种是以后发展的趋势。
[1]Bernd Schwarz,Thomas Hofmann.Identification of Novel Orosensory Active Molecules in Cured Vanilla Beans(Vanilla planifolia).Journal of Agricultural and Food Chemistry,2009,57,3729-3737
[2]陈德新.香荚兰[M].北京:中国林业出版社,2009:6-7
[3]刘晓庚,鞠兴荣,茆旭东,等.酶法提取松针精油的实验室研究[J].林产化学与工业,2005,25(3):111-114
[4]黄惠芳,梁立娟,农耀京,等.不同温度条件下超临界萃取姜黄油 GC-MS分析[J].食品科技,2011,36(2):270-272
[5]Henryk HJ,Krystian W,Erwin W,et al.Solid-phase microextrac-tion for the analysis of some alcohols and esters in beer:compari-son with static headspace method[J].Journal of Agricultural and Food Chemistry,1998,46(4):1469-1473
[6]Alexandra S,Janusz P.Analysis of flavor volatiles using headspace solid-phase microextration[J].Journal of Agricultural and Food Chemistry,1996,44(8):2187-2193
[7]刘晓艳,白卫东,黄玩娜.柿子果酒香气成分的GC-MS分析[J].酿酒,2011,38(1):52-55
[8]李洪玉,寿旦,李亚平,等.不同产地马尾松针挥发油的GC-MS分析[J].中华中医药学刊,2011,29(1):78-80
[9]钱俊青,谢祥茂.酶法提取植物油的工艺方法及特点[J].中国油脂,2003,28(4):14-17.
