罗非鱼鱼鳞明胶蛋白膜的制备及特性
2013-03-13吴菲菲翁武银苏文金曹敏杰刘光明
吴菲菲,翁武银,苏文金,曹敏杰,刘光明
(集美大学生物工程学院,福建厦门361021)
目前用于食品包装的材料大部分为塑料制品,但塑料垃圾在自然界中不易分解腐烂,给生态环境造成了严重的危害。而且在食品加工贮藏过程中,塑料中残留的一些添加剂、增塑剂等可能会由包装袋向内装食品迁移,给食品带来安全隐患[1]。因此,国内外众多学者开始致力于可食性或可降解性包装膜的研究,探寻可部分替代塑料包装的材料,减少环境污染。可食膜的制备、性能改良及其应用研究表明,利用蛋白质制备的可食膜不仅具有良好的机械性能,而且氧气阻隔性能也比多糖类可食膜和脂类可食膜优越[2-3]。其中,明胶由于具有丰富的原料来源和良好的成膜性能,作为蛋白可食膜的制备原料日益受到重视。目前明胶的生产原料主要为猪、牛的皮和骨,但由于对疯牛病、口蹄疫的恐慌以及宗教信仰等原因,研究人员开始尝试利用水生动物资源的下脚料提取明胶制备可食膜。另一方面,近年来我国水产品加工业得到迅速发展,2010年加工总量已超过1600万t,其中鱼糜制品年产量接近100万t,罗非鱼年加工量达到60万t左右[4]。在鱼糜加工和冷冻鱼片生产过程中,必然会产生大量的鱼皮、鱼鳞等下脚料。然而,这些下脚料目前主要被用于生产鱼粉等低附加值产品,部分鱼鳞甚至被作为废弃物直接丢弃,不仅浪费资源,也给环境造成污染。虽然利用鱼类下脚料中丰富的蛋白资源制备可食膜已引起广泛的关注,但主要集中在鱼皮明胶蛋白膜的研究上[5-8],关于利用含钙组织如鱼鳞制备明胶蛋白膜的研究还鲜见报道。因此,本研究利用罗非鱼鱼鳞制备明胶蛋白可食膜,考察了鱼鳞明胶的提取温度与时间以及甘油的添加对明胶蛋白膜理化性质的影响,探究鱼鳞明胶的成膜性能,为鱼鳞的综合利用开辟新的途径。
1 材料与方法
1.1 材料与仪器
新鲜的罗非鱼鱼鳞 福建厦门同安源水水产食品有限公司;甘油 国药集团化学试剂有限公司;无水乙醇、氢氧化钠 广东光华化学厂有限公司;盐酸西陇化工股份有限公司;DC蛋白测定试剂盒 美国Bio-Rad公司;分子量标准物 美国Fermentas公司。
Avanti J-25高速冷冻离心机 美国Beckman公司;UM113型搅拌脱泡机 日本Unix有限公司;PSX智能型恒温恒湿箱 浙江宁波莱福科技有限公司;厚度仪 日本Ozaki MFG公司;TMS-PRO质构仪 美国Food Technology公司;UV-2600A型紫外分光光度计 上海元析仪器有限公司;WSC-S测色色差计 上海精密科学仪器有限公司;DSC-Q2000型 美国TA仪器公司。
1.2 实验方法
1.2.1 鱼鳞的前处理 新鲜的罗非鱼鱼鳞利用3倍原料重量的0.05mol/L NaOH-25%酒精-1.5%H2O2溶液浸渍24h后,用清水漂洗至中性,再加入3倍原料重量的0.05mol/L HCl溶液于室温下搅拌浸渍2h,然后用清水漂洗至溶液的pH接近中性,沥干后冷冻干燥,于-37℃冰箱中保存用作以下实验的原料。
1.2.2 明胶蛋白的提取和组分分析 鱼鳞明胶蛋白的提取参考Jongjareonrak等[8]报道的方法并做些许改动。精确称取2g左右前处理过的鱼鳞,加入50mL蒸馏水,利用热水浴(60、80、100℃)浸提一段时间后,用冰水浴冷却至室温,通过离心(15000×g,20℃,15min)获得明胶蛋白溶液。提取液中的明胶蛋白含量和鱼鳞中的总蛋白含量根据凯氏定氮法[9]进行测定,鱼鳞明胶蛋白的提取率为提取的明胶蛋白含量(g)占鱼鳞中总蛋白含量(g)的比例。此外,明胶蛋白的分子量分布利用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析。
1.2.3 明胶蛋白膜的制备 明胶蛋白膜参考翁武银等[10]报道的方法进行制备。将明胶蛋白溶液的浓度调配成2%(w/v),并添加蛋白质量20% (w/w)的甘油,利用搅拌脱泡机对其进行脱泡后,将制备的溶液(4g)倒在5cm×5cm的有机硅树脂框内,放在(25±1)℃、相对湿度(RH)50%±5%的恒温恒湿箱中干燥24h后制备成明胶蛋白膜,揭膜后继续放在恒温恒湿箱中平衡48h,作为以下实验的测试样品。
另外,为了考察甘油对鱼鳞明胶蛋白膜性质的影响,在2%鱼鳞明胶蛋白溶液中添加蛋白质量20%~50%的甘油,然后按照上述方法制备成明胶蛋白膜。
1.2.4 机械性能的测定 将切成宽15mm、长45mm的明胶蛋白膜用厚度仪测定厚度后,利用质构仪对膜进行拉伸实验,力量感应元为100N,初始间隔为30mm,拉伸速率为1mm/s。明胶膜的抗拉伸强度(TS)和断裂伸长率(EAB)根据翁武银等[10]报道的方法进行计算。
1.2.5 水蒸汽透过率的测定 明胶蛋白膜的水蒸汽透过率(WVP)参照ASTM提供的方法进行测定[11]。在瓶口内径为2.2cm、容积为50mL的PET瓶中加入约40g完全干燥的硅胶,用明胶蛋白膜封紧瓶口,然后将PET瓶置于温度为30℃、RH为100%的玻璃干燥器中,每隔1h测定PET瓶的重量。膜的WVP根据翁武银等[10]报道的方法按以下公式进行计算。

式中,t为测定时间(s),w为t时间内瓶重变化量(g),x为膜的厚度(m),A为瓶口表面积(m2),ΔP为瓶内外的水蒸汽压差(Pa)。
1.2.6 颜色和透光率的测定 明胶蛋白膜的颜色利用色差计进行测定,膜的颜色以参数L*(黑-白)、a*(绿-红)、b*(蓝-黄)的值表示。膜的透光率和透明度值按照Hoque等[12]的方法进行测定,利用紫外分光光度计测定明胶膜在200~800nm波长范围内的透光率,膜的透明度值按以下公式进行计算:
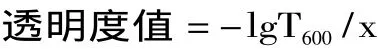
式中,T600为膜在600nm波长下的透光率,x为膜的厚度(mm),透明度值越高表示蛋白膜越不透明。
1.2.7 SDS-PAGE SDS-PAGE根据Laemmli[13]的方法进行测定,其中浓缩胶和分离胶的浓度分别为4%和6%。提取的鱼鳞明胶蛋白和制备的明胶蛋白膜利用8mol/L尿素-2%SDS-20mmol/L Tris-HCl (pH8.8)蛋白变性剂进行溶解后制备成蛋白浓度为1μg/μL的电泳样品,每个泳道加入10μL的电泳样品,在10mA下进行电泳,电泳结束后用考马斯亮蓝R-250染色液染色,再用脱色液(甲醇/乙酸/水为3/1/6,v/v/v)脱色至背景完全透明为止。
1.2.8 差示扫描量热分析(DSC) 利用差示扫描量热仪测定明胶膜的热力学性质,仪器采用金属铟进行校正。明胶膜先用液氮研磨成粉末,并放置在硅胶干燥器中干燥一周,获得的样品用于DSC分析和水分含量测定。DSC分析时,准确称取20mg左右上述样品放入坩埚中,以Al2O3粉末作为参比,系统用液氮冷却后,以10℃/min的升温速率从-90℃开始升温至200℃后快速降温,在-90℃平衡后,再以10℃/min的升温速率升温至200℃,得到第二循环的DSC结果。利用DSC配套的数据处理软件对DSC曲线进行分析,明胶膜的玻璃化转变温度(Tg)为转变斜线的中点所对应的温度。粉末样品的水分含量利用常压干燥法[14]进行测定。
1.2.9 数据统计与分析 采用SPSS 17.0软件(SPSS Inc,Chicago,IL,USA)对所得数据进行方差分析(ANOVA),显著性检验方法为Duncan多重检验,显著水平为0.05[15]。
2 结果与分析
2.1 浸提温度与时间对明胶蛋白提取率的影响
图1显示了浸提温度与时间对鱼鳞明胶蛋白提取率的影响。由图可知,浸提时间相同时,60℃下明胶蛋白的提取率最低,80℃次之,100℃最高,表明提高浸提温度可以促进明胶蛋白从鱼鳞中溶解出来。而且,不管在哪一个浸提温度下,鱼鳞明胶蛋白的提取率均随浸提时间的延长逐渐增大,并在浸提时间超过4h后逐渐趋于平衡。胶原是由3条α肽链缠绕形成的三股螺旋结构,相对分子量大约为300ku[16]。在热水作用下,维系胶原3股螺旋结构稳定的分子内/分子间氢键等次级键及部分肽键断裂,胶原的β肽链、α肽链及其聚集体和降解组分溶解到水中[17],而且提高温度会促进胶原变性转换成明胶,加速明胶蛋白的溶解。因此,鱼鳞明胶蛋白提取率随浸提温度的升高和浸提时间的延长逐渐增加(图1)。
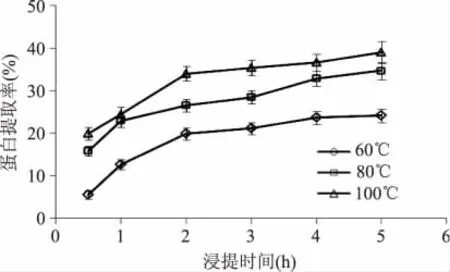
图1 浸提温度与时间对罗非鱼鱼鳞明胶蛋白提取率的影响Fig.1 Effect of extraction temperature and time on the extraction yield of gelatin from tilapia scales
2.2 浸提温度与时间对明胶蛋白组分的影响
利用SDS-PAGE对不同温度和时间提取的明胶蛋白进行分析,结果如图2所示。利用60℃浸提时,加热0.5h和1h提取的明胶蛋白中除了β肽链、α1肽链和α2肽链以外,还出现了两条分子量分别为160、80ku左右的蛋白条带。然而,随着浸提时间的延长,α肽链及其以上的蛋白组分发生明显的降解,分子量小于80ku的蛋白组分逐渐增多(图2),表明经过前处理后鱼鳞粗胶原蛋白中可能残留一些蛋白酶,导致明胶蛋白在浸提过程中发生降解。Jongjareonrak等[8]也报道了大眼鲷鱼皮中存在基质金属蛋白酶,添加胰蛋白酶抑制剂或EDTA能够抑制明胶蛋白在60℃提取时发生降解。当浸提温度提高至80℃时,加热1h以内提取的明胶蛋白中也会观察到160ku和80ku左右的这两条蛋白条带,但与60℃提取时的相比,条带浓度明显减少。而浸提3h以上的明胶蛋白中未观察到这些蛋白降解物,但β肽链和α肽链的条带浓度却出现一定程度的下降,同时小分子物质(<α2)逐渐增多(图2)。这可能是在80℃水浴升温过程中,残留的蛋白酶导致明胶蛋白发生一定程度降解。当浸提时间超过3h后酶解产物和高分子组分(>α2)由于热分解作用而发生降解,但相对60℃提取的明胶其β肽链和α肽链的降解明显受到抑制。而鱼鳞在100℃下浸提0.5h时,得到的明胶蛋白中几乎未发现160ku和80ku左右的蛋白降解物(图2),表明了鱼鳞内源性蛋白酶在100℃下易失活。但100℃却促进了明胶在高温下的热分解,当浸提时间达到3h以上时,β肽链和α肽链的条带基本上在电泳图谱中消失(图2)。以上结果表明,80℃水浴最适合用于提取罗非鱼鱼鳞明胶蛋白,得到的明胶蛋白中β肽链和α肽链组分被分解的程度最小。
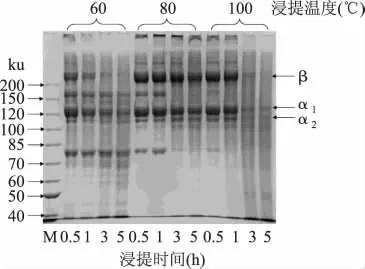
图2 浸提温度与时间对罗非鱼鱼鳞明胶蛋白组分的影响Fig.2 Effect of extraction temperature and time on the protein patterns of tilapia scale gelatin
2.3 提取工艺对明胶蛋白膜性质的影响
2.3.1 浸提温度对蛋白膜性质的影响 为了考察浸提温度对鱼鳞明胶蛋白膜机械性能和阻湿性能的影响,利用蛋白组分较接近(浸提0.5h,图2)的明胶蛋白作为原料制备可食膜,并对其机械性能和水蒸汽透过性能进行测定(表1)。结果发现,以80℃提取的明胶蛋白为原料制备的可食膜其抗拉伸强度(TS)最高,100℃次之,60℃最低。通常,明胶蛋白膜的机械性能与成膜明胶蛋白的分子量分布相关,高分子量成分含量越多,膜的TS越高[8]。在80℃和100℃下提取的明胶蛋白中不仅含有大量的β肽链和α肽链,还含有一些分子量大于β肽链的高分子多聚体,而60℃浸提的明胶蛋白中分子量低于α肽链的蛋白降解组分明显较多(图2),因此利用80℃和100℃浸提的明胶可以获得具有较高机械强度的蛋白膜(表1)。另一方面,提高明胶蛋白的浸提温度,鱼鳞明胶蛋白膜的EAB随之增加(表1)。这可能是随着浸提温度的升高,明胶蛋白充分受热变性,分子链逐渐展开,在成膜过程中能够有效地缠绕,从而使形成的明胶蛋白膜具有更好的延展性和柔韧性,宏观上表现为膜的EAB值增大。

表1 浸提温度对鱼鳞明胶蛋白膜的抗拉伸强度(TS)、断裂延伸率(EAB)和水蒸汽透过率(WVP)的影响Table 1 Effect of extraction temperature on the tensile strength(TS),elongation at break(EAB)and water vapor permeability(WVP)of edible films based on tilapia scale gelatin
表1还显示了利用不同温度提取的明胶制备的蛋白膜其水蒸汽透过率(WVP)的测定结果。由表可知,鱼鳞明胶蛋白膜的WVP值为1.12~1.46×10-10g· m-1·s-1·Pa-1,80℃提取制备的蛋白膜其WVP略高于60℃与100℃。主要原因是:60℃提取的明胶蛋白中小分子蛋白降解物较多(图2),在成膜过程中这些小分子物质填充到膜网络结构的孔隙中,从而增强了膜阻碍水分子穿透的能力;而明胶蛋白分子在100℃下得到充分伸展,形成的蛋白膜的网络结构更为紧密,导致膜的WVP值较低。
2.3.2 浸提时间对蛋白膜性质的影响 由于80℃浸提的明胶蛋白成膜性能最好(表1),因此以80℃为浸提温度,考察了浸提时间对鱼鳞明胶蛋白膜机械性能和阻湿性能的影响,结果列于表2中。当鱼鳞明胶蛋白提取时间较短时(<1h),以其为原料制备的蛋白膜的TS值最大,并且高于蓝鲸鱼皮明胶蛋白膜(27.29MPa)[5]和大眼鲷鱼皮明胶蛋白膜(28.28MPa)[8],类似于红鲷鱼皮明胶蛋白膜(41.09MPa)[8]。然而,进一步延长浸提时间,明胶蛋白膜的TS明显下降(表2),表明了在80℃下短时间浸提的罗非鱼鱼鳞明胶蛋白具有较好的成膜性能。当浸提时间达到3h以上时,明胶蛋白发生热分解(图2),导致形成的鱼鳞明胶蛋白膜的TS下降(表2)。另一方面,鱼鳞明胶蛋白膜的EAB和WVP随浸提时间的延长分别呈上升和下降趋势(表2),进一步表明了充分受热的明胶蛋白容易形成EAB高而WVP低的蛋白膜。

表2 浸提时间对鱼鳞明胶蛋白膜的抗拉伸强度(TS)、断裂延伸率(EAB)和水蒸汽透过率(WVP)的影响Table 2 Effect of extraction time on TS,EAB and WVP of edible films based on tilapia scale gelatin
根据图1、图2和表1、表2的结果可知,利用80℃加热1h提取罗非鱼鱼鳞明胶,不仅可以获得较高的蛋白提取率,而且得到的明胶蛋白具有良好的成膜性能,因此,利用80℃浸提1h的明胶为原料,详细考察甘油添加量对鱼鳞明胶蛋白膜性质的影响。
2.4 甘油添加量对鱼鳞明胶蛋白膜性质的影响
2.4.1 甘油添加量对明胶膜机械性能与阻湿性能的影响 表3显示了甘油添加量对鱼鳞明胶蛋白膜TS、EAB和WVP的影响。随着甘油添加量的增加,明胶蛋白膜的TS逐渐下降,EAB逐渐上升(表3)。甘油是亲水性小分子,容易进入到明胶蛋白分子链之间并与明胶蛋白分子中的亲水基团形成氢键,从而使得明胶蛋白分子间的相互作用力减弱,结果导致膜的脆性降低,柔韧性增强。然而,即使当甘油添加量增加到蛋白含量的50%时,本研究制备的鱼鳞明胶蛋白膜的TS还可达到16.45MPa,与塑料包装低密度聚乙烯膜的抗拉伸强度(16.5MPa)类似[18],进一步表明利用罗非鱼鱼鳞提取的明胶蛋白具有良好的成膜性能。另一方面,由于甘油的亲水特性,其含量增多会使明胶蛋白膜的吸湿性增强,WVP值上升(表3)。表 3中的结果表明,甘油添加量较低(20%)时,明胶蛋白膜可获得较好的抗拉伸性能及阻湿性能,但提高甘油含量却可以改善明胶蛋白膜的柔韧性。因此,可以根据实际需要改变甘油添加量以扩大明胶蛋白膜的应用范围。

表3 甘油添加量对蛋白膜的抗拉伸强度(TS)、断裂延伸率(EAB)和水蒸汽透过率(WVP)的影响Table 3 Effect of glycerol content on TS,EAB and WVP of gelatin films prepared from tilapia sclaes
2.4.2 甘油添加量对明胶膜颜色和透明度的影响 甘油对鱼鳞明胶膜颜色及透光性能的影响如表4所示。由表可知,改变甘油添加量,明胶膜的L*、a*、b*值未发生明显的变化,且均与白板的参数值(L*=91.86,a*=-0.88,b*=1.42)接近,表明利用罗非鱼鱼鳞制备的明胶蛋白膜在外观上几乎无色,而且甘油对明胶蛋白膜的颜色没有显著影响。另一方面,明胶蛋白膜的透明度值随甘油含量的增加逐渐降低,表明甘油的添加增强了蛋白膜的透光性能。可能是甘油作为小分子增塑剂容易进入明胶蛋白分子之间,导致单位面积内蛋白分子数目相对减少,使光线容易透过,因此提高了明胶蛋白膜的透光性能。姜燕等[19]也报道了甘油比其他增塑剂更容易增强蛋白膜的透光性能。

表4 甘油添加量对鱼鳞明胶蛋白膜颜色和透明度的影响Table 4 Effect of glycerol content on the color and transparency value of gelatin films prepared from tilapia scales
2.4.3 甘油对明胶膜蛋白组分的影响 甘油添加量对鱼鳞明胶膜蛋白组分的影响如图3所示。成膜溶液和明胶膜的主要蛋白组分均与明胶原料(80℃,1h;图2)一致,甘油的添加没有使成膜溶液和明胶膜中的蛋白组分发生明显的变化(图3)。可能是由于甘油在成膜过程中通过与明胶蛋白分子形成链间氢键而起到增塑作用,而氢键在制备电泳样品时容易被破坏,因此无法在SDS-PAGE图谱中体现。甘油对蓝鲸鱼皮明胶膜蛋白组分的影响也显示了与本文类似的结果[5]。然而,在图3中却观察到明胶蛋白膜中β肽链和α肽链的条带浓度明显低于成膜溶液,而160ku和80ku处的酶解产物含量明显增多,可能是经80℃加热1h未完全失活的蛋白酶在成膜过程(RH=50%,25℃干燥)中导致明胶蛋白发生了进一步的降解。
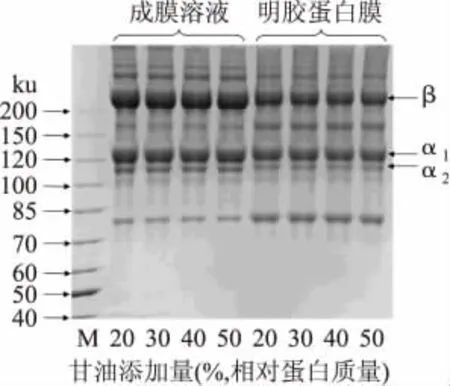
图3 甘油对明胶蛋白膜蛋白组分的影响Fig.3 Protein patterns of tilapia scale gelatin films with different glycerol concentration
2.4.4 甘油对明胶膜热稳定性的影响 图4显示了不同甘油添加量的鱼鳞明胶蛋白膜的DSC曲线和水分含量的测定结果。由图可知,当甘油添加量为20%时,鱼鳞明胶蛋白膜的玻璃化转变温度(Tg)可达113.97℃,高于甘油添加量为25%的大眼鲷鱼皮明胶膜(Tg=72.97℃)[8]和红鲷鱼皮明胶膜(Tg= 91.58℃)[8],与相同甘油添加量的牛皮明胶膜(Tg= 111.0℃)[20]相当,表明罗非鱼鱼鳞制备的明胶蛋白膜具有与牛皮明胶膜类似的热稳定性。从图4还可获知鱼鳞明胶蛋白膜的Tg随甘油含量的增加逐渐降低,这一结果与甘油对猪皮明胶膜热稳定性影响的报道一致[21]。甘油作为亲水性增塑剂,与明胶蛋白分子链上的亲水基团形成氢键,从而使得相邻大分子间的作用力减弱,膜网络结构的稳定性降低。此外,由于甘油的亲水特性,提高甘油添加量使得明胶蛋白膜中水分含量明显增多(图4)。而水分子在蛋白膜中同样可以起到增塑剂的作用[22],水分含量的增加进一步削弱了明胶蛋白分子间的相互作用。因此,鱼鳞明胶膜的热稳定性随甘油含量的增加逐渐下降(图4),结果导致膜的TS也随之降低(表3)。
3 结论
利用热水浸提法提取罗非鱼鱼鳞明胶蛋白时,发现随着浸提温度的增加和浸提时间的延长,从鱼鳞中溶解出来的明胶蛋白含量逐渐增多,80℃浸提时明胶蛋白的降解程度最小。而且,利用80℃浸提1h的明胶可制备成无色透明、具有良好机械性能的蛋白膜,表明罗非鱼鱼鳞明胶可以作为制备蛋白可食膜的新型替代原料。另一方面,甘油在鱼鳞明胶蛋白膜中主要起增塑剂的作用,其添加量的增加会逐渐减弱明胶蛋白分子之间的相互作用力,导致膜的热稳定性和机械性能下降,但膜的柔软性却可以得到改善。因此,通过调整甘油添加量可以制备出机械强度和柔韧性符合实际需求的蛋白膜。
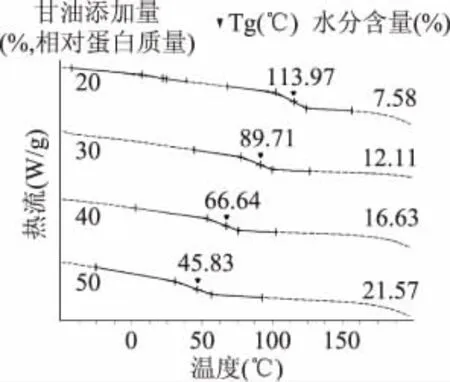
图4 鱼鳞明胶蛋白膜的DSC曲线和水分含量Fig.4 DSC thermograms and water content of tilapia scale gelatin films
[1]Yen TH,Lin-Tan DT,Lin JL.Food safety involving ingestion of foods and beverages prepared with phthalate-plasticizercontaining clouding agents[J].Journal of the Formosan Medical Association,2011,110(11):671-684.
[2]Cao N,Fu YH,He JH.Mechanical properties of gelatin films cross-linked,respectively,by ferulic acid and tannin acid[J]. Food Hydrocolloids,2007,21(4):575-584.
[3]Weng WY,Osako K,Tanaka M.Oxygen permeability and antioxidative properties of edible surimi films[J].Fisheries Science,2009,75(1):233-240.
[4]中国渔业年鉴[M].北京:中国农业出版社,2011.
[5]Limpisophon K,Tanaka M,Weng WY,et al.Characterization of gelatin films prepared from under-utilized blue shark(Prionace glauca)skin[J].Food Hydrocolloids,2009,23(7):1993-2000.
[6]Gómez-Estaca J,Montero P,Fernández-Martín F,et al. Physico-chemical and film-forming properties of bovine-hide and tuna-skin gelatin:A comparative study[J].Journal of Food Enginerring,2009,90(4):480-486.
[7]Pérez-Mateos M,Montero P,Gómez-Guillén MC.Formulation and stability of biodegradable films made from cod gelatin and sunflower oil blends[J].Food Hydrocolloids,2009,23(1):53-61.
[8]Jongjareonrak A,Benjakul S,Visessanguan W,et al. Characterization of edible films from skin gelatin of brownstripe red snapper and bigeye snapper[J].Food Hydrocolloids,2006,20 (4):492-501.
[9]GB 5009.5-2010,食品中蛋白质的测定[S].北京:中国标准出版社,2010.
[10]翁武银,刘光明,苏文金,等.鱼皮明胶蛋白膜的制备及其热稳定性[J].水产学报,2011,35(12):1890-1896.
[11]American Society for Testing and Material,Annual Book of ASTM standards[M].Philadelphia:ASTM,1989:730-779.
[12]Hoque MS,Benjakul S,Prodpran T.Properties of film from cuttlefish(Sepia pharaonis)skin gelatin incorporated with cinnamon,clove and star anise extracts[J].Food Hydrocolloids,2011,25(5):1085-1097.
[13]Laemmli UK.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227: 680-685.
[14]GB 5009.3-2010,食品中水分的测定[S].北京:中国标准出版社,2010.
[15]SteelRGD,TorrieJH.PrinciplesandProceduresof Statistics:A Biometrical Approach[M].New York:McGraw-Hill,1980.
[16]刘艳.草鱼鳞胶原蛋白肽的制备、性质及其应用研究[D].武汉:武汉工业学院食品科学与工程学院,2009.
[17]刘丽娜.鮰鱼皮明胶的制备及其功能性质研究[D].无锡:江南大学食品学院,2008.
[18]Shiku Y,Hamaguchi PY,Tanaka M.Effect of pH on the preparation of edible films based on fish myofibrillar proteins[J]. Fisheries Science,2003,69(5):1026-1032.
[19]姜燕,唐传核,温其标,等.增塑剂对大豆蛋白可食膜特性的影响[J].食品与发酵工业,2005,31(11):112-116.
[20]Rivero S,García MA,Pinotti A.Correlations between structural,barrier,thermal and mechanical properties of plasticized gelatin films[J].Innovative Food Science and Emerging Technologies,2010,11(2):369-375.
[21]Vanin FM,Sobral PJA,Menegalli FC,et al.Effects of plasticizers and their concentrations on thermal and functional properties of gelatin-based films[J].Food Hydrocolloids,2005,19 (5):899-907.
[22]Vrentas JS,Duda JL.A free volume interpretation of the influence of the glass transition on diffusion in amorphous polymers[J].Journal of Applied Polymer Science,1978,22(8): 2325-2339.
