Sagliker综合征透析龄和骨代谢血液指标的初步研究
2013-03-11李文歌马丹丹
董 静,李 铎,李文歌,张 凌,马丹丹★
(1.中日友好医院 口腔医学中心,北京 100029;2.中日友好医院 肾内科,北京 100029)
继发性甲状腺功能亢进(secondary hyperparathyroidism,SHPT)是慢性肾衰竭(chronic renal failure,CRF)的常见并发症之一。在1953年美国医生Cohen和Diamond[1]就报告了1例慢性肾衰竭并发SHPT导致面部畸形改变的病例。从1991年始,陆续有巴西、美国等国外学者报告了20余例类似病例,患者的临床表现多数被描述为“狮样面容”[2~4],也有被描述为“大头”[5]、“肿胀脸”[6]等。2004年,土耳其的Sagliker医生报道了这种面部容貌的变化,并将面部改变及其他伴发的一系列的相关症状首次命名为Sagliker综合征(Sagliker syndrome,SS)[7]。
目前,对SS相关的病因研究还很少。本研究主要通过对比SHPT伴发Sagliker综合征的患者和单纯SHPT患者之间的透析龄和骨代谢血液指标,为进一步的SS病因探索提供依据。
1 对象和方法
1.1 研究对象
选择自2005年至今由中日友好医院肾内科收治的规律性血液透析的患者共34例,所有患者均经肾内科确诊为继发性甲状旁腺机能亢进。同时,由3名该院口腔医学中心副主任医师根据X线头影测量值是否有变化分为2组,X线头影测量有变化的8例患者为继发性甲状旁腺机能亢进伴发Sagliker综合征组(SS组),X线头影测量无变化的26例患者为单纯性甲状旁腺机能亢进组(单纯SHPT组)。见图1,封二。
1.2 研究方法
对SS组及单纯SHPT组的患者分别在透析龄和各项骨代谢相关的血液指标上进行对比。
测定血钙、血磷、碱性磷酸酶(alkaline phosphatase,ALP)及血清全段甲状旁腺激素(serum intact parathyroid hormone,iPTH),所有标本均为清晨透析前采血,血清生化检测使用日本日立7600型血生化自动分析仪,钙、磷、ALP采用比色法,正常值:钙2.00~2.75mmol/L,磷0.81~1.78mmol/L,ALP 40~150IU/L。血清iPTH采用美国DLS公司intact-PTH 10-8000药盒,酶联免疫吸附法,正常值12~88pg/ml。
1.3 统计学方法
采用SPSS13.0进行均数及标准差统计,并对有关联的骨代谢血液指标进行线性回归分析。
2 结果
2.1 透析龄
透析龄均值SS组为146±45个月,单纯SHPT组为125±24个月,总均值为130±20个月。
2.2 骨代谢血液指标
SS组和单纯SHPT组的血钙、血磷、ALP浓度及iPTH浓度见表1。2组患者的ALP浓度存在显著性差异(P<0.01)。
2.3 透析龄对骨代谢血液指标的影响
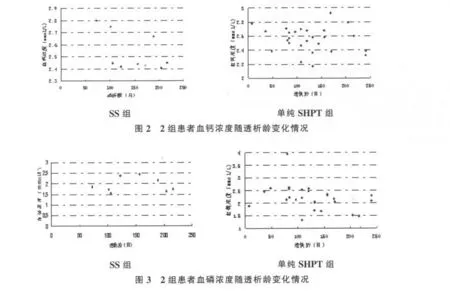
透析龄对2组患者血钙和血磷的影响见图2、图3。可以看出,2组患者透析龄基本分布在50~200个月之间。在透析龄为100~200个月时,SS组血钙浓度保持2.4~2.5mmol/L的水平;单纯SHPT组在2.4~2.8mmol/L的水平。SS组血磷浓度随透析龄增加呈现不规律变化,单纯SHPT组的血磷浓度基本在1.5~2.5mmol/L的范围内。

表1 2组患者骨代谢相关的血液指标
透析龄对患者的ALP和iPTH影响的差异见图4、图5。由图4可见,SS组的ALP浓度基本保持在500U/L以上,而单纯SHPT组大部分处于500U/L以下。在透析龄相同时,SS组的ALP浓度均高于单纯SHPT组。在透析龄为100~150个月的范围内,单纯SHPT组的ALP浓度跳升至500~1000U/L的区间。
由图5可见,单纯SHPT组的iPTH浓度随透析龄的增加呈现上升趋势,且在透析龄为100个月以后维持2000pg/ml以上的水平,部分病例甚至保持在3000pg/ml以上。SS组的iPTH浓度随透析龄的变化不明显,一半左右保持在2000pg/ml的水平。


表2 不同透析龄的2组患者指标对比差异样本
因2组患者透析龄基本分布在50~200个月,观察此范围内的不同透析龄的2组患者血液指标的差异,见表2。可见,透析龄相近的2组患者,血钙浓度均值基本相近,但SS组的ALP均值均显著高于单纯SHPT组(均P<0.01)。2组患者的iPTH均值均为正常值的25~32倍。随着透析龄的增加,SS组的血磷浓度由低于单纯SHPT患者,变化为高于单纯SHPT患者。
2.4 血钙与iPTH的关系
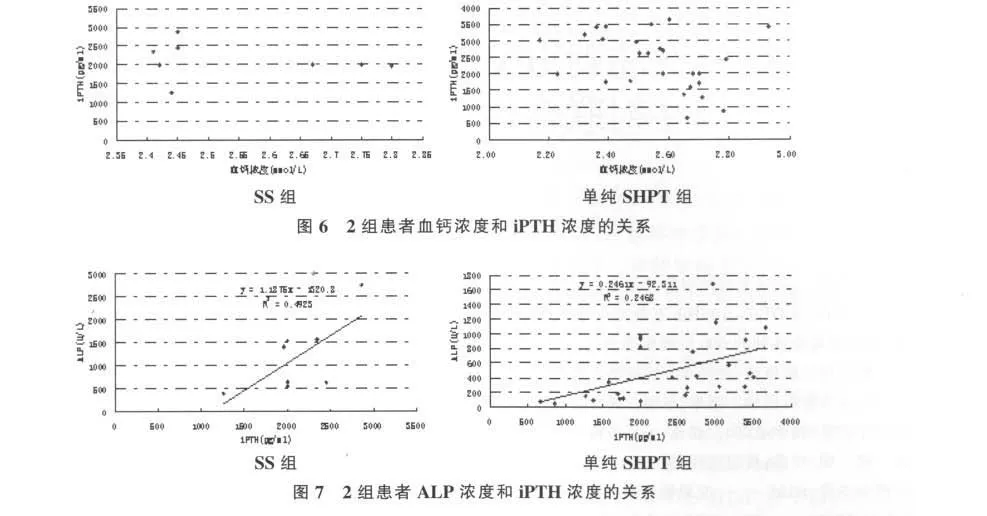
图6分别给出了SS组和单纯SHPT组血钙浓度和iPTH浓度的关系。SS组血钙浓度在2.4~2.5mmol/L时,iPTH浓度并未随血钙浓度增加而下降,而单纯SPTH组血钙浓度在2.2~2.5mmol/L时,iPTH浓度随着血钙浓度增加而有所下降。
2.5 碱性磷酸酶(ALP)与iPTH的关系
2组患者ALP浓度和iPTH浓度的关系见图7。结果显示,对SS组iPTH浓度而言,每增加100pg/ml,ALP浓度增 加118.8U/L(y=1.1875x-1320.8,R2=0.4923),对于单纯SHPT组,iPTH浓度每增加100pg/ml,ALP浓度增加24.6U/L(y=0.2461x-92.311,R2=0.2468)。
3 讨论
Sagliker综合征患者因面部颌骨、身高、全身骨骼等方面的改变,生活质量受到了严重影响。张凌等[8]对10例行甲状旁腺全切除术后的Sagliker综合征患者的研究发现,其iPTH显著下降,骨骼畸形停止发展,营养不良得到改善。然而,目前尚未发现对Sagliker综合征患者的病因进行探讨,本文从透析龄及骨代谢相关血液指标方面,将Sagliker综合征患者与单纯SHPT患者进行对比,初步探讨其发病原因。
本研究从透析龄上来看,SS组(146个月)要长于单纯SHPT组(125个月),在透析龄分别为50~100个月、100~150个月、150~200个月的区间,SS组的ALP浓度均值均显著高于单纯SHPT组(均P<0.01)。碱性磷酸酶(ALP)作为成骨细胞活性的一种标志物,参与矿化且有利于成骨过程。由以上两点来看,SHPT患者透析时间越长,发展成为Sagliker综合征的可能性就越大。因而,透析龄可能也是Sagliker综合征的一个危险因素。
从血钙浓度均值上看,SS组(2.55mmol/L)和单纯SHPT组(2.55mmol/L)基本在同一水平,并且都在较正常的范围内。但值得注意的是,SS组的血磷浓度(1.93mmol/L)虽略低于单纯SHPT组(2.21mmol/L),但随着透析龄的增加,SS组的血磷是呈现上升的趋势,单纯SHPT组却没有出现这样的趋势,但所有值都比正常值高。2组患者的血磷均值都高于正常值,这可能是由于慢性肾功能不全的患者长期进行透析治疗,虽然可维持血中钙离子的浓度,但是患者血液中的高磷却不能很好的排泄到体外,并且可能出现透析不充分的现象,因而血钙值接近正常但血磷偏高。因本文所获取的原始数据中未引用与透析充分性相关的数据,因而不能从透析充分性上进行更深入的分析。另外,SS组随着透析龄的增加血磷均值逐渐上升,而单纯SHPT组并没有出现这样的情况,因而可能说明随着透析时间的增加,血磷值控制越差的慢性肾功能不全的患者发展成为Sagliker综合征的可能性更大。这也提示我们,在临床工作中,不仅要监控血钙值,还要密切监控及调整血磷。
本研究中,SS组的ALP浓度均值(1185U/L)显著高于单纯SHPT组(491U/L,P<0.01),而iPTH浓度在2组(2109pg/ml vs 2371pg/ml)的差异并不明显,虽然其iPTH浓度均处在非常高的水平。这可能表明,Sagliker综合征患者体内存在某种机制,使iPTH浓度处于高水平的情况下,ALP浓度远高于单纯SHPT患者。因ALP参与矿化且有利于成骨过程,这正与Sagliker综合征患者上下颌骨畸形增生的临床表现相符,进一步证实了我们的判断。
人体内源性PTH调节的最终结果是降低血磷、升高血钙,而钙是调节PTH分泌的最重要因素。Hoenderop等[9]的研究发现,当血钙在1.88~2.63mmol/L时,低血钙刺激甲状旁腺分泌PTH,高血钙抑制PTH的分泌。当血钙超出此范围时,PTH的分泌仅有轻度的改变。对于SS组而言,血钙浓度在2.4~2.5mmol/L时,并没有出现高血钙抑制iPTH分泌的现象。但单纯SHPT组的血钙浓度在此范围内时,随着血钙浓度的增加出现了iPTH下降的情况,这与Hoenderop等人的研究情况相符合。
碱性磷酸酶(ALP)作为成骨细胞活性的一种标志物,在继发性甲状旁腺功能亢进时随着血清中iPTH的升高也出现升高[10]。从拟合的结果显示,Sagliker综合征患者ALP浓度对iPTH浓度的变化较单纯SHPT患者更为敏感。这提示我们,当单纯SHPT患者iPTH浓度升高时,ALP上升幅度随iPTH上升幅度较以前明显增加时,其发展成为Sagliker综合征患者的可能性加大。
本研究初步探讨了Sagliker综合征患者的部分病因,但由于样本量有限,关于Sagliker综合征的发病原因,还需要进行进一步的深入探讨。
[1] Cohen J,Diamond I.Leontiasis ossea,slipped epiphyses,and granulosa cell tumor of testis with renal disease:report of a case with autopsy findings[J].AMA Arch Pathol,1953,56(5):488-500.
[2] Dantas M,Costa RS,Jorgetti V,et al.Facial leontiasis ossea:a rare presentation of hyperparathyroidism secondary to chronic renal insufficiency[J].Nephron,1991,58(4):475-478.
[3] Lee VS,Martinez S.Leontiasis ossea in secondary hyperparathyroidism[J].J Bone Miner Res,1997,12(11):1952-1953.
[4] Reidy JM,Motamedi K,Berens D,et al.Renal osteodystrophy with leontiasis ossea deformity[J].Otolaryngol Head Neck Surg,1998,119(5):525-527.
[5] Lee VS,Webb MS,Martinez S,et al.Uremic leontiasis ossea:"bighead"disease in humans? Radiologic,clinical,and pathologic features[J].Radiology,1996,199:233-240.
[6] Fisher D,Hiller N,Drukker A.Nephroquiz for the beginner:A swollen face in a girl on haemodialysis.Diagnosis:renal osteodystrophy[J].Nephrol Dial Transplant,1999,14(7):1797-1798.
[7] Sagliker Y,Balal M,Sagliker Ozkaynak P,et al.Sagliker syndrome:uglifying human face appearance in late and severe secondary hyperparathyroidism in chronic renal failure[J].Semin Nephrol,2004,24(5):449-455.
[8] 张凌,姚力,花瞻,等.甲状旁腺全切除术治疗10例Sagliker综合征疗效评估[J].中华内科杂志,2011,50(7):562-567.
[9] Hoenderop JG,Nilius B,Bindels RJ.Molecular mechanism of active Ca2+reabsorption in the distal nephron[J].Annual review of physiology,2002,64:529-549.
[10] 张建荣,张凌.慢性肾脏病继发性甲旁亢[M].北京:人民军医出版社,2010.23-24.
