拟青霉β-1,3(4)-葡聚糖酶同源建模及共价固定化
2013-03-07华承伟于江傲谢凤珍陈晓静
华承伟,于江傲,谢凤珍,陈晓静
(1.河南科技学院生命科技学院,河南 新乡 453003;2.河南科技学院新科学院,河南 新乡 453003)
拟青霉β-1,3(4)-葡聚糖酶同源建模及共价固定化
华承伟1,于江傲1,谢凤珍2,陈晓静2
(1.河南科技学院生命科技学院,河南 新乡 453003;2.河南科技学院新科学院,河南 新乡 453003)
采用同源建模的方法构建拟青霉β-1,3(4)-葡聚糖酶的三维结构。通过对其活性位点及表面氨基酸残基侧链的分析,利用氨基载体Sepabeads EC-HA共价固定化葡聚糖酶,优化固定化条件,比较固定化酶与游离酶的酶学参数。结果表明:m(酶粉):m(载体)=1.2:1、温度40~45℃、固定化时间8h,固定化效果最好。蛋白结合率可达91.7%,酶活回收率达87.6%,固定化酶最适温度、热稳定性、pH值稳定性和批次使用稳定性均得到明显提高。
β-1,3(4)-葡聚糖酶;同源建模;共价固定化
β-葡聚糖是由β-D-葡萄糖残基通过β-1,3或β-1,4-糖苷键连接而成的多聚糖,是谷类植物细胞壁的主要组分,广泛存在于大麦、黑麦、小麦和稻米等禾本科谷物及酵母中[1],与阿拉伯木聚糖、戊聚糖、纤维素、果胶等均属植物细胞壁中的可溶性结构性非淀粉多糖。β-葡聚糖酶作为一种重要的工业用酶,在啤酒工业、功能性食品、制糖、造纸、日化及饲料工业中有重要的应用价值。固定化酶可以克服游离酶的不稳定性,具有可反复或连续使用、易与反应产物分离等显著优点,对于解决部分价格昂贵及稀有酶来源、降低生产成本具有重要的意义。固定化技术经过30多年的发展,但真正应用于工业化的固定化酶并不多,主要是因为固定化酶的过程中还存在几个亟待解决的难题:酶的活性中心发生物理化学变化导致酶活力降低;酶固定化后多了空间屏障,增加了传质阻力;酶和载体结合不牢固,容易脱落,酶活力损失大;固定化颗粒成型困难等[2-3]。如何解决这些问题是固定化技术的热点,研究者不断地对固定化载体改良并提出新的载体和固定化方法[4-7],并在酶的共价固定和定向固定化等方面作了大量研究。本实验利用同源建模技术构建了来源于拟青霉的β-1,3(4)-葡聚糖酶的三维结构,通过分析其活性位点和表面氨基酸组成,利用酶蛋白侧链氨基进行定向共价固定化研究。通过固定化的葡聚糖酶可用于啤酒工业及葡聚糖寡糖制造的连续生产,对于解决优良酶制剂来源及降低生产成本具有重要的意义。
1 材料与方法
1.1 材料与试剂
酶制剂:拟青霉(Paecilomyces sp. FLH30)β-1,3(4)-葡聚糖酶(8649U/mg大麦葡聚糖),由河南科技学院分离工程实验室保藏毕赤酵母工程菌发酵纯化自制;固定化载体:氨基型SEPABEADS EC-HA(EA)和环氧型SEPABEADS EC-EP(HFA)系列聚甲基丙烯酸球状基质(Resindion S.r.l., Mitsubishi Chem. Corp., Japan);大麦葡聚糖 美国Sigma公司。
1.2 仪器与设备
TU-1901紫外-可见分光光度计 北京普析通用仪器有限责任公司;RH-Q全温振荡器 江苏金坛恒丰制造有限公司;HH-8恒温水浴锅 江苏金坛环宇科学仪器厂。
1.3 方法
1.3.1 同源建模
拟青霉β-1,3(4)-葡聚糖酶(GenBank登录号:HQ825092)由298个氨基酸残基组成。模板搜索采用NCBI的BLASTp和PDB的BLAST程序,同源建模采用MODELLER(v9.10)程序和EasyModeller 2.0图形操作界面[8-9]。由程序自动生成10个模型,选取概率密度函数(probability density functions,PDF)对蛋白质几何性质打分最高的模型,用Procheck程序进行合理性评价。蛋白三维结构及显示采用Pymol(v1.3.1)程序。
1.3.2 酶的固定化
环氧型SEPABEADS EC载体固定化:7mL离心管中,精确称取一定量冷冻干燥的酶粉与载体混合,加入KH2PO4-K2HPO4缓冲液(1.25mol/L,pH8.0),载体与缓冲液比为1:4(m/V)。混合物置于全温振荡器中控制一定温度,固定化一定时间,静置20h,振荡频率40次/min。90μm滤膜过滤混合物,回收载体及滤液,固定化酶分别用KH2PO4-K2HPO4缓冲液(0.02mol/L,pH8.0)、含0.5mol/L NaCl的KH2PO4-K2HPO4缓冲液(0.02mol/L,pH8.0)及醋酸缓冲液(0.1mol/L,pH5.0)各洗涤1次,除去未共价结合的酶蛋白,合并滤液,计算酶的蛋白结合量。固定化酶置于4℃冰箱保存。
氨基型SEPABEADS EC载体固定化:载体预先用含2g/100mL戊二醛的KH2PO4-K2HPO4缓冲液(0.02mol/L,pH8.0,载体:缓冲液为1:4),于25℃活化1h,然后用同样的缓冲液洗涤2次。固定化操作同上,但在固定化时,磷酸缓冲液浓度为0.02mol/L。
1.3.3 酶活力测定
酶活力的单位定义为:70℃、pH7.0的MES缓冲液及底物质量浓度为1g/100mL条件下,每分钟生成1μmol葡萄糖所需要的酶量。采用DNS法测定还原糖含量[10]。
1.3.4 蛋白含量测定
参照Lowry等[11]的方法,以牛血清白蛋白作为标准蛋白。
1.3.5 最适pH值和最适温度
在70℃条件下,分别测定固定化酶在pH2.5~11.0的4种不同缓冲液(50mmol/L,柠檬酸缓冲液pH2.5~5.5,MES缓冲液 pH5.0~7.0,磷酸缓冲液pH6.0~8.5,甘氨酸-NaOH缓冲液pH8.5~11.0)中的酶活力,以最高酶活力作为100%。为考察固定化酶在不同pH值条件下的稳定性,一定量的固定化酶分别于上述缓冲液50℃保温30min后冰浴30min测定残余酶活力,以未经处理酶的酶活力为100%。分别于30~100℃测定酶活力(50mmol/L MES缓冲液pH7.0),以最高酶活力作为100%,固定化酶于不同温度下分别保温、定时取样测定残余酶活力,以未经处理酶的酶活力为100%,考察其热稳定性。结果为3次实验数据的平均值。
2 结果与分析
2.1 同源建模及分析
NCBI和PDB数据库BLSAT搜索结果显示,拟青霉β-1,3(4)-葡聚糖酶与黄孢原毛平革菌(Phanerochaete chrysosporium)的内切β-1,3(4)-葡聚糖酶(PDB code,2CL2) 具有较高的序列相似度(similarity:55%)和一致性(identity:44%)。利用2CL2作为模板,利用MODELLER通过序列比对、模型建立、Loop和结构优化,得到最终三维模型(图1a)。使用Procheck程序对模型结构的立体化学参数进行了评价,该程序可以凭经验比较给定蛋白质结构与最合理的蛋白质结构之间立体化学性质的差异。评价结果中主要考察所有氨基酸残基骨架的二面角分布,并通过程序生成的Ramachandran图(图1b)来表示。建模的蛋白质有97.7%的残基落入中心区域(the core regions),2.3%的残基落入许可区(allowed regions),无残基落入不允许区(disallowed regions)。上述结果说明建模得到的葡聚糖酶模型氨基酸二面角结构是比较合理的。

图 1β-1,3(4)-葡聚糖酶同源建模的模型(a)与Ramachandran图(b)Fig.1 Three dimensional structure (a) and Ramachandran plot (b) of β-1,3(4)-glucanase from Paecilomyces sp. FLH30
三维模型显示,该葡聚糖酶由两个大的反向平行β-折叠层组成,两个β-折叠层连接两端的环(loops)(图1a),由4个二硫键Cys96~Cys265和Cys252~Cys272,Cys138~Cys234和Cys154~Cys167固定。活性位点氨基酸残基EIDIIE和糖苷水解酶16家族活性位点氨基酸残基EIDIE相似[12-15],位于底物结合的狭沟中(图2a)。整个酶分子含有6个赖氨酸(Lys)残基位于酶分子表面,只有一个Lys残基位于酶与底物结合狭沟的边缘,且距催化中心氨基酸残基较远,其余5个Lys残基远离底物结合和催化位点(图2b),因此,可利用Lys残基侧链的ε-NH2进行酶的共价固定化。

图 2β-1,3(4)-葡聚糖酶模型分子表面(a)及赖氨酸残基侧链分子表面(b)Fig.2 Molecular structure of β-1,3(4)-glucanase from Paecilomycessp. FLH30 (a) and Lys side chain (b)
2.2 葡聚糖酶的共价固定化
2.2.1 载体选择
SEPABEADS®EC系列载体为高度多孔亲水性聚甲基丙烯酸球状基质,其中S级颗粒大小100~300μm,孔径10~20nm;温度稳定范围2~60℃;氨基型载体pH值稳定范围1~14,环氧型载体pH值稳定范围5~8;流速可达10m/h,对应压力1.2bar/m。因此,具有稳定的物理和化学性质、在高浓度溶液和通常溶剂中的低膨胀率和深度交联,具有杰出的机械渗透稳定性等优点,适合工业生产应用。根据前述分析结果,选用氨基型SEPABEADS EC-HA/EA和环氧型SEPABEADS EC-EP/HFA这4种S级载体,分别取1g湿载体,加入0.25g酶粉,固定化18h,测定固定化效率(蛋白结合率)和酶活回收率。结果见表1。
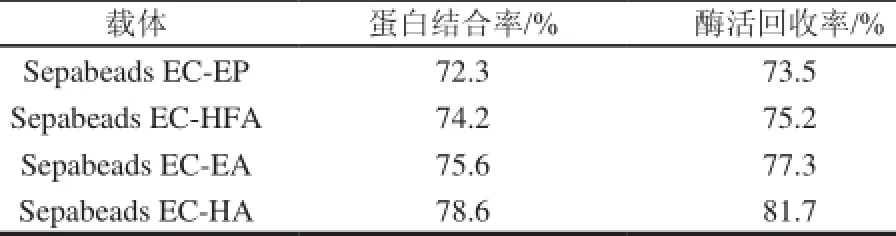
表 1 4种Sepabeads EC载体固定化葡聚糖酶效果Table 1 Comparison of immobilization of β-1,3(4)-glucanase from Paecilomyces sp. FLH30 onto four different types of Sepabeads EC
两种环氧型载体HFA和EP的功能基团最小密度分别为75、100μmol/g湿载体,但HFA型载体在蛋白结合率及酶活回收率方面都高于EP型载体,可能是由于HFA载体较EP载体具有更长的载体臂,利于蛋白结合及活性保持所致。两种氨基型载体的蛋白结合率要高于环氧型载体,可能是由于含有较高的功能基团密度(>600μmol/g湿载体)。4种载体中,以HA载体效果最好,蛋白结合率及酶活回收率都高于其他3种载体,因此,选择HA载体作为后续实验的固定化载体。
2.2.2 酶用量和固定化时间对共价固定化的影响
平行称取1g戊二醛活化过的湿载体(含水量70%)8份,分别加入不同量的酶粉,加入4mL的磷酸缓冲液,于25℃固定化18h,测定固定化酶活力(以固定化酶最高酶活力为100%)和酶活回收率,结果如图3所示。

图 3 葡聚糖酶用量对固定化效果的影响Fig.3 Effect of glucanase loading on the relative activity and activity recovery of immobilized β-1,3(4)-glucanase
单位质量的载体活性官能团数量、空间效应和酶的浓度对酶的结合量有重要的影响,因此考察酶用量对固定化效果、节约酶用量有重要意义。由图3可知,一定范围内,随酶量的增加,蛋白结合量和酶活回收率随之增加,当1g湿载体,酶用量超过1.2g,即m(酶):m(载体)高于1.2:1时,固定化酶相对活力(蛋白结合量)基本不再增加,但酶活回收率却逐渐下降,说明载体与酶结合已达饱和状态。
2.2.3 温度对共价固定化的影响
活化载体的醛基与蛋白Lys的ε-NH2在碱性条件下发生亲核加成反应,生成希夫(Schiff)碱,温度对于希夫碱的形成具有重要的影响,因此,可根据酶的耐热性,选择合适的温度进行固定化,以缩短固定化时间,选择1g湿载体,酶用量为1.2g,固定化时间为2h,考察不同温度下固定化酶的蛋白结合量和酶活回收率,结果见图4。

图 4 反应温度对酶固定化效果的影响Fig.4 Effect of immobilization temperature on the protein binding rate and activity recovery of immobilized β-1,3(4)-glucanase
由图4可知,本重组葡聚糖酶游离酶在低于50℃以下的温度范围内,非常稳定,高于70℃,酶失活速率较快[9]。图中结果显示,随温度升高,蛋白结合量随之增加,但超过50℃以后,酶活回收率下降,因此,固定化最适温度可控制在40~45℃之间。另外,温度过高,副反应较多,因此后续实验的固定化温度选择40℃。
2.2.4 时间对共价固定化的影响
平行称取1g戊二醛活化过的湿载体6份,分别加入1.2g酶粉,加入4mL磷酸缓冲液,于40℃固定化不同时间,测定固定化酶活力和酶活回收率,结果见图5。

图 5 固定化反应时间对酶固定化效果的影响Fig.5 Effect of reaction time on the relative activity and activity recovery of immobilized β-1,3(4)-glucanase
由图5可知,固定化8h,固定化酶相对酶活力达到最大,随后,酶活回收率稍有下降。当温度控制在25℃固定化时,需要20h 左右才能达到最大结合率(结果未给出)。对于本葡聚糖酶,由于具有良好的热稳定性,因此提高固定化反应温度,可缩短固定化时间,同时又不影响蛋白结合率(91.7%)(图中未显示)和酶活回收率(87.6%)。
2.2.5 固定化酶还原对共价固定化的影响
氨基载体经戊二醛活化后与酶蛋白游离氨基形成的希夫碱在水溶液及酸性条件下稳定性较差,容易出现蛋白脱落,因此,采用此法固定化的酶需要把C=N形式的双键还原为单键的仲胺形式。称取5g固定化酶,加入20mL KH2PO4-K2HPO4缓冲液(0.02mol/L,pH8.0),加入4mg/L的NaBH42mL,4℃反应2h,过滤后用磷酸缓冲液冲洗2次。分别称取1g还原和未还原的固定化酶于10mL酶反应体系(1g/100mL大麦葡聚糖,50mol/L MES,pH7.0)中,50℃反应10min,离心,除去反应物,重复20批次,测定固定化酶活力,以原始固定化酶活力为100%,每个样品做3次平行。实验结果表明,还原型固定化酶明显较未还原的固定化酶稳定性高,前者使用20批次后,相对酶活力保持在98%以上,而后者只有75.6%。
2.3 固定化酶性质
2.3.1 pH值对固定化酶的影响
由图6a可知,固定化酶和游离酶最适pH值没有发生变化,都在pH7.0左右,但相对于游离酶,固定化酶在酸性和碱性条件下,对应的酶活要高,且最适作用pH值范围要宽,在pH5.0~9.0之间,相对酶活力可保持在80%以上,而游离酶在pH6.0~7.5之间。由图6b可知,不同pH值条件下的稳定性表明,固定化酶在pH3.5~10.5之间,相对酶活力保持在80%以上,而游离酶在pH4.5~9.5之间。结果表明固定化酶对pH值的敏感性降低,扩大了pH值应用范围。

图 6 固定化酶和游离酶的最适pH值(a)和pH值稳定性(b)Fig.6 Optimum pH (a) and pH stability (b) of immobilized and free β-1,3(4)-glucanase
2.3.2 温度对固定化酶的影响

图 7 固定化酶和游离酶的最适温度(a)和热稳定性(b)Fig.7 Optimum temperature (a) and thermal stability (b) of immobilized and free β-1,3(4)-glucanase
由图7a可知,固定化酶的最适温度为75℃,较游离酶提高了5℃,且在不同温度下的相对酶活力高于游离酶。由图7b可知,固定化酶的耐热性也高于游离酶,70、75、80℃经30min保温处理后,相对酶活力为88.2%、74.4%和42.6%,而游离酶为80.5%、58.5%和25.2%。
3 结 论
酶的固定化研究中,载体的选择对固定化成败具有决定性作用[16-17],本研究借助于酶分子同源建模,通过对其活性位点及表面氨基酸残基侧链分析,在不影响活性位点暴露情况下,选择酶分子中Lys残基的ε-NH2作为酶共价交联位点,选用氨基型SEPABEADS EC-HA载体,利用戊二醛交联双功能试剂进行固定化,基本实现了酶的定向共价固定化,减少了载体及固定化方法的盲目性。对固定化的条件进行优化,得到了m(酶粉):m(载体)=1.2:1、温度40~45℃、固定化时间8h的最佳固定化条件。固定化酶的最适温度、热稳定性和pH值稳定性均较游离酶有了明显提高。
[1] BULIGA G S, BRANT D A, FINCHER G B. The sequence statistics and solution conformation of a barley (1→3, 1→4)-beta-D-glucan[J]. Carbohyd Res, 1986, 157: 139-156.
[2] MARCO C, TORRE R, FERANADEZ-LORENTE G, et al. Epoxyamino groups: a new tool for improved immobilization of proteins by the epoxy method[J]. Biomacrornolecules, 2003, 4(3): 772-777.
[3] 蔡宏举, 付大雁, 王满意, 等. 大孔载体固定化脂肪酶[J]. 过程工程学报, 2007, 7(4): 773-777.
[4] 孙健, 周毅频, 陶家权, 等. 巨大芽孢杆菌青霉素G酰化酶在新型环氧载体ZH-HA上的固定化[J]. 工业微生物, 2008, 38(1): 1-5.
[5] 高阳, 谭天伟, 聂开立, 等. 大孔树脂固定化脂肪酶及在微水相中催化合成生物柴油的研究[J]. 生物工程学报, 2006, 22(1): 114-118.
[6] 许敬亮, 袁振宏, 张宇, 等. 氨基功能载体固定化酶研究进展[J]. 化工进展, 2010, 29(3): 494-497.
[7] BASSO A, SPIZZO P, FERRARIO V, et al. Endo- and exo-inulinases: enzyme-substrate interaction and rational immobilization[J]. Biotechnol Prog, 2010, 26(2): 397-405.
[8] ESWAR N, WEBB B, MARTI-RENOM M A, et al. Comparative protein structure modeling using MODELLER: Chapter 2: Unit 2.9[M]. Curr Protoc Protein Sci, John Wiley & Sons, Inc, 2007.
[9] BHUSAN K K, POLAMARASETTY A, PALLU R. EasyModeller: a graphical interface to MODELLER[J]. BMC Res Notes, 2010, 3: 226.
[10] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugars[J]. Analytical Chemistry, 1959, 31(3): 426-428.
[11] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the folin phenol reagent[J]. J Biol Chem, 1951, 193(1): 265-275.
[12] KAWAI R, IGARASHI K, YOSHIDA M, et al. Hydrolysis of β-1,3/1,6-glucan by glycoside hydrolase family 16 endo-1,3(4)-betaglucanase from the basidiomycete Phanerochaete chrysosporium[J]. Appl Microbiol Biotechnol, 2006, 71(6): 898-906.
[13] JUNG Y J, LEE Y S, PARK I H, et al. Molecular cloning, purif i cation and characterization of thermostable beta-1,3-1,4 glucanase from Bacillus subtilis A8-8[J]. Indian J Biochem Biophys, 2010, 47(4): 203-210.
[14] NAKATANI Y, LAMONT I L, CUTFIELD J F. Discovery and characterization of a distinctive exo-1,3/1,4-{beta}-glucanase from the marine bacterium Pseudoalteromonas sp. strain BB1[J]. Appl Environ Microbiol, 2010, 76(20): 6760-6768.
[15] CHENGWEI H, HUAXI Y, LINGXIA J. Cloning and expression of endo-1,3(4)-β-glucanase gene from Paecilomyces sp. FLH30 and the characterization of the recombinant enzyme[J]. Biosci Biotechnol Biochem, 2011, 75(9): 1-6.
[16] RAGHUVANSHI S, GUPTA R. Advantages of the immobilization of lipase on porous supports over free enzyme[J]. Protein Pept Lett, 2010, 17(11): 1412-1416.
[17] CORDEIRO A L, POMPE T, SALCHERT K, et al. Enzyme immobilization on reactive polymer fi lms[J]. Methods Mol Biol, 2011, 751: 465-476.
Homology Modeling and Covalent Immobilization of β-1,3(4)-Glucanase from Paecilomyces sp. FLH30
HUA Cheng-wei1,YU Jiang-ao1,XIE Feng-zhen2,CHEN Xiao-jing2
(1. School of Life Science and Technology, Henan Institute of Science and Technology, Xinxiang 453003, China;2. College of Xinke, Henan Institute of Science and Technology, Xinxiang 453003, China)
The three-dimensional structure of β-1,3(4)-glucanase from Paecilomyces sp. FLH30 was constructed by means of homology modeling using the crystal structure of endo-β-1,3(4)-glucanase from Phanerochaete chrysosporium as a template, and its active site and side chains of surface amino acid residues were analyzed. Sepabeads EC-HA as a carrier of amino groups was used for the covalent immobilization of this enzyme and immobilization conditions were optimized. Meanwhile, enzymatic characteristics of free and immobilized β-1,3(4)-glucanase were compared. The best immobilization results were obtained under the conditions: enzyme/carrier mass ratio1.2:1, temperature 40ü45 ℃, and immobilization time 8 h. Under these conditions, the protein binding rate was 91.7% and the activity recovery was 87.6%. The optimum temperature, thermal stability, pH stability and operational stability of immobilized glucanase were all improved when compared to free glucanase.
β-1,3(4)-glucanase;homology modeling;covalent immobilization
Q814.2
A
1002-6630(2013)01-0252-05
2011-10-07
华承伟(1972ü),男,副教授,博士,研究方向为食品生物技术。E-mail:hcwxfxhy@yahoo.cn
