辣椒þ“花壳ÿ”主要致变细菌的分离及鉴定
2013-03-07丁筑红郑文宇肖治柔
刘 海,丁筑红*,郑文宇,肖治柔,邓 程,杨 茜
(贵州大学生命科学学院,贵州 贵阳 550025)
辣椒þ“花壳ÿ”主要致变细菌的分离及鉴定
刘 海,丁筑红*,郑文宇,肖治柔,邓 程,杨 茜
(贵州大学生命科学学院,贵州 贵阳 550025)
采用微生物学传统分离培养方法从辣椒花壳组织中分离到可致辣椒花壳细菌,并从中选取主要致变细菌,进行常规鉴定和分子生物学鉴定。通过对其形态特征观察、生理生化特征分析以及测定16S rDNA序列,用BLAST 软件对测序结果进行相似性比对,鉴定结果发现:Bacillus subtilis 2株;Lysinibacillus sphaericus 1株;Bacillus amyloliquefaciens 1株;Bacillus pumilus 1株。
辣椒;花壳;分离;鉴定;系统发育分析
干辣椒是鲜红辣椒经过干制而成的辣椒产品,是辣椒产品加工的主要原料。通过对鲜辣椒进行干制,可以将鲜辣椒的可溶性固形物浓度提高到微生物难于在其上生存和利用的程度,同时抑制辣椒体内酶的活性,以达到长期保存的目的[1]。由于干辣椒的水分含量低、体积小、质量轻,运输、贮藏等相对容易,因此,干辣椒的国际贸易额大大高于鲜辣椒,其产量也逐年增长[2-3]。然而,在辣椒的干制过程中,特别是自然干制中,辣椒果实会出现红色褪变,形成花壳或白壳干辣椒,严重影响辣椒的感官品质和商品价值[4-5]。导致辣椒红素褪变的原因很多[6-7],但在辣椒自然干制中引起花壳的原因主要是微生物的作用[8-10]。2008年,李桂舫等[10]对干制辣椒红色素丧失与病原菌的关系进行了研究,通过对褪色的干制辣椒种子及组织的分离培养,得到4种真菌菌株,分别为Acremonium sp.、Alternaria sp.、Cladosporium sp.和Fusarium sp.。采用刺伤法将这4种真菌接种到转红期的健康辣椒果实上,初步发现Acremonium sp.和Fusarium sp.可混合侵染引起辣椒红色素丧失。
真菌可导致辣椒色素褪色,造成辣椒花壳[9-10]。然而,细菌对辣椒干制过程中辣椒色素的影响却鲜见报道。本实验通过对自然干制过程中花壳致变细菌的分离,利用传统的细菌分类鉴定方法和分子生物学鉴定方法对辣椒花壳致变细菌进行鉴定,分析辣椒花壳致变细菌的群属,为预防辣椒花壳提供理论依据。
1 材料与方法
1.1 材料与试剂
辣椒(Capsicum annuum L.),花溪党武本地辣椒二金条[11]购于花溪农贸市场,新鲜且充分成熟,无腐烂变质。
DNA提取试剂盒(离心柱型) 北京三博远志生物技术有限责任公司。
1.2 培养基配方
牛肉膏蛋白胨琼脂培养基(g/L):蛋白胨10、牛肉膏3、氯化钠5、琼脂15,蒸馏水1000mL,pH7.2~7.4。
1.3 方法
1.3.1 辣椒花壳致变细菌的分离纯化[12]
将新鲜红色辣椒在室温条件下自然风干。对出现
花壳的辣椒进行随机抽样,无菌水冲洗花壳辣椒果实表面,用无菌剪刀在花壳辣椒病健处剪取(1~2)cmh(1~2)cm大小辣椒组织于无菌研钵中,加入10mL无菌生理盐水研磨,将辣椒组织磨碎,静置5min,吸取0.5mL涂布于无菌营养琼脂平板上,置于30℃培养箱中培养24h。待其长出菌落,用无菌接种环挑取不同单个菌落划线转接纯化多次,直至通过镜检观察确定其为纯培养物后,挑取单个菌落接种于牛肉膏蛋白胨琼脂斜面培养基于30℃培养箱中培养24h,然后置于4℃冰箱保存备用。
1.3.2 辣椒花壳致变细菌致病性接种
选取健康成熟的花溪党武本地新鲜红辣椒,用自来水冲洗3h后沥干,切取(1~2)cmh(2~4)cm大小的辣椒组织,用70%乙醇溶液消毒2min,0.1%升汞溶液灭菌30min,然后用无菌水冲洗9~10次。将消毒灭菌的辣椒组织放入无菌的培养皿中,置于30℃的培养箱中观察5d,剔除被污染的辣椒组织。将花壳辣椒组织中分离纯化的细菌菌种用无菌生理盐水洗下,制成1h107CFU/mL菌悬液,取1mL接种于经消毒灭菌的辣椒组织,同时,用无菌水润湿培养皿中纱布,每一菌株做3个重复,将接种后的辣椒组织置于30℃的培养箱中保湿5d后,再培养20d,以无菌生理盐水作为空白对照。培养期间观察其色泽变化,将导致辣椒花壳的菌株保存于4℃冰箱。
1.3.3 辣椒花壳致变细菌形态学特征观察
将导致辣椒花壳的菌株接种于无菌营养琼脂平板上30℃培养24h,菌落形态观察按袁丽红[13]的方法进行。然后分别对培养24h的培养物按照结晶紫草酸铵染色法进行革兰氏染色,按镀银染色法进行鞭毛染色,按孔雀绿芽孢染色法进行芽孢染色[14]。菌体细胞大小利用测微尺测量[15],菌株运动性和好氧性通过穿刺接种观察[16-17]。
1.3.4 生理生化指标测定
按照东秀珠等[14]分类方法进行生理生化实验。
1.3.5 16S rDNA分子测序及序列分析
DNA按照细菌基因组DNA提取试剂盒手册中细菌基因组DNA提取步骤进行。
采用细菌16S rDNA通用引物(正向引物27F:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物1492R:5'-GGYTACCTTGTTACGACTT-3'),以导致辣椒花壳菌株的基因组DNA为模板进行PCR扩增。扩增体系为50μL:DNA模板1~5μL,5U/μL Taq plus DNA聚合酶0.2μL、10hPlus PCR Buffer 5μL、dNTP(10mmol/L) 2μL、上下游引物(10μmol/L)各2μL、ddH2O补足至50μL。扩增条件为:94℃预变性3min;95℃变性30s,55℃退火30s,72℃延伸60s,35个循环;72℃最后延伸5min,4℃保存。
取3~5μL扩增产物进行琼脂糖凝胶电泳,电泳缓冲液为10hTBE,凝胶浓度为1.5%,恒定电压为150V,电泳15min后,通过EB染色在紫外灯下观察目的条带,质量浓度>50ng/μL为合格。质量浓度达不到或没有扩增条带的样品重新扩增。对目标片段,用琼脂糖凝胶DNA回收试剂盒进行纯化与回收,操作步骤参照试剂盒说明书进行。对纯化和回收的DNA序列进行测序,菌株测序的整个过程由北京三博远志生物技术有限责任公司完成。将菌株的16S rRNA基因序列提交GenBank进行BLAST比对,查找相似性较高菌株序列。使用序列分析软件ClustalX2.0.11程序对相似性比较高的菌株序列进行多序列比对(multiple alignments),采用Kimura2-Parameter距离模型[18]计算核苷酸差异值,利用MEGA4.1建树软件采用Neighbor-Joining[19]法以相近序列构建系统发育树,自展数(bootstrap)为1000。
2 结果与分析
2.1 辣椒花壳致变细菌的分离与回接结果
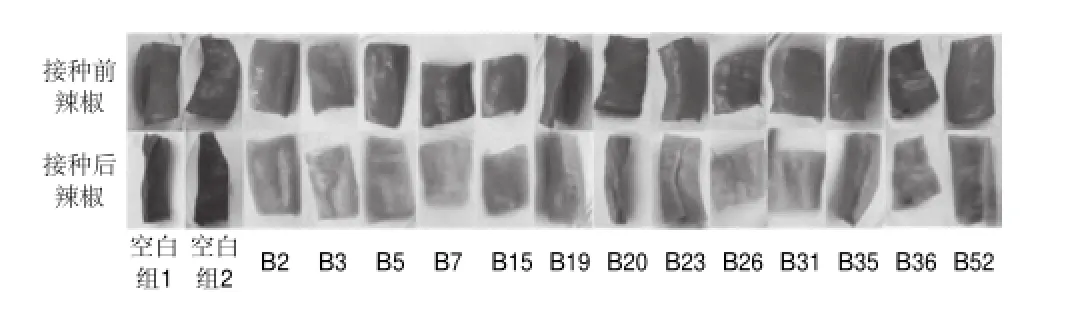
图 1 5株细菌对辣椒作用结果Fig.1 Effect of inoculation with 5 selected bacterial isolates on red pepper
从辣椒花壳组织中分离纯化得到63株菌株,将所分离纯化的63株菌种接种于经灭菌的新鲜健康的红辣椒组织。在接种后的第5天,接种菌株B3、B5、B7、B15的辣椒组织开始出现橘黄色斑块,并且橘黄色斑块向周围扩散,第6天B26出现橘黄色斑块,橘黄色斑块也向周围扩散。第20天B19和B20开始出现红色褪变,经过12d的培养,B2、B23和B52的辣椒组织的剪切边沿处开始出现黄色,其黄色由辣椒边沿向辣椒组织中部扩散。第15天,B31、B35和B36均出现变色现象。
经过25d的培养观察,有13株菌株可导致辣椒颜色从红色变为黄色或橘黄色。如图1所示,B2、B23、B31和B35菌株对辣椒组织的影响较其他菌株弱。B3、B5、B7、B15、B19、B20、B26、B36和B52的颜色变化较明显,辣椒组织完全由红色变为黄色或橘黄色。在辣椒自然干制过程中,辣椒一般在15~20d后开始出现花壳现象,B3、B5、B7、B15和B26菌株接种辣椒组织变色时间较其他菌株短。空白组辣椒的颜色加深,变为深红色。经过对辣椒组织进行接种培养观察,此13株菌株均可导致辣椒组织变色,形成花壳辣椒。然而,其中B3、B5、B7、B15和B26能在短时间使辣椒组织发生明显变色,因此,可初步断定B3、B5、B7、B15和B26是辣椒花壳的主要致变细菌,对其进行初步鉴定和分子生物学鉴定。
2.2 辣椒花壳致变细菌形态特征及生理生化分析
将变色明显的5株菌株B3、B5、B7、B15和B26分别用划线法接种于无菌的营养琼脂平板上,置于30℃培养箱中培养24h,观察其菌落形态。菌落形态特征见图2。5株菌株的菌落颜色均为灰白色,圆形,不透明,直径0.5~3.5mm,菌落湿润。其中,B15菌落的菌落中间有白色十字状皱褶。
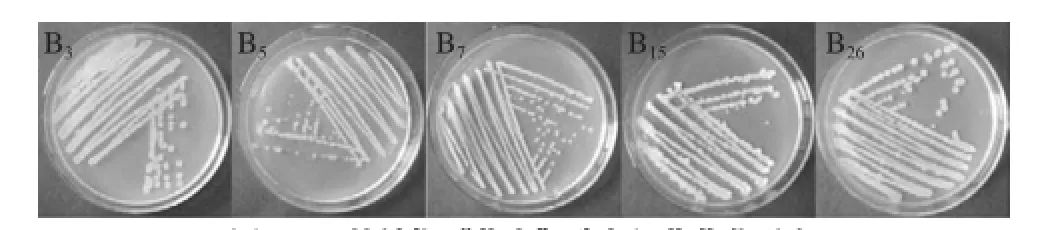
图 2 5株辣椒“花壳”致变细菌菌落形态Fig.2 Colony morphology of 5 selected bacterial isolates
对5株菌株进行革兰氏染色、芽孢染色和鞭毛染色,5株细菌均为革兰氏阳性杆菌,以周生鞭毛运动,产芽孢。其中,B5产球状芽孢,芽孢膨大,顶端着生。B3、B7、B15和B26的芽孢形状为椭圆形,B3和B26的芽孢偏端着生,B7和B15的芽孢的着生位置为中部(图3)。5株菌株均为好氧菌。

图 3 5株辣椒“花壳”致变细菌细胞形态结构Fig.3 Cell morphology of 5 selected bacterial isolates

表 1 辣椒“花壳”致变细菌形态特征Table 1 Morphological features of 5 selected bacterial isolates

表 2 辣椒“花壳”致变细菌生理生化特性Table 2 Physiological and biochemical properties of 5 selected bacterial isolates
辣椒花壳致变细菌形态特征如表1所示。由表2可见,B3能利用葡萄糖产酸,不产气,能利用蔗糖产酸,不能利用乳糖、棉子糖、麦芽糖、鼠李糖、D-阿拉伯糖、山梨醇、木糖醇、肌醇、甘露醇、水杨苷产酸;水解淀粉,葡萄糖铵阳性,能还原硝酸盐,但不能还原亚硝酸盐,V-P实验阳性,甲基红实验阴性,不产氧化酶、苯丙氨酸脱羧酶和精氨酸双水解酶,尿素酶和接触酶阳性;不利用柠檬酸盐和丙二酸盐,不产硫化氢和吲哚,不能在氰化钾培养基中生长,能液化明胶。B5不能利用葡萄糖、蔗糖、乳糖、棉子糖、麦芽糖、鼠李糖、D-阿拉伯糖、山梨醇、木糖醇、肌醇、甘露醇、水杨苷产酸。不水解淀粉。葡萄糖铵和柠檬酸盐利用阴性,不还原硝酸盐和亚硝酸盐,不产苯丙氨酸脱羧酶和精氨酸双水解酶,产氧化酶、尿素酶和接触酶,不产硫化氢和吲哚,能利用丙二酸盐和液化明胶,V-P和甲基红均为阴性,能在氰化钾培养基中生长。B7能利用葡萄糖产酸不产气,能利用蔗糖产酸,不能利用乳糖、棉子糖、麦芽糖、鼠李糖、D-阿拉伯糖、山梨醇、木糖醇、肌醇、甘露醇产酸。葡萄糖铵阴性,不水解淀粉;能利用水杨苷产酸,能还原硝酸盐,不还原亚硝酸盐,V-P实验阳性,甲基红实验阴性,不产尿素酶、苯丙氨酸脱羧酶和精氨酸双水解酶,氧化酶和接触酶阳性,不产硫化氢和吲哚,不利用柠檬酸盐和丙二酸盐,能液化明胶,氰化钾生长实验阴性。B15能利用葡萄糖产酸,但不产气,不能利用蔗糖、乳糖、棉子糖、麦芽糖、鼠李糖、D-阿拉伯糖、山梨醇、木糖醇、肌醇、甘露醇、水杨苷产酸;葡萄糖铵阳性,水解淀粉,能还原硝酸盐,但不能还原亚硝酸盐,V-P实验阳性,甲基红实验阴性,不产尿素酶、苯丙氨酸脱羧酶、精氨酸双水解酶和氧化酶,产接触酶,不利用柠檬酸盐和丙二酸盐,能液化明胶,氰化钾生长实验阴性,不产硫化氢和吲哚。与B3相比,B26能利用甘露醇产酸和柠檬酸盐,但不能水解淀粉。参照伯杰细菌鉴定手册[20]初步判定此5株菌株属于芽孢杆菌属。
2.3 16S rDNA序列测定分析结果
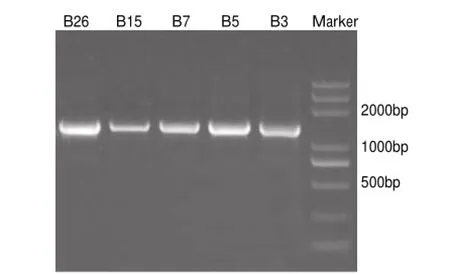
图 4 5株菌株16S rDNA扩增产物的凝胶电泳图Fig.4 Gel electrophoresis of PCR amplif i cation products of 16S rDNA sequences from 5 selected bacterial isolates
经过对5株菌株16S rDNA进行扩增,所得序列大小约为1500bp左右(图4)。对5株辣椒花壳致变细菌的16S rDNA进行测序,将测得菌株的16S rDNA序列进行BLAST同源比对分析。一般情况下,16S rDNA序列相似性在98%以上的可以认为是同种,97%以上可以认为是同属[21],序列相似性小于96%~97%的可以认为是不同种,小于93%~95%的可以认为是不同属[22]。
将所测16S rDNA序列登陆GenBank进行BLAST比对,5株菌株通过BLAST比对,都能在数据库中找到同源性非常高的相似菌株序列。菌株B3、B7、B15和B26均与芽孢杆菌属(Bacillus)具有较高的序列相似性,B5与赖氨酸芽孢杆菌属(Lysinibacillus)有较高的序列相似性。经过对比分析,菌株B3与菌株Bacillus subtilis strain C11D(HQ388812)的16S rDNA序列相似性达到99.9%,菌株B26与菌株Bacillus subtilis strain SCD115030(JN998727)的16S rDNA序列相似性达到99.8%。对菌株B3与B26的16S rDNA序列进行比对,其相似性可达到99.7%。菌株B5与菌株Lysinibacillus sphaericus strain JV(HM234124)、菌株B7与菌株Bacillus pumilus strain ZAQ1(HQ143667)、菌株B15与菌株Bacillus amyloliquefaciens strain JXQZ11(HQ844481)的16S rDNA序列相似性分别达到99.7%、99.8%和99.1%。
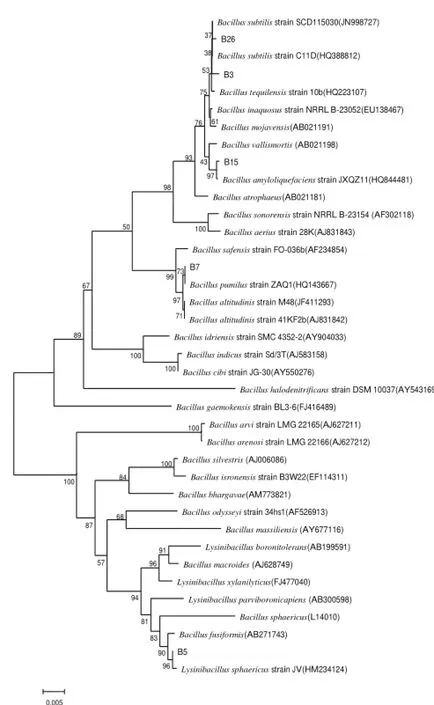
图 5 5株辣椒“花壳”致变细菌的16S rDNA系统发育树Fig.5 Phylogenetic tree based on the 16S rDNA sequences of 5 selected bacterial isolates fruits
对5株辣椒花壳致变细菌及其同源菌株的16S rDNA序列,利用MEGA4.1建树软件采用Neighbor-Joining法构建系统发育树。由图5可见,菌株B5与Lysinibacillus sphaericus strain JV(HM234124)聚合,且自信度高达96%,其亲缘关系较近;菌株B7与Bacillus pumilus strain ZAQ1 (HQ143667)聚成一支,其亲缘关系较近;菌株B15与Bacillus amyloliquefaciens strainJXQZ11(HQ844481)有较近的亲缘关系;菌株B3、B26与Bacillus subtilis strain SCD115030(JN998727)、Bacillus subtilis strain C11D(HQ388812)和Bacillus tequilensis strain 10b(HQ223107)聚在一起,其中,B3、 B26、Bacillus subtilis strain SCD115030(JN998727)、Bacillus subtilis strain C11D(HQ388812)之间的亲缘关系较近。
因此,综合5株辣椒花壳致变菌的细胞形态结构、生理生化特性及16S rDNA 序列测序结果,分别将B5、B7、B15准确鉴定为Lysinibacillus sphaericus、Bacillus pumilus和Bacillus amyloliquefaciens,将B3和B26均鉴定为Bacillus subtilis。
3 讨 论
辣椒花壳现象不仅出现在采后,辣椒在采前也会出现辣椒颜色褪变现象[9]。辣椒花壳致变菌的作用是辣椒采前颜色褪变的主要原因,在辣椒生长红熟期间,辣椒花壳致变菌可侵入辣椒果实组织中,引起辣椒果实颜色褪变现象的发生。李明远等[9]对田间采集的虎皮病辣椒果实进行病原分离,发现病原真菌是干辣椒
虎皮现象产生的主要原因,其病原真菌主要有细交链孢(Alternarialternata)、青霉菌(Penieillium sp.)、芽枝霉菌(Cladosporium sp.) 和镰刀菌(Fusariom sp.) 等。由于采前侵入辣椒果实组织内的花壳致变菌可在采后辣椒果实组织中继续生长繁殖,从而导致在辣椒采后自然干制和贮藏期间辣椒花壳现象的产生。此外,在辣椒果实自然干制过程中,由于辣椒组织脱水死亡,花壳致变菌极易侵入辣椒果实组织内部,引起辣椒颜色褪变。李桂舫等[10]从干制辣椒的褪色组织和辣椒种子中分离出4种辣椒花壳致变真菌。其中,有3种真菌是在辣椒生长红熟期间所携带的花壳致变真菌,另一种真菌在辣椒干制和贮藏期间侵入并导致辣椒褪色。
辣椒果实颜色与其所含类胡萝卜素成分有关[23-25]。从辣椒花壳致变细菌所导致辣椒颜色的变化可见,辣椒的颜色由红色变为黄色或橘黄色,而空白对照组辣椒组织的颜色由红色变为深红色,这可能与其中呈现红色的类胡萝卜素降解有关[26-28]。辣椒红素对外界环境比较敏感,辣椒红色素贮存在辣椒果实的完整细胞组织中,由于有细胞膜及细胞内某些成分的保护并形成脂类,其对光热等具有较高的稳定性,但当辣椒红色素失去了细胞膜等生物保护机制,辣椒红色素在有氧条件下会产生自氧化反应,而外界的光照高温及助氧化剂等的存在又会加速其氧化分解而褪色[29]。因此,辣椒花壳致变细菌对辣椒色素的影响可能是对辣椒组织结构造成破坏,使辣椒红色素的保护机制受到影响而发生变化,加速色素氧化褪色出现辣椒花壳。本实验分离得到的辣椒花壳致变细菌主要为芽孢杆菌,其中,经鉴定的5株主要辣椒花壳致变细菌中,有2株为枯草芽孢杆菌(Bacillus subtilis)。然而枯草芽孢杆菌主要作为共生菌存在于辣椒组织中[30],其致变机制有待进一步研究。
芽孢杆菌是辣椒中的优势菌群,张晓玲[31]从市售10种干辣椒样品中共分离得到了13种细菌,发现其中12种细菌为芽孢杆菌。张春燕等[32]对低水分辣椒粉带菌状况进行调查,对48份低水分辣椒粉样品带菌状况进行取样分析,结果表明其带菌量在2.2h104~2.8h106CFU/g之间,平均带菌量为4.8h105CFU/g,球菌和芽孢杆菌为优势菌,含量分别为52.0%和46.0%,而杆菌(无芽孢)所占比例较低为2.0%。由此可见,辣椒所带菌群极易引起辣椒果实颜色的褪变,尽量减少辣椒果实的带菌量有助于减少辣椒花壳现象的发生。
[1] 庄灿然. 中国干制辣椒[M]. 北京: 中国农业科技出版社, 1995: 209-242.
[2] 王永平, 何嘉, 张绍刚, 等. 我国辣椒国内外市场需求现状及变化趋势[J]. 北方园艺, 2010(1): 213-216.
[3] 李萌, 龙彭年, 肖四海. 世界辣椒产业经济发展状况与我国的对策思考[J]. 辣椒杂志, 2010(4): 1-5.
[4] 中华人民共和国农业部. NY 5229ü2004 无公害食品: 辣椒干[S].北京: 中国农业出版社, 2004.
[5] 中华人民共和国国家进出口商品检验局. SN/T 0231ü1993出口辣椒干检验规程[S].
[6] 张志强, 江英, 田丽萍. 辣椒红色素的稳定性及在食品中的应用研究[J]. 中国调味品, 2006(4): 32-35.
[7] 金青哲, 齐策, 王兴国. 王鑫辣椒红色素的分离及光稳定性研究[J] .食品与生物技术学报, 2007, 26(2): 53-57.
[8] 丁筑红, 杨咏鹃, 刘坤. 不同干燥方法对辣椒品质的影响[J]. 食品科技, 2008(4): 57-60.
[9] 李明远, 武东繁. 干辣椒“虎皮”原因的调查与研究[J]. 植物保护, 1994, 20(2): 21-22.
[10] 李桂舫, 金静, 傅德峰, 等. 干制辣椒红色素丧失与病原菌的关系[J].中国蔬菜, 2008(12): 27-29.
[11] 邹学校. 辣椒遗传育种学[M]. 北京: 科学出版社, 2009: 13-58.
[12] 方中达. 植病研究方法[M]. 3版. 北京: 农业出版社, 1998: 179-185.
[13] 袁丽红. 微生物学实验[M]. 北京: 化学工业出版社, 2010: 72-77.
[14] 东秀珠, 蔡秒英. 常见细菌鉴定手册[M]. 北京: 科学出版社, 2001: 349-419.
[15] 沈萍, 陈向东. 微生物学实验[M]. 4版. 北京: 高等教育出版社, 2007: 47-51.
[16] 周德庆. 微生物学实验教程[M]. 2版. 北京: 高等教育出版社, 2006: 49-51.
[17] 牛天贵. 食品微生物学实验技术[M]. 北京: 中国农业大学出版社, 2002: 47-53.
[18] KIMURA M. A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences[J]. J Mol Evol, 1980, 16(2): 111-120.
[19] SAITOU N, NEI M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Mol Biol Evol, 1987, 4(4):406-425.
[20] 布坎南R E, 吉本斯N E. 伯杰细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984: 729-796.
[21] DEVEREUX R, HE S H, DOYLE C L, et al. Diversity and origin of Desulfovibrio species: phylogenetic def i nition of a family[J]. Journal of Bacteriology, 1990, 172(7): 3609-3619.
[22] VAISHAMPAYAN P, MIYASHITA M, OHNISHI A, et al. Description of Rummeliibacillus stabekisii gen. nov., sp. nov. and reclassification of Bacillus pycnus Nakamura, et al. 2002 as Rummeliibacillus pycnus comb. nov.[J]. Int J Syst Evol Microbiol, 2009, 59(5): 1094-1099.
[23] MATSUFUJI H, ISHIKAWA K, NUNOMURA O, et a1. Anti-oxidant content of different coloured sweet peppers, white, green, yellow, orange and red (Capsicum annuum L.)[J]. International Journal of Food Science and Technology, 2007, 42: 1482-1488.
[24] LANG Y Q, YANAGAWA S, SASANUMA T, et a1. Orange fruit color in Capsicum due to deletion of capsanthin-capsorubin synthesis gene[J]. Breeding Science, 2004, 54(1): 33-39.
[25] CAMERA B, MONEGER R. Free and esterif i ed carotenoids in green and red fruits of Capsicium annuum[J]. Phytochemistry, 1978. 17(1): 91-93.
[26] 金银根. 植物学[M]. 2版. 北京: 高等教育出版社, 2010: 25-27.
[27] FREY-WYSSLING A, KREUTZER E. The submicroscopic development of chromoplasts in the fruits of Capsicum annuum L.[J]. Journal Ultrastructure Research, 1958, 1(4): 397-411.
[28] 戴雄泽, 王利群, 陈文超, 等. 辣椒果实发育过程中果色与类胡萝卜素的变化[J]. 中国农业科学, 2009, 42(11): 4004-4011.
[29] 张甫生, 庞杰, 徐秋兰, 等. 辣椒红色素的研究进展[J]. 辣椒杂志, 2003(2): 37-41.
[30] 何红, 蔡学清, 洪永聪, 等. 辣椒内生细菌的分离及拮抗菌的筛选[J].中国生物防治, 2002, 18(4): 171-175.
[31] 张晓玲. 干辣椒微生物区系及保藏方法的研[D]. 重庆: 西南大学, 2008.
[32] 张春燕, 蔡静平, 潘峰. 低水分辣椒粉带菌状况及控制技术的研究[J]. 食品科学, 2007, 28(1): 131-134.
Isolation and Identif i cation of Bacteria Causing Discoloration in Red Pepper Fruits (Capsicum annuum L.)
LIU Hai,DING Zhu-hong*,ZHENG Wen-yu,XIAO Zhi-rou,DENG Cheng,YANG Qian
(College of Life Science, Guizhou University, Guiyang 550025, China)
Five dominant bacteria causing the discoloration of red pepper fruits (Capsicum annuum L.) were isolated from red pepper fruits following the traditional bacterial isolation procedures. Meanwhile, they were identified based on morphological observation, physiological and biochemical properties, 16S rDNA sequences and BLAST homology alignment as two Bacillus subtilis strains, one Lysinibacillus sphaericus strain, one Bacillus amyloliquefaciens strain, and one Bacillus pumilus strain, respectively.
red pepper;discoloration;isolation;identif i cation;phylogenetic analysis
TS207.4
A
1002-6630(2013)01-0160-06
2012-04-10
国家自然科学基金项目(31060228/C200301)
刘海(1988ü),男,硕士研究生,研究方向为食品加工与贮运保鲜技术。E-mail:573390817@qq.com
*通信作者:丁筑红(1966ü),女,教授,学士,研究方向为农产品贮藏加工与利用。E-mail:gzdxdzh@163.com
