微生物谷氨酰胺转氨酶对小麦粉品质的影响
2013-03-07李建科
李 鑫,赵 燕,李建科,*
(1.南昌大学 生物质转化教育部工程研究中心,江西 南昌 330047;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
微生物谷氨酰胺转氨酶对小麦粉品质的影响
李 鑫1,2,赵 燕1,2,李建科1,2,*
(1.南昌大学 生物质转化教育部工程研究中心,江西 南昌 330047;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
通过粉质、拉伸实验和凝胶渗透液相色谱分析,研究微生物谷氨酰胺转氨酶(MTG)对面团流变学特性和面筋蛋白的影响。结果表明:添加5U/g(以面粉计)的MTG后,面团稳定时间增加了18%,弱化度降低了15%,粉质指数得到提高;MTG对面团拉伸特性的影响更明显,且静置时间越长,对拉伸特性的改善效果越好;添加5U/g的MTG后,面粉悬浮液中ω5-醇溶蛋白和ωb-醇溶蛋白含量各显著减少了99%和88%左右;添加10U/g的MTG后,冻干面团中高分子质量谷蛋白亚基(HMW-GS)和ωb-醇溶蛋白含量分别减少了42%和25%。MTG通过催化面筋蛋白中各组分发生分子内及分子间的交联作用,增加面筋蛋白中大分子蛋白数量,提高面筋质量。MTG对面粉品质的改良效果明显,使其在烘焙食品中有广阔的应用前景。
微生物谷氨酰胺转氨酶(MTG);面团流变性能;面筋蛋白
1907年,Osborne根据小麦面粉中蛋白质的溶解特性,将小麦面粉蛋白质分为清蛋白(溶于水和稀缓冲液)、球蛋白(不溶于水而溶于盐溶液)、醇溶蛋白(溶于60%~90%乙醇)、麦谷蛋白(溶于稀酸和稀碱溶液),其中醇溶蛋白和麦谷蛋白为小麦储藏蛋白,两者合称为面筋蛋白[1-2]。醇溶蛋白根据不同电泳迁移率,可分为α-、β-、γ-、ω-4种类型,其中ω-醇溶蛋白又可以分为ω1,2-和ω5-两种类型。α-、β-醇溶蛋白的分子质量为3.1h104D,γ-醇溶蛋白的分子质量为3.3h104D,而ω-醇溶蛋白分子质量为4.4h104~7.4h104D[3-4]。麦谷蛋白是自然界中分子最大的蛋白质之一,在还原条件下根据其分子质量的不同,可分为高分子质量谷蛋白亚基(HMW-GS)和低分子质量谷蛋白亚基(LMW-GS),分子质量分别为8h104~
1.3h105D和1h104~7h104D[5-6]。面粉中面筋蛋白的含量和各组分的组成及比例等决定面团的流变性、持气性以及面制品的烘焙品质等[7]。
微生物谷氨酰胺转氨酶(MTG)通过微生物发酵分离纯化而来[8-9],它能催化蛋白质分子内或分子间的交联,蛋白质和氨基酸之间的连接及蛋白质分子内谷氨酰胺基的水解[10],从而改变蛋白质的结构和功能特性,改善食品的质构和口感,增加食品的营养价值[8]。面筋蛋白中的醇溶蛋白和谷蛋白都是MTG作用的良好底物,通过MTG的催化作用,可以促进面筋蛋白分子内和分子间的交联,增加面筋蛋白中的大分子数量,从而改善面筋蛋白中醇溶蛋白和谷蛋白的组成、含量及比例结构,优化面筋网络结构,增强面团筋力,提高面制品黏弹性、乳化性、起泡性等品质。另外,MTG能将赖氨酸交联到面筋网络上,减少赖氨酸在面制品加工过程中的损失,从而提高面制品的营养价值[11-12]。Larrέ等[13]于2000年用不同比例的酶与底物浓度进行实验,通过SDS-PAGE分析证实催化交联反应的存在,交联程度与MTG的用量和反应时间显著相关,且MTG对HMW-GS的作用效果最明显。Gerrard等[14]的研究表明,MTG可以增加面筋蛋白中醇溶蛋白组分的含量,且交联作用对HMW-GS也有较大影响。
本实验通过测定面团粉质和拉伸特性,考察添加MTG对面团流变学特性的影响;并应用凝胶渗透液相色谱(GP-HPLC)分析经MTG处理后的面团和面粉悬浮液中醇溶蛋白和谷蛋白各组分的含量和组成变化情况,探究MTG对面筋蛋白中不同组分的作用效果,分析其作用机理,为MTG在面粉以及面制品中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
MTG(200U/g) 深圳市绿微康生物工程有限公司;面粉(粗蛋白10.7%、水分12.2%、灰分0.5%) 辉县市银龙专用粉食品有限公司;低分子质量标准蛋白 北京博莱生物实验材料研究所。
1.2 仪器与设备
电子粉质仪、拉伸仪 北京东孚久恒仪器技术有限公司;LC-20A液相色谱仪 日本岛津公司;Talboys基础型漩涡混合器 上海安谱科学仪器有限公司;5810R冷冻型台式大容量高速离心机 德国Eppendorf公司。
1.3 方法
1.3.1 面团粉质特性和拉伸特性测定
分别向面粉中添加0~10U/g的MTG(以面粉计),混合均匀,参照GB/T 14614ü2006《小麦粉面团的物理特性吸水量和流变学特性的测定 粉质仪法》的方法,进行粉质实验。
向面粉中添加5U/g的MTG,混合均匀,参照GB/T 14615ü2006《小麦粉 面团的物理特性流变学特性的测定 拉伸仪法》的方法,测定面团拉伸特性,并与不添加MTG的面粉进行对照。
1.3.2 面筋蛋白的分离及分析
1.3.2.1 样品制备
面粉悬浊液:准确称取2.0g面粉5份,分别添加不同浓度的稀释好的酶液20mL(Tris-HCl缓冲液,0.2mol/L,pH6.0),25℃条件下磁力搅拌10min后快速转移到4℃冰箱中,终止反应。
冻干面团:准确称取10.0g面粉5份,分别添加不同浓度的稀释好的酶液6.3mL(3.2%的NaCl溶液),将面粉在3min内揉成光滑的面团后,在37℃,相对湿度为80%的恒温箱中静置10min,再迅速转移到—20℃冰箱中冷冻,真空冷冻干燥24h,粉碎,过120目筛。
1.3.2.2 面筋蛋白的分离
分别取MTG处理后的面粉悬浊液2mL,4℃、4000r/min离心10min,残留物中加入2mL水,室温涡流振荡10min,4℃、4000r/min离心10min,两次离心上清液合并;残留物依次用2mL盐溶液(0.4mol/L NaCl+0.062mol/L Na2HPO4,pH7.6)、2mL体积分数60%乙醇溶液和2mL SDS-Tris-HCl缓冲液(1.5% SDS+1% DTE溶于0.063mol/L Tris-HCl缓冲液,pH7.5)在室温或者70℃(谷蛋白)涡流振荡10min,再于4℃或20℃(谷蛋白)离心10min,分离上清液,各组分振荡离心两次,上清液合并。所得的各组分用各自的提取液定容至4mL。最后所得残留物用氮气吹干。
分别准确称取0.20g经MTG处理后的冻干面团粉末,加入2mL体积分数60%乙醇溶液,室温涡流振荡10min,4℃、4000r/min离心10min,残留物再用2mL乙醇溶液振荡离心一次,上清液合并;离心所得残留物中加入2mL SDS-Tris-HCl缓冲液,室温涡流振荡和20℃离心两次,上清液合并。所得各组分用各自提取液定容至4mL。最后残留物用氮气吹干。
1.3.2.3 面筋蛋白的分析
分离的醇溶蛋白和谷蛋白各组分在GP-HPLC分析前用0.45μm半透膜过滤[15]。过膜后的醇溶蛋白和谷蛋白根据Bauer等[15]的方法,进行GP-HPLC分析。
岛津LC-20A液相色谱仪:色谱柱:TSKgel G2000SWXL(5)7.8mmh300mm;25℃;流动相:SDSTris-HCl缓冲液(1.5% SDS溶于0.063mol/L Tris-HCl缓冲液,pH7.0);进样量:5μL;流速:0.3mL/min;紫外检测器;检测波长:220nm。
用一系列已知相对分子质量的低分子蛋白质标准物,根据其相对分子质量和淋洗时间作蛋白质相对分子质量的校准曲线。
2 结果与分析
2.1 MTG对面团粉质特性和拉伸特性的影响
面团在揉和过程中及面团形成后表现出的各种物理特性,能很好地反映面粉加工的品质,尤其是烘焙品质[16]。通过粉质仪测定面团的揉和特性,发现MTG对面团粉质特性有一定的改善,如表1所示,尤其是面团的稳定时间和弱化度。添加MTG后,面团稳定时间从3.3min增加到3.9min(5U/g),增加了18%,但当MTG添加量过大(10U/g),稳定时间有所减小(3.7min);面团弱化度从171BU一直降到145BU(10U/g),降低了15%左右;面团粉质指数也得到提高;而MTG对面团的粉质吸水率没有多大的影响。实验结果与Basman[17]、陈晓明[18]等的研究结果基本一致,这说明通过MTG催化交联作用,增加了面筋蛋白中大分子聚合体的数量,改善了面筋网络空间结构,提高了面筋强度,使得面团抗破坏能力增强,弹性增强,流变性能得到改善。在一定添加量范围内(0~10U/g),MTG添加量越大,面团粉质特性越好。

表 1 MTG对面团粉质特性的影响Table 1 Effect of MTG on farinographic properties of dough
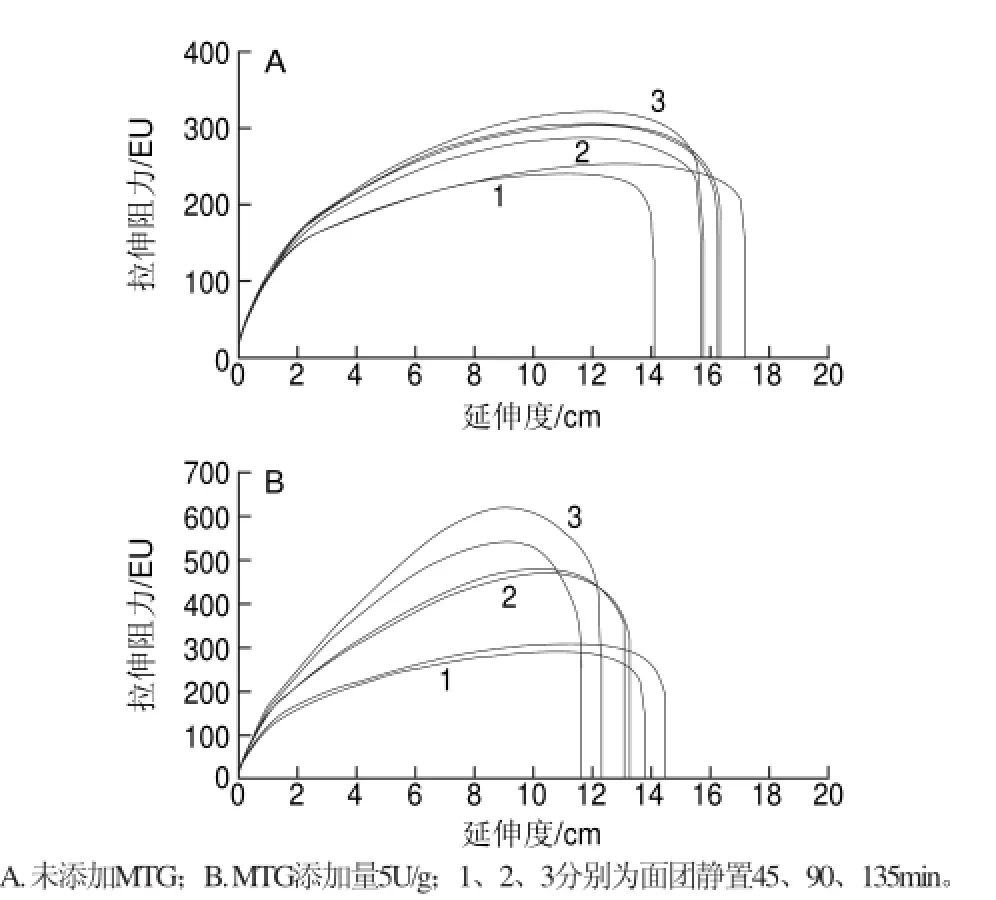
图 1 面团拉伸曲线Fig.1Extensograph curve of dough
拉伸曲线反映面团在外力作用下在产生变形的过程,其变形程度与面团本身的延伸性与抗延伸性有关[16]。MTG添加量为0和5U/g时的面团拉伸曲线如图1所示,MTG对面团拉伸特性的影响非常明显(表2),且静置时间越长,MTG对面团的拉伸特性影响越大。添加5U/g的MTG时,静置45min,面团拉伸特性变化比较小,而静置90min和135min后,面团拉伸特性改善非常明显。面团静置135min后,拉伸能量和拉伸阻力分别增大了18.4%和92.6%,拉伸比从1.3增加到3.7,而延伸度降低了31.8%,这进一步说明MTG使得面筋网络结构更牢固,面团筋力和弹性增强,延伸性降低,持气能力增强。
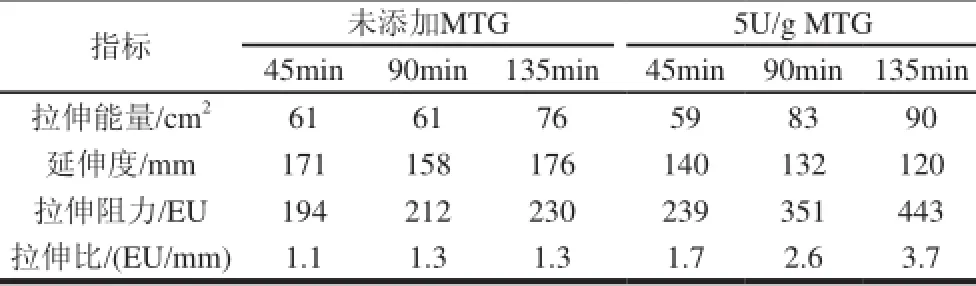
表 2 MTG对面团拉伸特性的影响Table 2 Effect of MTG extensographic properties of dough
粉质特性实验和拉伸特性实验表明,MTG能有效改善面团的弹性和延伸性,改善面团的流变性能,使得面筋网络结构更稳定,进而提高面粉和面制品的加工品质和烘焙品质。
2.2 MTG对面筋蛋白的影响
为了得到更加明显的实验效果,MTG添加量都比实际应用中的添加量高。将经MTG处理后的面粉悬浮液离心并将残渣依次用水、盐溶液、60%乙醇溶液(醇溶蛋白)和含有还原剂(DTE)的SDS溶液(谷蛋白)振荡离心两次。分离得到的醇溶蛋白、谷蛋白和不溶性残留蛋白分别用凯氏定氮法测定其中粗蛋白含量,结果如表3所示。
表 3 MTG对面粉悬浮液和冻干面团中各组分粗蛋白含量的影响(±s,n=2)Table 3 Effect of MTG on protein content in Osberne fraction of fl our suspensions and frozen dough (±s,n=2)
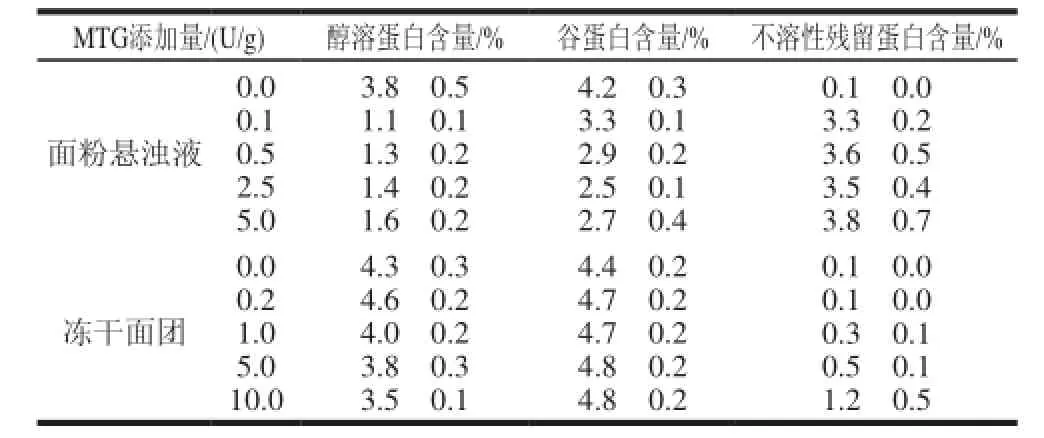
表 3 MTG对面粉悬浮液和冻干面团中各组分粗蛋白含量的影响(±s,n=2)Table 3 Effect of MTG on protein content in Osberne fraction of fl our suspensions and frozen dough (±s,n=2)
注:MTG添加量均以面粉计。
MTG添加量/(U/g)醇溶蛋白含量/%谷蛋白含量/%不溶性残留蛋白含量/%面粉悬浊液0.0 0.1 0.5 2.5 5.0 3.8f0.5 1.1f0.1 1.3f0.2 1.4f0.2 1.6f0.2 4.2f0.3 3.3f0.1 2.9f0.2 2.5f0.1 2.7f0.4 0.1f0.0 3.3f0.2 3.6f0.5 3.5f0.4 3.8f0.7 0.1f0.0 0.1f0.0 0.3f0.1 0.5f0.1 1.2f0.5冻干面团0.0 0.2 1.0 5.0 10.0 4.3f0.3 4.6f0.2 4.0f0.2 3.8f0.3 3.5f0.1 4.4f0.2 4.7f0.2 4.7f0.2 4.8f0.2 4.8f0.2
由表3可知,添加MTG后,面粉悬浊液中醇溶蛋白和谷蛋白含量发生明显变化。醇溶蛋白的含量在添加0.1U/g的 MTG后显著减少(3.8%减少到1.1%),此后随着MTG添加量的增大,其含量又有少许增加(1.1%增加到1.6%)。MTG对面粉悬浊液中的谷蛋白含量也有影响,MTG添加量增加到2.5U/g时,谷蛋白含量持续从4.2%降低到2.5%。在未添加MTG时,面粉中谷蛋白基本上能完全溶于含水乙醇(室温)和添加了还原剂的SDS溶液(70℃),此时不溶性残留蛋白几乎是以自由蛋白的形式存在(0.1%~0.2%)[15]。而添加MTG后,不溶性残留蛋白含量显著增加,这是由于MTG的催化交联作用促使醇溶蛋白和谷蛋白分子间和分子内的相互转化,生成分子质量更大且不溶于SDS溶液的蛋白质。
通过粗蛋白含量测定发现冻干面团中添加10U/g的MTG后,面粉中醇溶蛋白含量由4.3%减少到3.5%,减少了18.6%,谷蛋白和不溶性残留蛋白含量都有所增加。冻干面团中醇溶蛋白、谷蛋白及不溶性残留蛋白含量变化没有面粉悬浮液中那么明显,这可能与面团体系中的水含量比面粉悬浮液中水含量要少有关。
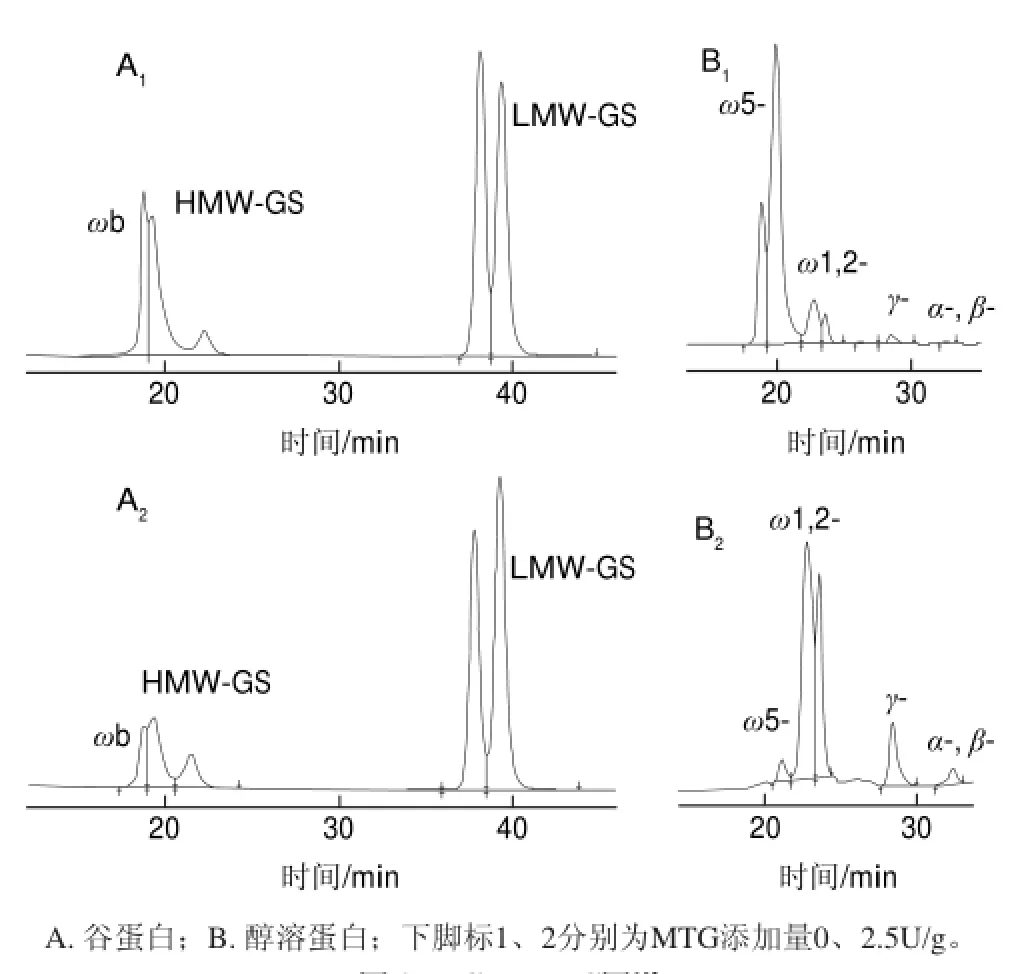
图 2 GP-HPLC图谱Fig.2HPLC prof i les of glutens and gliadins in the presence of MTG at different concentrations
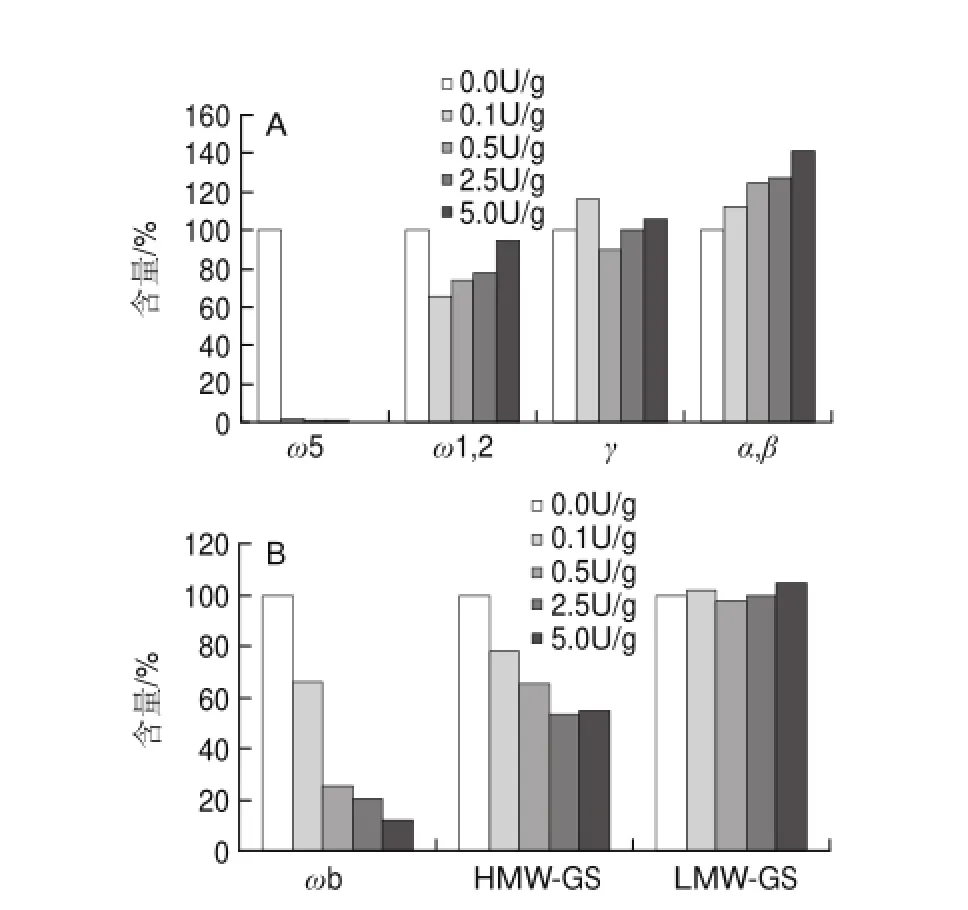
图 3 添加不同量MTG后面粉悬浊液中醇溶蛋白(A)和谷蛋白(B)各组分含量变化Fig.3 Effect of MTG on the contents of different fractions of gliadin and gluten in fl our suspension
MTG通过催化交联作用,而增强面团的筋力提高面制品的品质。为了了解MTG交联作用的蛋白质底物,进而研究其作用机理,就有必要分析面筋蛋白各组分含量变化情况。根据蛋白质分子质量校准曲线为y=—1.2334x+6.146(R2=0.994),其中x为蛋白质分子质量的对数值(lgMw),y为分配系数(Kav)。面筋蛋白中各蛋白组分的分子质量大小和图2,可以确定谷蛋白中ωb-醇溶蛋白的洗脱时间为18~19min,HMW-GS的洗脱时间为19~20min,而LMW-GS的洗脱时间为37~42min。醇溶蛋白中洗脱时间在18~20min为ω5-醇溶蛋白,20~25min为ω1,2-醇溶蛋白,28~30min为γ-醇溶蛋白,32~35min为α-、β-醇溶蛋白。
不同添加量MTG作用后,面粉悬浮液中测定的醇溶蛋白和谷蛋白中各个组分的含量变化如图3所示。醇溶蛋白中的ω5-醇溶蛋白受MTG作用效果最明显,其含量从100%(0U/g)显著减少到1%以下(0.5U/g);ω1,2-醇溶蛋白含量也有所降低,含量先减少到65.4%(0.1U/g)后又增加到94.7%(5U/g);γ-醇溶蛋白含量基本上没有多大变化,而α-、β-醇溶蛋白含量随着MTG添加量的增加而增加了41%左右(5U/g)。谷蛋白中,添加5U/g的MTG后,ωb-醇溶蛋白含量减少了88%左右,HMW-GS含量也减少了46%左右,而LMW-GS含量基本上没有多大变化。由结果可知,参与交联反应的主要是ω-醇溶蛋白和HMW-GS,这与Larrέ[13]、Bauer[15]等的研究基本一致。Bauer等[15]认为不能仅仅以面筋蛋白各组分中的谷氨酰胺(Gln)含量(表4)来解释MTG催化反应的机理,因为Gln在面筋蛋白各组分中含量都很高(34%~56%)[19]。其中ω5-醇溶蛋白和ω1,2-醇溶蛋白中Gln含量达到43%~56%,所以ω-醇溶蛋白在交联作用中能更好的作为酰基供体而参与反应。此外,赖氨酸(Lys)含量也是交联反应中的一个限制因素,Lys残基上的ω-氨基作为酰基转移反应中的酰基受体,使得交联反应顺利进行。HMW-GS中Lys含量最高(0.7%~1.1%),每个分子都含有5~8个Lys残基,而LMW-GS中每个蛋白质分子只含有1个Lys残基,故HMW-GS通过交联反应能更好地转化为分子质量更大的大分子物质。Bauer等[15]还认为α-、β-醇溶蛋白通过交联作用后转化为大分子物质从而其含量会减少,但本研究中α-、β-醇溶蛋白含量反而有所增加,可能原因是实验样品提取过程中有少量MTG残留,干扰了实验结果。LMW-GS含量基本上没有变化,这与LMW-GS肽链中Lys残基的位置与其他蛋白组分中Lys残基位置不同以及LMW-GS中Lys残基含量相对较少有关。α-、β-醇溶蛋白中Lys既不是位于肽链中的C端也不是位于N端,很容易受MTG催化交联作用,而LMWGS中Lys残基位于由半胱氨酸形成的分子内二硫键内的半封闭区域,受空间效应而不能很好的参与交联作用[20]。
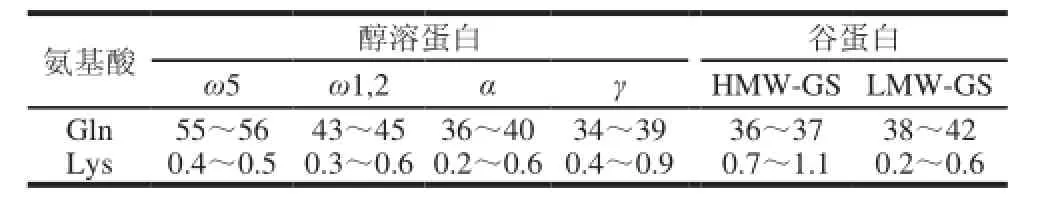
表 4 谷蛋白各组分中Gln和Lys含量Table 4 Gln and Lys content (mol %) in glutens and gliadins
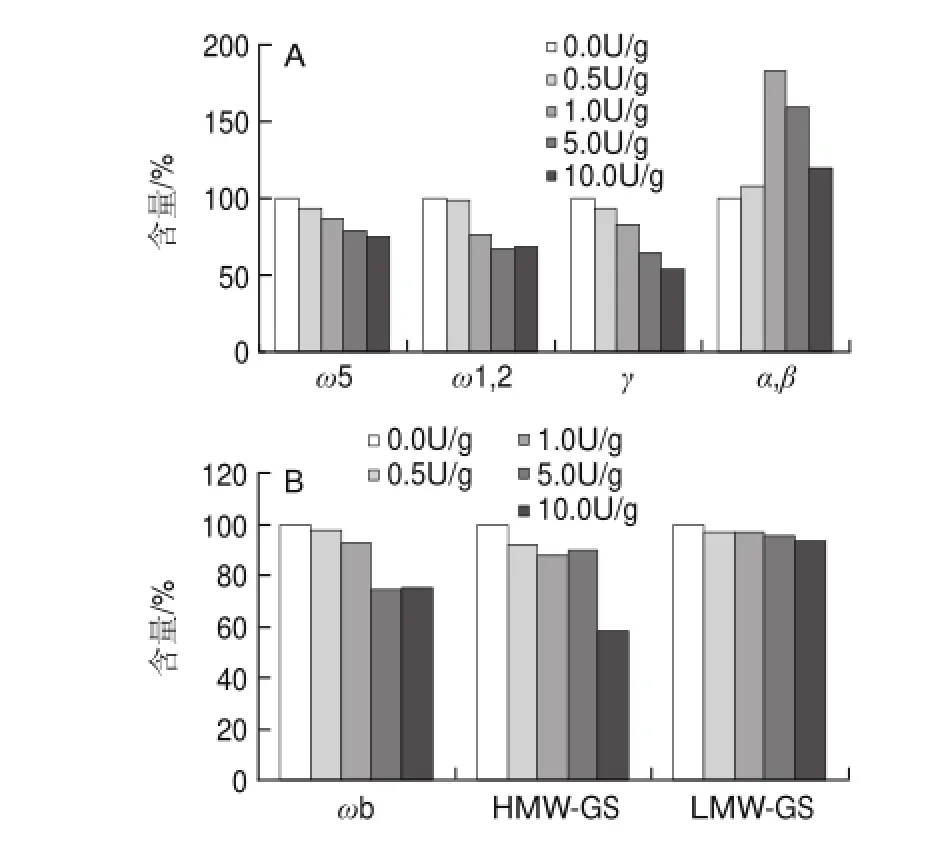
图 4 冻干面团中不同MTG添加量下醇溶蛋白(A)和谷蛋白(B)各组分含量变化Fig.4Effect of MTG on the contents of different fractions of gliadin and gluten in in frozen dough
将一定量面粉与含有不同添加量MTG(0~10U/g)的NaCl溶液混合,和成面团,反应一段时间后,将面团冷冻干燥,磨成粉末,过筛后分别用60%乙醇溶液和含还原剂的SDS溶液提取其中醇溶蛋白和谷蛋白。与面粉悬浊液相比,冻干面团并没有用用纯水和盐溶液提取,而是直接用乙醇溶液提取,是为了避免催化交联反应在用纯水和盐溶液提取时继续进行而影响实验结果。粗蛋白含量测定结果见表4,GP-HPLC测定醇溶蛋白和谷蛋白中各个组分的含量变化情况如图4所示。添加10U/g的MTG后,ω5-、ω1,2-、γ-醇溶蛋白含量分别减少了26%、33%、46%,ωb和HMW-GS含量也分别减少了25%和42%,而LMW-GS含量基本上没有变化。冻干面团中各组分的含量变化情况大体上与面粉悬浊液相似,只是反应强度比较温和,主要原因是面团中的面筋蛋白不能像在水溶液中那样充分、顺利地展开,交联作用受到的空间阻碍较大[15]。
醇溶蛋白和谷蛋白中的各组分都是MTG催化作用的良好底物,尤其是Gln残基和Lys残基含量较高的HMW-GS和ω-醇溶蛋白。GP-HPLC分析进一步证实,MTG能促进面筋蛋白分子间与分子内的相互转化,将面筋蛋白中小而不规则的蛋白质分子相互交联成大而均匀的蛋白质分子,使得面团的空间网络结构更稳定。
3 结 论
MTG能有效改善面团的粉质特性和拉伸特性,提升面团的流变性和加工性能,随着MTG添加量从0U/g增大到10U/g,面团粉质指数从52增大到60;添加MTG后,面团拉伸阻力、拉伸能量和拉伸比均增大,而延伸度降低,且静置时间越长,作用效果越明显。GP-HPLC分析发现面筋蛋白中的ω-醇溶蛋白和HMW-GS最容易受MTG作用,这主要与这两种蛋白亚基中的Gln和Lys含量及其空间结构有关。由于MTG的价格较高,限制了其在面制品上的应用,因此,提高MTG的酶活,降低其生产成本,是目前研究人员需要迫切解决的问题。
[1] 刘冬儿. 小麦蛋白制品的开发和利用[J]. 食品科技, 1999(1): 22-25.
[2] 贾光锋, 范丽霞, 王金水. 小麦面筋蛋白结构、功能性及应用[J]. 粮食加工, 2004(2): 11-13.
[3] 董超华, 徐如宏, 张庆勤. 小麦醇溶蛋白和谷蛋白研究进展[J]. 山地农业生物学报, 2003, 22(2): 164-168.
[4] 郝春燕, 李建国, 李雅轩, 等. 小麦醇溶蛋白基因克隆研究进展[J].首都师范大学学报: 自然科学版, 2006, 27(2): 67-70.
[5] 张海华, 周惠明. 小麦面筋蛋白结构及其改性研究[J]. 粮食与油脂, 2010(9): 1-3.
[6] 王怡然, 王金水, 赵谋明, 等. 小麦面筋蛋白组成、结构和特性[J].食品工业科技, 2007, 28(10): 228-231.
[7] KINETICS A, KRISTIINA K, ANTTI K, et al. Kinetics of transglutaminase-induced cross-linking of wheat proteins in dough[J]. Agricultural and Food Chemistry, 2005, 53: 1039-1045.
[8] ANDO H, ADACHI M,UMEDA K, et al. Purification and characteristics of a novel transglutaminase derived from microorganisms[J]. Agricultural and Biological Chemistry, 1989, 53(10): 2613-2617.
[9] 周迪楠, 田亚平, 华子安, 等. 微生物转谷氨酰胺酶的纯化方法和酶学性质研究[J]. 工业微生物, 2004, 34(3): 20-23.
[10] FOLK J E, CHUNG S I. Molecular and catalytic properties of transglutaminases[J]. Adv Enzymol Relat Areas Mol Biol, 1973, 38: 91-109.
[11] IWAMI K, YASUMOTO K. Amine-binding capacities of food proteins in transglutaminase reaction and digestibility of wheat gliadin with ε-attached lysine[J]. Food Agriculture, 1986, 37: 495-503.
[12] SEGURO K, KUMAZAWA Y, KURAISHI, C, et al. The ε-(γglutamyl) lysine mojety in crosslinked casein is an available source for lysine for rats[J]. Nutrition, 1996, 126: 2557-2562.
[13] LARRέC, DESSERME C, BARBOT J, et al. Biochemical analysie and rheological properties of gluten modif i ed by transglutaminase[J]. Cereal Chemistry, 2000, 77: 121-127.
[14] GERRARD J A, FAYLE S E, BROWN P A, et al. Effects of microbial transglutaminase on the wheat proteins of bread and croissant dough[J]. Food Science, 2001, 66: 782-786.
[15] BAUER N, KOEHLER P, WIESER H, et al. Studies on effects of microbial transglutaminase on gluten proteins of wheat. Ⅰ. Biochemical analysis[J]. Cereal Chemistry, 2003, 80(6): 781-781.
[16] 田建珍. 专用小麦粉生产技术[M]. 郑州: 郑州大学出版社, 2004.
[17] BASMAN A, KÖKSEL H, PERRY K. Effects of increasing levels of transglutaminase on the rheological properties and bread quality characteristics of two wheat flours[J]. European Food Research and Technology, 2002, 215(5): 419-424.
[18] 陈晓明. 谷氨酰胺转氨酶对大豆粉-面粉面团特性的影响[J]. 食品与机械, 2008, 24(1): 139-142.
[19] WIESER Y, RINZEMA A, TRAMPER J, et al. Klassifizierung der proteinkomponenten des Weizenklebers[J]. Getreide Mehl Brot, 1991, 45: 35-38.
[20] MÜLLER S, WISER H. The location of disulphide bonds in monomeric γ-type gliadins[J]. Cereal Science, 1997, 26: 169-176.
Inf l uence of Microbial Transglutaminase on the Quality of Wheat Flour
LI Xin1,2,ZHAO Yan1,2,LI Jian-ke1,2,*
(1. Engineering Research Center of Biomass Conversion, Ministry of Education, Nanchang University, Nanchang 330047, China;2. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
The influence of microbial transglutaminase (MTG) on the rheological properties of dough and gluten was investigated by farinograph and extensograph measurement and HPLC analysis. When 5 U/g MTG was added to wheat fl our, the dough stability time increased by 18%, the degree of softening decreased about 15%, and the farinograph index also ascended. Addition of 5 U/g MTG had more signif i cant effects on extensograph properties, and the longer the standing time, the better extensograph properties were improved. In addition, the contents of ω5-gliadin and ωb-gliadin in fl our suspension declined by 99% and 88%, respectively, as opposed to 42% and 25% observed when 10 U/g MTG was added. MTG could improve the quality of gluten by catalyzing the intermolecular and intramolecular interactions of various components and producing more macromolecular proteins. In conclusion, MTG is effective in improving the quality of fl our and therefore has wide prospects for applications in baked foods.
microbial transglutaminase (MTG);dough rheological properties;gluten
TS211.4
A
1002-6630(2013)01-0135-05
2011-10-18
李鑫(1986ü),男,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:xinxin19861104@163.com
*通信作者:李建科(1962ü),男,教授,博士,研究方向为食品科学、化学工程与生物质转化。E-mail:jianke_li@yahoo.com
