醌茜素荷移分光光度法测定盐酸伊托必利
2013-03-06赵杰李华侃
赵杰,李华侃
(辽宁医学院化学教研室,辽宁 锦州 121001)
醌茜素荷移分光光度法测定盐酸伊托必利
赵杰,李华侃
(辽宁医学院化学教研室,辽宁 锦州 121001)
目的 建立测定盐酸伊托必利含量的方法。方法 盐酸伊托必利与醌茜素在碱性条件下可发生电荷转移反应,形成稳定的11∶型荷移络合物,在最大吸收波长578 nm处测定络合物的吸光度。结果 盐酸伊托必利药物质量浓度在20.0~140.0 mg·L-1内服从比耳定律,相关系数为0.999 1,RSD为0.62%,表观摩尔吸光系数为2.03×103L·mol-1·cm-1,回收率为99.1%~102.3%。结论 方法准确、简便、快捷,可用于测定片剂中盐酸伊托必利的含量。
盐酸伊托必利;醌茜素;荷移反应;分光光度法
盐酸伊托必利(itopride hydrochloride,IH)是具有双重作用机制的新型促胃肠动力药,主要用于治疗功能性消化不良及慢性胃炎患者因胃肠动力障碍引起的上腹部不适、餐后饱胀、食欲缺乏、恶心、呕吐等各种症状。目前测定IH的方法有紫外分光光度法[1]、流动注射化学发光法[2]、毛细管电泳法[3]、高效液相色谱法[4,5]等。而采用醌茜素(quinalizarin,QLZ)荷移分光光度法对IH的研究尚未见报道。本文参考有关文献[6],研究了IH与QLZ的荷移反应条件和产物的光谱性质,探讨了反应机制, 建立了简便、快捷的测定IH的荷移分光光度法,并用该法测定了片剂中IH的含量,结果令人满意。
1 试验部分
1.1 仪器与试剂
UV-2550型紫外可见分光光度计(日本岛津公司);721型分光光度计(上海第三分析仪器厂);HH-S数显恒温水浴锅(江苏省金坛市医疗仪器厂);PHS-25数显酸度计(上海精科)。
5×10-4mol·L-1QLZ(北京化工厂)乙醇溶液:准确称取QLZ 27.2 mg溶于适量乙醇中,并用乙醇稀释至200 mL;
1.0 g·L-1IH对照品(中国药品生物制品检定所,批号:100939-200701)溶液:称取IH对照品100.0 mg,置50 mL量瓶中,加水溶解并稀释至刻度,摇匀,即得对照品储备液。精密吸取对照品储备液25 mL,置于50 mL量瓶中,加入0.1 mol·L-1NaOH溶液1.0 mL,然后用水稀释至刻度,摇匀,即得pH 9.20的对照品溶液;
IH片剂(修正药业集团长春高新制药有限公司,批号:101201,120901,120903,规格:50 mg·片-1);所用其他试剂均为分析纯,试验用水为二次蒸馏水。
1.2 试验方法
取适量IH溶液(含IH≤0.70 mg)于5 mL具塞比色管中,加入QLZ乙醇溶液3.5 mL,用溶剂稀释至刻度(控制体系中乙醇和水的体积比为73)∶,摇匀,在室温下放置10 min后,以空白试剂为参比,用1 cm比色皿,在578 nm波长处测定吸光度。
2 结果与讨论
2.1 吸收光谱
按试验方法配制一系列不同组分的溶液,在400~800 nm内扫描,吸收光谱见图1,由图1可以看出,IH在可见光区没有吸收,QLZ的λmax= 490 nm,荷移络合物的λmax=578 nm,由于最大吸收波长发生红移,说明生成荷移络合物。故本试验选择578 nm作为测定波长。
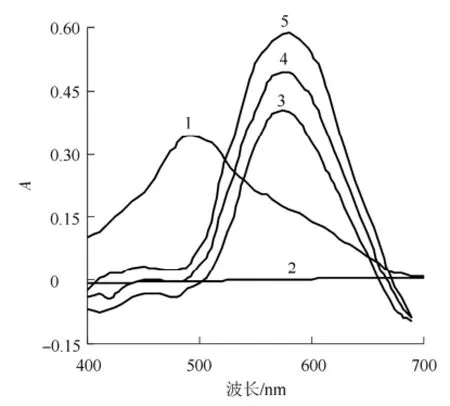
图1 吸收光谱1-醌茜素(CQLZ=1.0×10-4mol·L-1);2-依托必利(C依托必利=2.5×10-4mol·L-1);3、4、5-荷移络合物(CIH:2.0×10-4mol·L-1;2.5×10-4mol·L-1;3.0×10-4mol·L-1)Fig 1 Absorption spectra 1-QLZ(CQLZ=1.0×10-4mol·L-1); 2-IH(CIH=2.5×10-4mol·L-1); 3, 4, 5-IHQLZ charge-transfer complex(CIH: 2.0×10-4mol·L-1; 2.5×10-4mol·L-1; 3.0×10-4mol·L-1)
2.2 反应时间的影响
取IH溶液适量于5 mL比色管中,加入QLZ乙醇溶液3.5 mL,用溶剂稀释至刻度(控制乙醇和水的体积比为73)∶,以试剂空白为参比,分别放置5,10,20,30,40,50 min后测定吸光度分别为0. 490,0. 495,0.496,0. 494,0. 497,0. 494。结果表明,产物的吸光度10 min后基本不随反应时间的变化而变化,配好溶液放置10 min后可作比色测定,并在2 h内吸光度基本不变。
2.3 反应温度的影响
按试验方法,分别在15,20,25,30,35,40 ℃ 水浴中保温10 min后冷却至室温,测得溶液吸光度分别为0. 494,0.501,0. 495,0.502,0.496,0.498。可见溶液的吸光度基本不随反应温度的变化而变化,故本试验选择在室温下测定吸光度。2.4 溶剂的影响
按试验方法,分别选用水、甲醇、乙醇、乙腈、丙酮、三氯甲烷做溶剂,所测溶液的吸光度分别为0.495,0.305,0.298,0.287,0.221,0.196。结果表明,水作溶剂灵敏度最高。另外,由于QLZ溶液是用乙醇配制的,因此,本方法使用乙醇和水混合溶剂。保持其他条件不变,只是改变体系中乙醇和水的体积比,当乙醇和水的体积比分别是73∶,82∶,91∶时,测得溶液的吸光度分别为0.498,0.402,0.296。以上数据说明,乙醇和水体积比为73∶时反应灵敏度最高。
2.5 QLZ用量的影响
按试验方法,只是改变QLZ的用量,当QLZ用量分别是1.5,2.0,2.5,3.0,3.5,4.0 mL时,所测溶液的吸光度分别为0.243,0.345,0.433,0.475,0.496,0.467。说明QLZ用量为3.5 mL时,反应可以进行完全。故本试验选择QLZ溶液的用量为3.5 mL。
2.6 pH对反应的影响
分别配制不同pH的IH对照品溶液,按试验方法进行测定,吸收光谱见图2,由图2可以看出,IH-QLZ荷移反应的最佳酸度是pH 9,当pH超过10以后,随着试剂空白颜色的加深,吸光度值下降,同时溶液的稳定性变差。故本试验选择IH对照品溶液的pH为9.12。

图2 吸收光谱1-pH=7.09;2-pH=8.01;3-pH=9.12;4-pH=10.08;5-pH=11.02Fig 1 Absorption spectra 1-pH=7.09; 2-pH=8.01; 3-pH=9.12; 4-pH=10.08; 5-pH=11.02
2.7 方法的精密度
取IH溶液0.5 mL,按试验方法平行配制6份溶液,测得溶液的吸光度分别为0.492,0.497,0.496,0.495,0.494,0.501。通过计算可知,当IH浓度为100.0 mg·L-1时,6次测定结果RSD为0.62%。
2.8 线性范围
取IH对照品适量,加水溶解并制成浓度为20.0,40.0,60.0,80.0,100.0,120.0,140.0 mg·L-1的线性系列溶液,以IH的质量浓度与其吸光度绘制工作曲线(每个浓度点平行3份)。其线性回归方程为:A=0.005 13c-0.019 74(浓度单位是mg·L-1),相关系数r=0.999 1,表观摩尔吸光系数为2.03× 103L·mol-1·cm-1,IH质量浓度在20.0~140.0 mg·L-1范围内服从比耳定律。
2.9 反应机制探讨
IH分子中的叔氮原子在酸性条件下质子化,在碱性溶液中,氮原子去质子后可作为n电子供体,QLZ是一个平面型π电子受体,IH与QLZ反应可形成n-π型荷移络合物。用等摩尔连续变化法和摩尔比法测定络合物的组成比为11∶,荷移反应可表示如下:
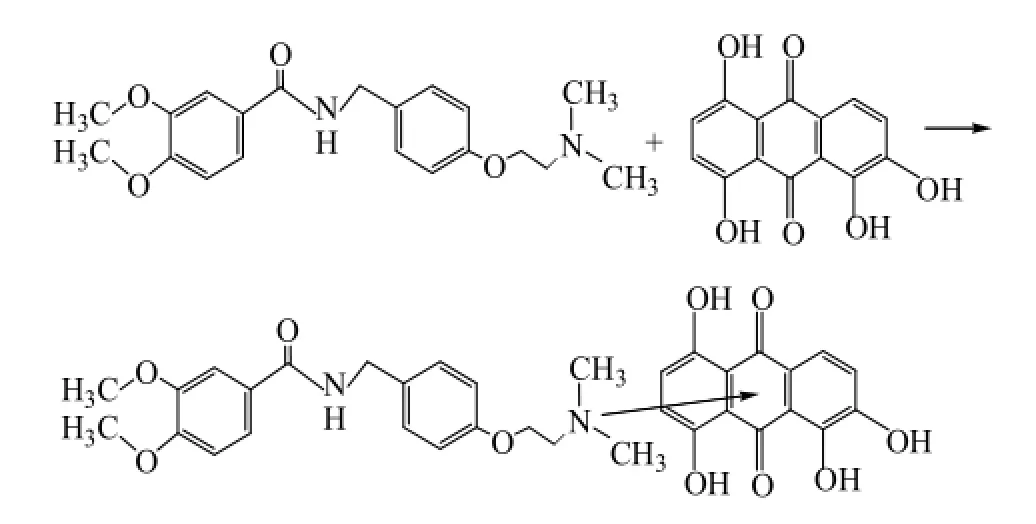
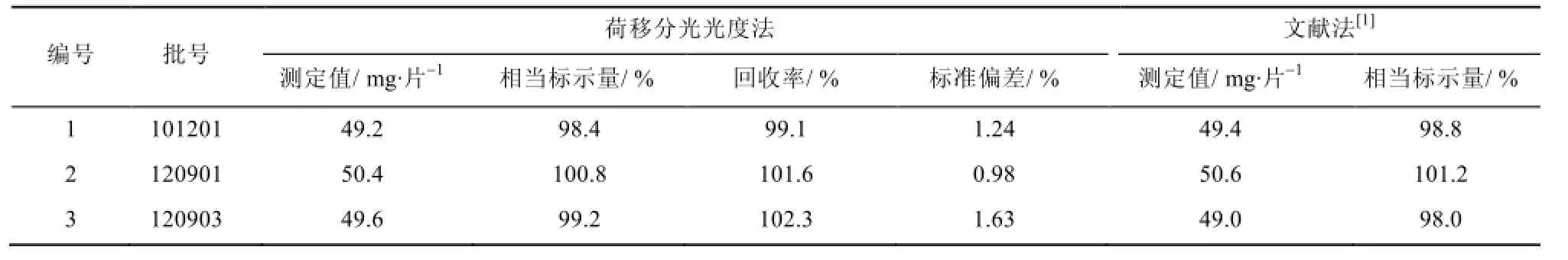
表1 样品分析结果及回收率试验结果(n=5)Tab 1 Analytical results of samples and results of tests for recovery(n=5)
3 样品测定
3.1 样品溶液的制备
取IH片剂(标示量是50 mg·片-1)20片,准确称量后,研细。精密称取总量1/10的样品粉末,置50 mL量瓶中,加水适量,振摇使其溶解完全,并用水稀释至刻度,摇匀,滤过,精密量取续滤液25 mL,置50 mL量瓶中,加入0.1 mol·L-1NaOH溶液1.0 mL,然后用水稀释至刻度,摇匀。
3.2 样品分析及回收率试验
准确移取适量IH样品溶液于5 mL比色管中,分别以荷移分光光度法和文献法[1]中的紫外分光光度法进行测定,同时采用标准加入法作回收率试验,结果见表1。回收率试验说明,样品中辅料对测定基本无干扰。
4 讨论
本方法选择醌茜素与盐酸依托必利进行荷移反应而显色,在578 nm处对其制剂进行测定。文献法[1]选择在水溶液中,258 nm处,用紫外分光光度法直接测定盐酸依托必利的含量。与文献法[1]比较,本方法选择性好,易于排除干扰,测定在可见光区进行,线性范围宽,具有一定的实用价值,为盐酸伊托必利片剂中有效成分分析及质量评价提供参考。
试验表明,醌茜素荷移分光光度法可以快速检测片剂中盐酸伊托必利的含量,方法简便,灵敏度高, 结果准确可靠。
REFERENCES
[1] WS1-(X-079)-2004Z(国家食品药品监督管理局国家药品标准) [S]. 52: 185-186.
[2] SHANG G R, WANG J W, YANG W P. Chemiluminescence flow system for determination of itopride hydrochloride with immobilized reagents [J]. Chin J Anal Lab(分析试验室), 2008, 27(5): 102-104.
[3] LÜ H Y, LI M Y, YU H L, et al. Determination of itopride hydrochloride by capillary electrophoresiscoupled with electrochem ilumolinescence method [J]. Chin J Pharm Anal(药物分析杂志), 2010, 30(1): 91-94.
[4] ZHAO Y P. Determination of itopride hydrochloride capsule by HPLC [J]. Tianjin Pharm (天津药学), 2000, 12(2): 60-61.
[5] XIE G F, LI Y F, LI Z H. Determination of itopride hydrochloride tablets by RP-HPLC [J]. China Pharm(中国药师), 2009, 12(4): 461-462.
[6] LI H K, XU X. Spectrophotometric determination of clarithromycin based on the charge transfer reaction between clarithromycin and alizarin red [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2006, 23(1): 47-49.
Spectrophotometry Determination of Itopride Hydrochloride Based on Charge-transfer Reaction with Quinalizarin
ZHAO Jie, LI Huakan
(Department of Chemistry, Liaoning Medical College, Jinzhou 121001, China)
OBJECTIVE To establish a method for determination of itopride hydrochloride. METHODS Itopride hydrochloride reacted with quinalizarin to form stable charge transfer complex whose composition ratio is 1∶1 under alkaline conditions and could be determined at 578 nm. RESULTS Beer′s Law is obeyed in the range of 20.0-140.0 mg·L-1of itopride hydrochloride and the correlation coefficient is 0.999 1. And RSD is 0.62%. The apparent molar absorptivity of the complex is 2.03×103L·mol-1·cm-1. The recoveries are 99.1%~102.3%. CONCLUSION The method is simple, rapid and accurate, can be used to the determination of itopride hydrochloride in tablets.
itopride hydrochloride; quinalizarin; charge-transfer reaction; spectrophotometry
R927. 2
A
1007-7693(2013)10-1123-03
2013-03-04
赵杰,女,硕士,讲师 E-mail: lnyuxuan@163.com
