头孢丙烯微生物限度检查方法的验证
2013-03-06洪亮卢启寰
洪亮,卢启寰
(台州市食品药品检验所,浙江 台州 318000)
头孢丙烯微生物限度检查方法的验证
洪亮,卢启寰
(台州市食品药品检验所,浙江 台州 318000)
目的 建立头孢丙烯原料的微生物限度检查方法,并对其进行方法学验证。方法 按中国药典2010年版方法对3个批号的头孢丙烯原料进行微生物限度检查方法验证。细菌的计数方法和控制菌检查均采用低速离心-薄膜过滤-酶中和联用法;霉菌和酵母菌计数采用平皿法。结果 各试验菌的回收率均>70%,稀释液回收率也均>70%,控制菌检查具有专属性,满足中国药典2010年版验证试验的要求。结论 本品的微生物限度检查方法有效可行,可用于头孢丙烯原料的微生物限度检查。
头孢丙烯原料;微生物限度检查;方法学验证
头孢丙烯(cefprozil)是第二代头孢类抗生素,具有广谱抗菌作用,对革兰阳性需氧菌中的金黄色葡萄球菌(包括产β-内酰胺酶菌株),肺炎链球菌,化脓性链球菌作用明显,对坚忍肠球菌,大肠埃希菌,单核细胞增多性李斯特菌,表皮葡萄球菌,腐生葡萄球菌,Warnei葡萄球菌,无乳链球菌,链球菌C、D、F、G组和草绿色链球菌等具抑制作用。本品作用机制是抑制细菌细胞壁合成,使细菌迅速破裂溶解。临床广泛应用于敏感菌所致上、下呼吸道感染,皮肤和皮肤软组织感染。根据中国药典2010年版规定,在对如抗菌消炎胶囊、清胰口服液等具有抗菌活性的药物进行微生物限度检查时[1-2],应首先消除其抗菌活性,并对所用方法进行验证,以确定所采用的方法适用于该药品微生物限度检查[3]。
1 材料
1.1 仪器
万级空气净化间、百级净化台、生物安全柜(杭州金利净化工程有限公司);LDZX-50FBS型电热压力蒸汽灭菌器(上海申安医疗器械厂);恒温振荡仪(江苏金坛市金城国胜实验仪器厂);电子天平(常熟双杰测试仪器厂);DAG-9248A型电热恒温鼓风干燥箱,GNP-9270型恒温培养箱,霉菌培养箱(上海精宏实验设备有限公司);80-2型离心沉淀器(上海手术器械厂)。
1.2 菌种
大肠埃希菌[CMCC(B)44102]、金黄色葡萄球菌[CMCC(B)26003]、枯草芽孢杆菌[CMCC(B) 63501]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003],均由浙江省食品药品检验研究院提供。
1.3 培养基及试剂
营养琼脂培养基(批号:121129)、改良马丁培养基(批号:1201062)、改良马丁琼脂斜面培养基(批号:120113)、营养肉汤培养基(批号:120314)、玫瑰红钠琼脂培养基(批号:1012152)、胆盐乳糖培养基(批号:120306)、4-甲基伞形酮葡糖苷酸培养基(MUG,批号:101020),均购自北京三药科技开发公司。
pH 7.0无菌氯化钠-蛋白胨缓冲液(批号:20130121,青岛蓝雁绿检),0.9%无菌氯化钠溶液(批号:121218,安徽双鹤药业有限责任公司)。
头孢菌素酶(批号:201205011,每支200万单位,杭州北望生物技术有限公司)。
1.4 样品
头孢丙烯(浙江华方药业有限责任公司,批号:130101,130102,130103,规格:原料药)
2 方法与结果
2.1 菌液制备
接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜培养物至营养琼脂培养基中,在30~35 ℃下培养18~24 h;接种白色念珠菌的新鲜培养物至改良马丁培养基中,在23~28 ℃下培养24~48 h 后,将上述培养物用0.9%无菌氯化钠溶液制成每1 mL含菌数为50~100 cfu的菌悬液;接种黑曲霉菌的新鲜培养物至改良马丁琼脂斜面培养基中,培养5~7 d,加入3~5 mL含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱后吸出孢子悬液至无菌试管内,用含0.05% (mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液制成每1 mL含孢子数50~100 cfu的孢子悬液[4]。
2.2 供试液制备
称取样品10 g,加入pH 7.0无菌氯化钠-蛋白胨缓冲液至100 mL,放入水浴温度为45 ℃的恒温振荡仪中振荡混匀,制成1∶10的供试液。
2.3 细菌、霉菌和酵母菌计数方法的验证
样品在水中的溶解性差,并对细菌特别是金黄色葡萄球菌有较强的抑制作用,因此细菌计数可用培养基稀释法、低速离心沉淀-薄膜过滤法、低速离心沉淀-薄膜过滤-酶中和联用法分别处理,分析上述几种方法对各菌的回收结果,选择出各菌回收率在 70%以上的方法作为有效方法;霉菌和酵母菌计数可采用平皿法进行试验验证。
2.3.1 试验组 细菌计数:①培养基稀释法:取1∶10供试液1 mL,等量分注于5个平皿中,每个平皿中再分别加入试验菌1 mL(50~100 cfu·mL-1),立即倾注营养琼脂培养基15 mL。按大肠、金葡、枯草顺序平行制备,下同。②低速离心沉淀-薄膜过滤法:取1∶10供试液10 mL注入灭菌离心管中,500 r·min-1离心3 min,取出全部上清液加至含50 mL pH 7.0无菌氯化钠-蛋白胨缓冲液的灭菌滤器中进行薄膜过滤。接着用pH 7.0无菌氯化钠-蛋白胨缓冲液进行冲洗,每膜每次冲洗50 mL,振摇滤过,分别尝试用400,600,800 mL的冲洗量来进行冲洗。在最后一次冲洗中,每膜加入试验菌1 mL(50~100 cfu· mL-1),过滤。取出滤膜,菌面朝上,贴于已制备好的营养琼脂平皿里。③低速离心沉淀-薄膜过滤-酶中和联用法:前面操作同低速离心沉淀-薄膜过滤法,也分别用400,600,800 mL的冲洗量来进行冲洗,在最后一次50 mL的冲洗中,先加20 mL冲洗液,再加入头孢菌素酶50万单位,在灭菌滤器中反应10 min后,再过滤,接着每膜加入余下的30 mL冲洗液,再加入试验菌1 mL (50~100 cfu·mL-1),过滤。取出滤膜,菌面朝上,贴于已制备好的营养琼脂平皿(每个平皿含头孢菌素酶50万单位)。上述几种方法制备的营养琼脂平皿于35 ℃培养48 h后取出计数。
霉菌和酵母菌计数平皿法:每个平皿中直接加入1∶10供试液1 mL,再分别加入白色念珠菌、黑曲霉1 mL(50~100 cfu·mL-1),立即倾注玫瑰红钠琼脂培养基15 mL。每种试验菌平行制备2个平皿,置25 ℃培养3 d,取出计数。
2.3.2 菌液组 取各试验菌50~100 cfu,加相应培养基,培养,计数。测定加入的菌数,结果见表1。
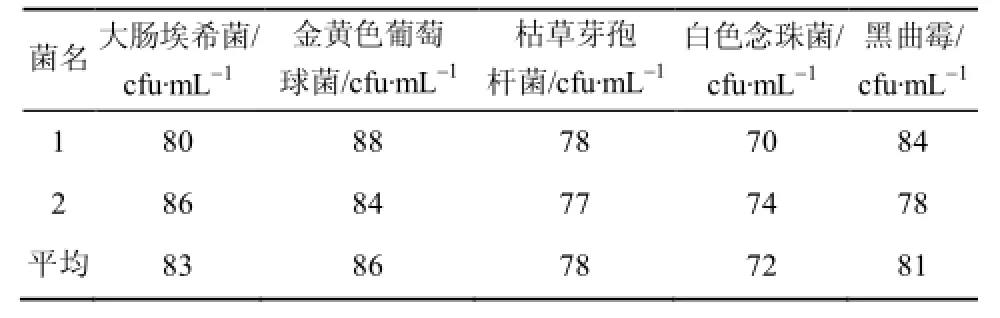
表1 菌液组计数结果Tab 1 Results of microbial group counts
2.3.3 供试品对照组 按试验组的方法处理,不加菌液,加入相应的培养基。培养,计数,测定供试品的本底菌数。
2.3.4 稀释剂对照组 用pH 7.0无菌氯化钠-蛋白胨缓冲液替代供试品,加入试验菌,使最终菌浓度为每1 mL供试液含50~100 cfu(其中“2.3.1”细菌计数:①培养基稀释法里相应的稀释剂对照组最终菌浓度为每0.2 mL供试液含50~100 cfu),按试验组菌落计数方法测定其菌数。
2.3.5 回收率计算 试验组菌回收率=(试验组平均菌落数-供试品对照组平均菌落数)/菌液组平均菌落数×100%
稀释剂对照组菌回收率=稀释剂对照组平均菌落数/菌液组平均菌落数×100%[2]
2.3.6 菌落计数法验证结果 上述各法各做3次平行试验,计算回收率,取3次平行试验稀释剂对照组和试验组的菌回收率均在70%以上的最简方法为头孢丙烯原料的菌落计数法,结果见表2。可得出细菌计数采用低速离心-薄膜过滤-酶中和联用法(400 mL冲洗量);霉菌和酵母菌计数采用平皿法。
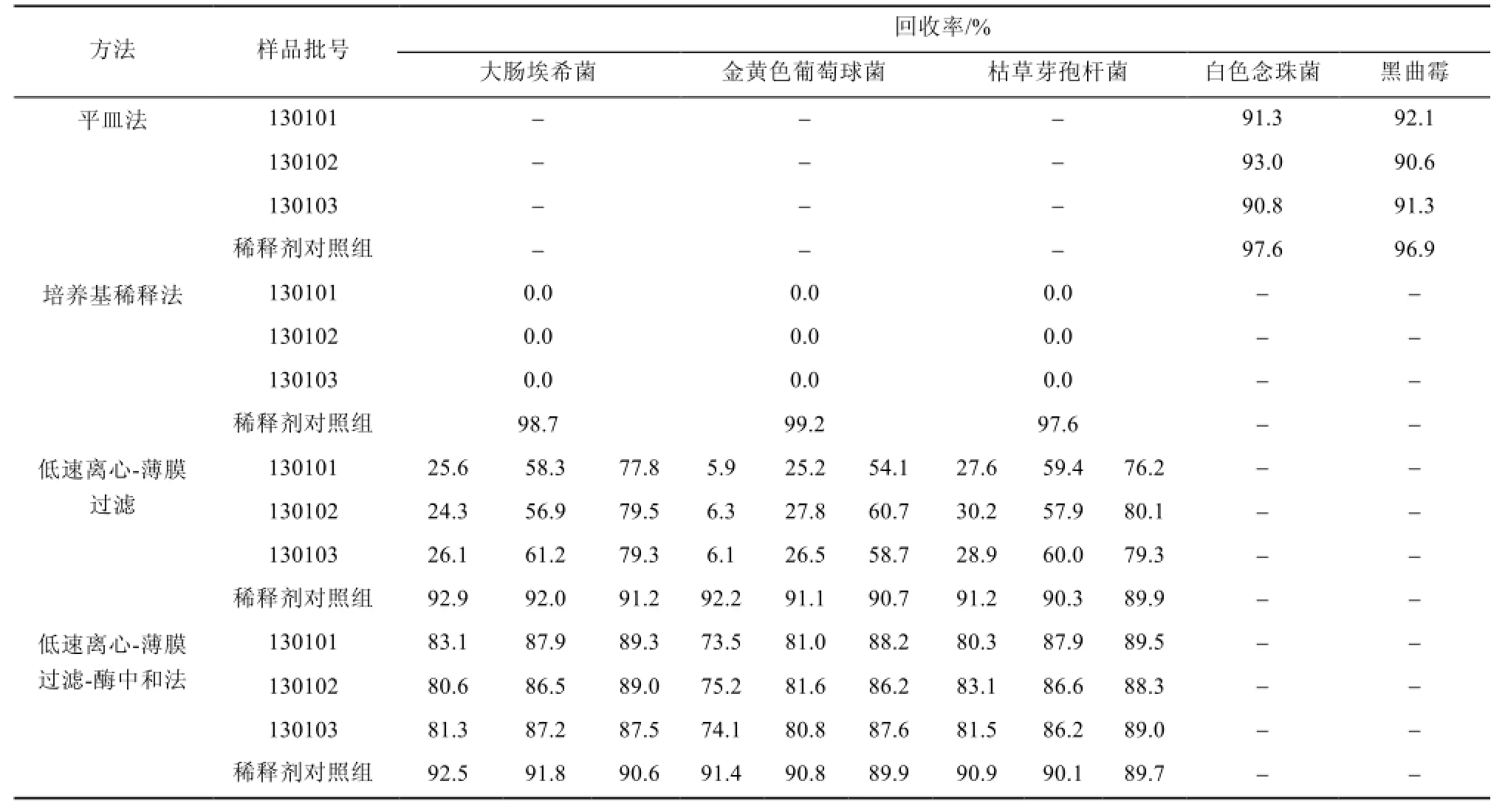
表2 5种试验菌方法学验证回收率结果Tab 2 Results of the five kinds of the recovery test
2.4 控制菌检查法的验证
2.4.1 试验组 ①培养基稀释法:取3批药品的1∶10供试液各10 mL及10~100 cfu试验菌加入灭菌锥形瓶中,再分别尝试加入300,500 mL胆盐乳糖培养基。②低速离心沉淀-薄膜过滤法:采用“2.3.1”项下细菌计数方法②制备薄膜,放入含100 mL胆盐乳糖灭菌瓶中。③低速离心沉淀-薄膜过滤-酶中和联用法:采用“2.3.1”项下细菌计数方法。④制备薄膜,放入含100 mL胆盐乳糖灭菌瓶中(含50万单位头孢菌素酶)。以上制备的薄膜置35 ℃培养18~24 h后做MUG试验及靛基质试验。
2.4.2 控制菌验证结果 从表3可以看出,在3个批号样品的平行试验中,采用低速离心沉淀-薄膜过滤-酶中和联用法为最优方法,试验组检出大肠埃希菌,可按此方法进行头孢丙烯原料的控制菌检查。
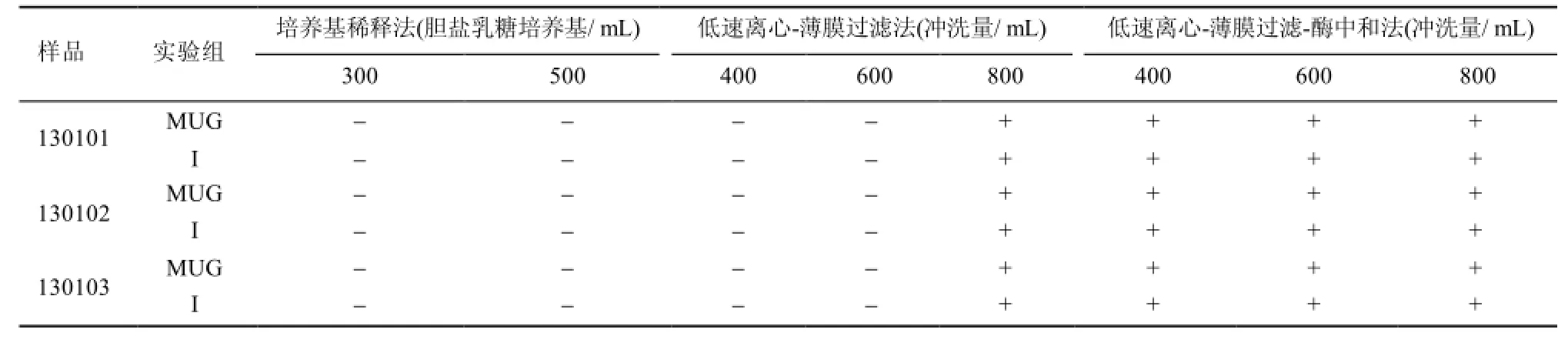
表3 大肠埃希菌方法验证试验结果Tab 3 Escherichia coli method validation test results
2.5 微生物限度检查验证结果
综合以上结果,通过5种试验菌、3次平行试验的回收率方法学验证及控制菌方法验证,头孢丙烯原料的微生物限度检查法:细菌计数及控制菌检查用低速离心-薄膜过滤-酶中和联用法(400 mL冲洗量);霉菌和酵母菌计数用平皿法。
3 讨论
头孢丙烯在水中微溶,故在制备1∶10供试液时,需45 ℃恒温振摇;同理在考虑采用薄膜过滤法时,应首先进行低速离心,去除不溶于稀释剂的药物颗粒。而有相关试验文献[5]和中国药典2010版表明,采用500 r·min-1离心3 min,对细菌的回收率影响较小。不溶性药物低速离心后,可因其质量大于细菌细胞而下沉至管底,达到既去除颗粒沉淀,又不影响试验对菌落数的检出[2]。头孢丙烯原料不溶于稀释剂的组分基本被低速离心除去,大大降低了其抑制细菌和堵塞薄膜的作用。
再者通过薄膜过滤,除去头孢丙烯一部分溶于稀释剂的抑菌组分。最后通过酶中和法,基本除去了头孢丙烯的抑菌作用。这里采用薄膜过滤-酶中和法联用是为了减少冲洗量。过大的冲洗量不仅容易导致薄膜的破损,而且易损伤药品中所含的微生物,导致假阴性的结果出现。在冲洗过程中,对冲洗液的温度应控制在40~45 ℃为宜。过低的温度容易使药物析出,堵塞或吸附在薄膜上;过高的温度容易伤害样品中的污染菌,导致假阴性。每次冲洗时,还应振摇滤器,使吸附在薄膜中的药物更容易被洗脱除去。
采用冲洗液最后一次过滤前加入部分酶,是因为头孢丙烯对普通的β-内酰胺酶有很强的耐酶作用,而专属的头孢菌素酶价格不菲,如每瓶冲洗液都加入酶进行冲洗,试验成本过高,而且酶的浓度过稀,酶解反应效率低。所以在最后一次冲洗液加50万单位头孢菌素酶反应10 min,并在培养基中加入50万单位头孢菌素酶,可保证残留在薄膜上的头孢丙烯被酶中和掉。
通过低速离心沉淀-薄膜过滤-酶中和联用法,去除了头孢丙烯原料的抑菌成分,本方法用于头孢丙烯原料的质量控制有效可行。
REFERENCES
[1] YANG J W, WANG Q H, WU Z X, et al. Methodology validation study of microbial limit examination of Qingyi oral liquid [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2012, 29(10): 939-941.
[2] HUO X, LIU B, LIU J H, et al. Establishment and validation of microbial limit method for Kangjunxiaoyan capsules [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2012, 29(12): 1121-1124.
[3] MA X R, SU D M. Drug Microbiological Inspection Technology(药品微生物学检验技术) [M]. Vol 7. Beijing: Hualing Press, 2007: 218.
[4] Ch.P(2010)Vol II(中国药典2010年版. 二部) [S]. 2010: Appendix 107-116.
[5] YUAN L N, SONG Q. Experiments on the recovery of bacteria and fungi by the method of low speed centrifuge in microbial limit tests [J]. Chin J Pharm Anal(药物分析杂志), 2007, 27(10): 1620-1622.
Establishment and Validation of Methodology for Microbial Limit Test of Cefprozil APIs
HONG Liang, LU Qihuan
(Taizhou Institute for Food and Drug Control, Taizhou 318000, China)
OBJECTIVE To establish a method for microbial limit test of cefprozil APIs, and carry out the verification of methodology. METHODS According to the method of Chinese Paharmacopoeia 2010, microbial limitexamination of three batches of cefprozil APIs were studied. Low speed centrifuge, membrane filtration and enzyme neutralization method were used with count of bacterium and pathogenic bacteria test. The plate method was used with counts mold and yeasts. RESULTS The recoveries above 70% were obtained when comparing the product challenge to its corresponding inoculum control, and no growth was observed in the negative diluent controls. The Method could pass the validation test of Chinese Pharmacopoeia 2010 version. CONCLUSION The method can be used in microbial limit test of cefprozil APIs.
cefprozil APIs; microbial limit test; validation
R916.693
B
1007-7693(2013)10-1119-04
2013-04-15
洪亮,男,主管药师 Tel: 13857660015 E-mail: letgohl@163.com
