双层包埋制备嗜酸乳杆菌微胶囊及其应用
2013-03-04段显萍
马 嫄,段显萍,刘 芸,龚 丽
(西华大学生物工程学院,四川 成都 610039)
双层包埋制备嗜酸乳杆菌微胶囊及其应用
马 嫄,段显萍,刘 芸,龚 丽
(西华大学生物工程学院,四川 成都 610039)
为确保嗜酸乳杆菌抵抗机械挤压、胃酸等不适条件,顺利到达肠道发挥益生作用,以多孔淀粉为壁材微胶囊化嗜酸乳杆菌,通过单因素试验和正交试验考察pH值、振荡时间、多孔淀粉用量、温度4个因素对嗜酸乳杆菌微胶囊化的影响。结果表明:108CFU/mL嗜酸乳杆菌悬液50mL、多孔淀粉用量5g、pH6.0、温度20℃、200r/min振荡50min的最佳工艺条件下,制得微胶囊包埋嗜酸乳杆菌包埋率为67.12%;将其饲喂幼犬后,检测犬粪便中双歧杆菌、乳酸菌、大肠杆菌、产气荚膜梭菌、pH值的变化,结果表明嗜酸乳杆菌微胶囊可有效改善犬肠道微生态。
嗜酸乳杆菌;微胶囊;多孔淀粉;包埋
嗜酸乳杆菌(Lactobacillus acidophilus,LA)属革兰氏阳性无芽孢杆菌科的乳杆菌属,是广泛存在人体和一些动物肠道内的益生菌。嗜酸乳杆菌是兼性厌氧菌,最适生长温度为35~38℃,最适pH值为5.5~6.0[1-3]。多孔淀粉(microprous starch)是指具有生淀粉酶活力的酶在低于淀粉糊化温度下作用于生淀粉颗粒后形成的一种蜂窝状多孔变性淀粉。其表面的淀粉孔可作为一个容器包埋嗜酸乳杆菌,减轻机械挤压、胃酸等对嗜酸乳杆菌的影响,使其顺利到达肠道发挥益生作用[4-7]。目前就嗜酸乳杆菌的益生效果保护技术主要有深冷冻技术和微胶囊技术,微胶囊技术多为单层包埋处理[7-15]。本实验采用双层包埋技术,以多孔淀粉为内壁材,包埋嗜酸乳杆菌,采用海藻酸钠为外壁材,经复凝聚法,通过冷冻干燥制备高活菌率的益生菌微胶囊;并通过饲喂幼龄犬仔,检测喂养一段时间后犬肠道内菌群的变化,评价嗜酸乳杆菌微胶囊对幼犬肠道菌群的调节作用。
1 材料与方法
1.1 材料与试剂
嗜酸乳杆菌由中国工业微生物菌种保藏管理中心提供。
多孔淀粉 辽宁立达生物科技有限公司;海藻酸钠、氯化钙(分析纯) 成都科龙化工试剂公司。
1.2 仪器与设备
lyolab3000冷冻干燥机 丹麦Heto公司;SHA-B数显恒温振荡器 金坛市富华仪器有限公司;SGSP-02电热恒温隔水式培养箱 黄石市恒丰医疗器械有限公司。
1.3 方法
1.3.1 菌种的活化与收集
将经活化并培养18h的菌液,在低温高速离心机(4℃,1000r/min)离心一定时间,然后用少量生理盐水冲洗沉淀,倒入灭过菌的三角烧瓶中,加好塞子在4℃冰箱中保存。根据GB 4789.2—2010《菌落总数测定》[16]的方法进行平板稀释法计数。将配置好的MRS固体培养基经高温灭菌后,在无菌操作条件下倒平板,冷却。并取1mL菌液于生理盐水中,适当稀释数倍后,取5个浓度梯度(10-6~10-10),每个梯度移取0.2mL菌液于经冷却凝固好的培养基中,(37±1)℃恒温箱培养24h后,菌落计数。再根据计数,将离心后的菌体用灭菌后的生理盐水适当稀释,调整活菌接种量至108CFU/mL,以备用。
1.3.2 嗜酸乳杆菌微胶囊的制备
在无菌操作条件下,称取一定量的多孔淀粉于烧杯中,加入108CFU/mL菌悬液50mL,用NaOH、HCl溶液调pH值,再在适温条件下振荡吸附数十分钟,至完全吸附,加入质量分数为2%的海藻酸钠溶液,搅拌均匀后挤入2%的无菌CaCl2溶液中,固化30min成膜。用3.5% CaCl2溶液浸泡10min进行硬化。过滤取得样品,用清水漂去表面的CaCl2残液,再用质量分数为0.85%的无菌生理盐水洗涤微胶囊表面菌体。在-40℃的超低温冰箱中预冻4h以上,再在冷冻干燥机中进行冻干处理24h,使其水分含量小于3%,制得微胶囊。
1.3.3 包装及保藏
将冻干后的微胶囊进行真空包装,在4℃冰箱中保藏。
1.3.4 单因素试验

表1 单因素试验因素水平表Table1 Factors and levels for one-factor-at-a-time design
1.3.5 正交试验
选择多孔淀粉用量、温度、pH值、振荡时间4个因素设置3个水平,安排L9(34)正交试验。
1.3.6 微胶囊包埋率的测定
取冷冻干燥后的样品0.1g于10mL磷酸缓冲液中破壁,从中吸取1mL稀释浓度梯度,然后涂布平板,(37±1)℃恒温厌氧培养24h,活菌计数依据GB 4789.35—2010《食品微生物学检验:乳酸菌检验》标准进行。取适量检样(微胶囊),用生理盐水进行适当倍数稀释后选择2~3个试样,各取1mL在无菌环境下注入MRS固体培养基中。

式中:T为样品内的活菌接种量/(CFU/mL);W为包埋原液中的活菌接种量/(CFU/mL)。
1.3.7 饲喂实验
选取身体状况良好的幼犬13只,每天对其定量饲喂3次所制得的嗜酸乳杆菌微胶囊,收集其粪便,并分别检测双歧杆菌、乳酸菌、大肠杆菌、产气荚膜梭菌的数量变化。
1.3.8 益生作用效果评价[17-22]
将每批次的样品按序号取出,记录名称,然后准确称取样品5.00g,分别转移至盛有45mL生理盐水、45mL蛋白胨水的锥形瓶中,振摇2min,静置,备用。
分别采用GB/T 4789.3—2003《食品卫生微生物学检验:大肠菌群测定》检测大肠杆菌,GB/T 4789.34—2008《食品卫生微生物学检验:双歧杆菌检验》检测双歧乳杆菌,SN/T 1941.1—2007《进出口食品中乳酸菌检验方法》检测乳酸菌,GB/T 4789.13—2003《食品卫生微生物学检验:产气荚膜梭菌检验》检测产气荚膜杆菌。
2 结果与分析
2.1 单因素试验
2.1.1 多孔淀粉用量对微胶囊化的影响由表2可知,在pH值、包埋温度及振荡时间不变的条件下,当多孔淀粉用量在4g时,微胶囊的包埋效果最好。此时理论上微胶囊的粒径分布范围较窄,呈球性较好。多孔淀粉颗粒的孔洞对嗜酸乳杆菌有一定的容纳数量(即饱和度),当达到该饱和度时,多孔淀粉添加量的增加不会引起包埋率的增加。且多孔淀粉添加量的增加(>

表2 多孔淀粉用量对微胶囊化的影响Table2 Effect of porous starch mass on embedment efficiency
4g)会造成微胶囊的团聚,难以分离、收集。因此,选择多孔淀粉添加量为4g为宜。
2.1.2 温度对微胶囊化的影响

表3 温度对微胶囊化的影响Table3 Effect of temperature on embedment efficiencyTab
由表3可知,在其他参数不变的条件下,随着包埋温度的升高,包埋率随之降低,在温度为20℃时包埋效率为最高。
2.1.3 振荡时间对微胶囊化的影响

表4 振荡时间对微胶囊化的影响Table4 Effect of oscillation time on embedment efficiency
由表4可知,微胶囊包埋率随着振荡时间的延长而升高。当振荡时间在50min时,多孔淀粉就能充分包埋菌种,包埋效率最好。在整个试验过程中,由于溶液中的菌体先到达多孔淀粉颗粒周围,再通过吸附力进入颗粒内部的孔洞中,振荡时间逐渐延长时增大了颗粒与菌体充分接触的几率,从而包埋率逐渐提高。振荡时间大于50min后多孔淀粉慢慢开始崩解,故以振荡时间50min为好。
2.1.4 pH值对微胶囊化的影响

表5 pH值对微胶囊化的影响Table5 Effect of pH on embedment efficiency
由表5可知,微胶囊的包埋率随着pH值的变化而变化。由于多孔淀粉对pH值较稳定,嗜酸乳杆菌在pH5.5~6.0范围内也能保持较好的活性,所以当pH值为6.0时,包埋效率较高,粒径分布范围较窄,利于收集;而在pH值小于6.0时,由于包埋条件不佳,微胶囊的粒径大且呈球性不好,不利于收集;当pH值大于6.0时,微胶囊包埋率下降。
2.2 正交试验
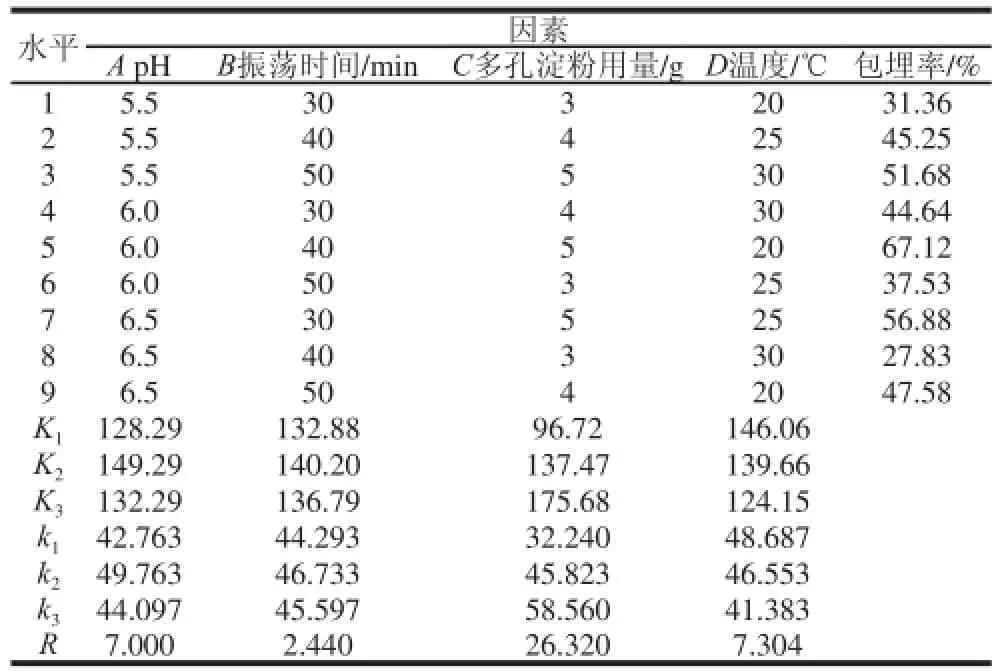
表6 L6 L9(3(34)正交试验设计及结果Table6 Orthogonal array design matrix and results
由表6可知,各因素影响微胶囊化的主次顺序为多孔淀粉用量>包埋温度>振荡时间>pH值。包埋过程中,溶液中的嗜酸乳杆菌菌体先到达多孔淀粉颗粒周围,再通过吸附力进入颗粒内部的孔洞中,当振荡转速过大或过小时会降低颗粒与菌体接触的几率,从而影响包埋率;而多孔淀粉对pH值较稳定,嗜酸乳杆菌在pH5.5~6.0范围内也能保持较好的活性,包埋过程受溶液pH值的影响较小。
根据正交试验结果可知,嗜酸乳杆菌微胶囊化的最佳工艺条件为A2B2C3D1,即多孔淀粉用量5g、振荡时间50min、包埋pH6.0、包埋温度20℃,按此工艺条件进行验证实验测得包埋率为67.12%。
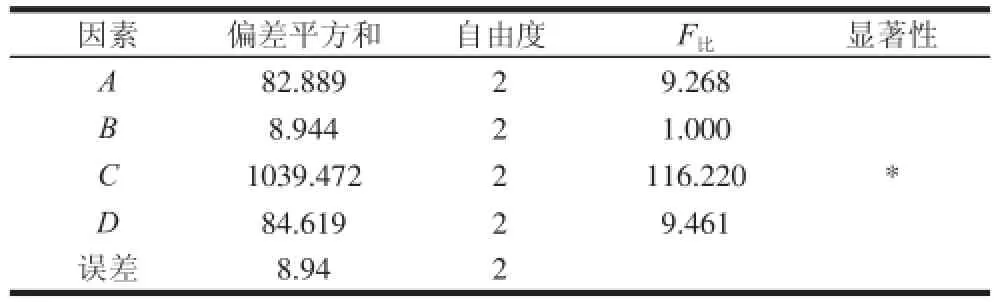
表7 正交试验方差分析表Table7 Analysis of variance for the experimental results of orthogonal array design
方差分析进一步表明在影响微胶囊化包埋率的因素中,多孔淀粉用量为显著性因素,pH值、振荡时间、包埋温度对微胶囊化有一定的影响。
2.3 益生作用效果评价
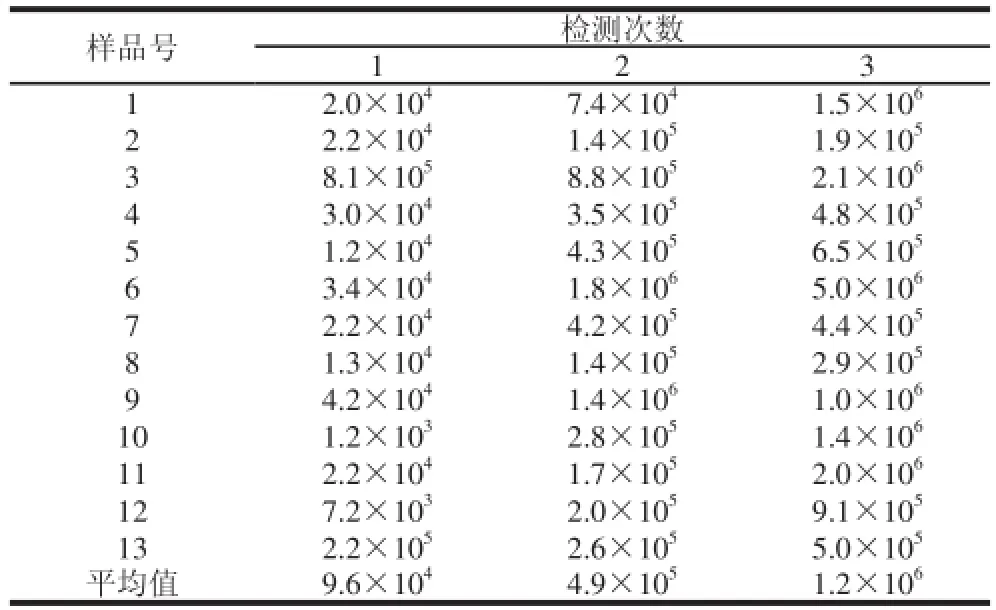
表8 犬粪便中双歧杆菌的测定结果Table8 Effect of ingestion of Lactobacillus acidophilus microcapsules on Bififi dobacterium population in dog feces个/g
由表8可知,随着饲喂量的增加,犬粪便中的双歧杆菌检出量也不断增加,很快上升了两个数量级。嗜酸乳杆菌是肠道中的主要益生菌和双歧杆菌是互生关系,由于喂养了嗜酸乳杆菌微胶囊,实验犬肠道中的嗜酸乳杆菌数量比例得到了提升,其分泌的抗生物类物质抑制了致病菌的生长,为双歧杆菌的生长提供了有利条件,使双歧杆菌数量上升,共同调节肠道菌群平衡。
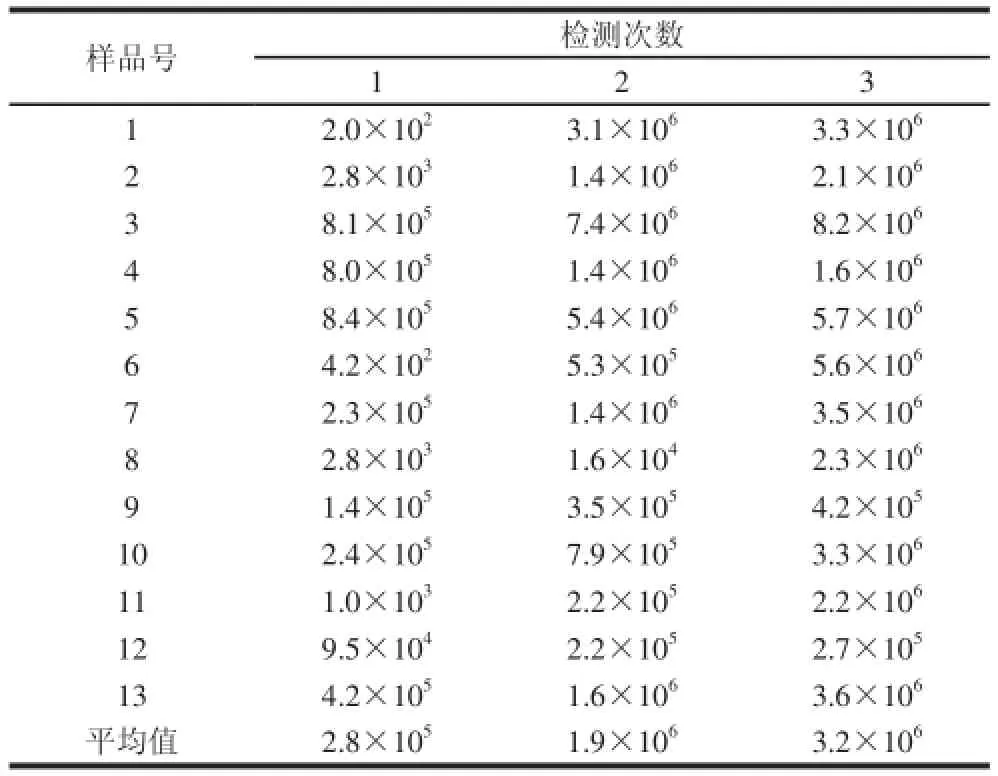
表9 犬粪便中乳酸菌的测定结果Table9 Effect of ingestion of Lactobacillus acidophilus microcapsules on Lactobacillus population in dog feces个/g
由表9可知,随着饲喂量的增加,试验犬粪便中乳酸菌的数量迅速上升,在后期虽有一定的平缓下降,但仍处于同一个数量级,属于正常的波动情况。嗜酸乳杆菌属于乳酸菌的一个属,与其他的很多乳酸菌均存在互生关系,它们在肠道内共同发酵,能更好地抑制有害菌的生长,有利于益生菌在胃肠道占据优势(80%以上),维持机体处于健康状态。

表10 犬粪便中大肠杆菌的测定结果Table10 Effect of ingestion of Lactobacillus acidophilus microcapsulleess oonn Escherichia coollii population in dog feceess个/100g
由表10可知,随着饲喂量的增加,实验犬粪便中的大肠杆菌数量急剧下降,降低到40个/100g左右时,呈缓慢下降趋势,变化不大,这是由于嗜酸乳杆菌能分泌抗生物素类物质(嗜酸乳菌素、嗜酸杆菌素、乳酸菌素), 对肠道致病菌产生拮抗作用。大肠杆菌肠道致病菌,具有毒力因子(如内毒素、荚膜、黏附素、外毒素等),在一些特殊条件下,会危害身体健康。大肠杆菌在肠道中比例的下降,标志着饲喂狗的嗜酸乳杆菌微胶囊进入肠道后成功定植于其胃肠道并对肠道菌群起到了很好的调节效果。

表11 犬粪便中产气荚膜梭菌的测定结果Table11 Effect of ingestion of Lactobacillus acidophilus microcapsules on Clostridium perfringens population in dog feces个/g
由表11可知,随着饲喂量的增加,狗粪便中产气荚膜杆菌的数量快速下降。产气荚膜杆菌是寄居在温血动物消化道内,能引起多种致病。由于嗜酸乳杆菌等其他的胃肠道益生菌对其拮抗作用的结果,产气荚膜杆菌在肠道中比例的下降,标志着饲喂狗的嗜酸乳杆菌微胶囊进入肠道后成功定植于其胃肠道并对肠道菌群起到了很好的调节效果。

表12 犬粪便中pH值的测定结果Table12 Effect of ingestion of Lactobacillus acidophilus microcapsules on fecal pH of dogs
由表12可知,随着饲喂量的增加,犬粪便的pH值几乎没有改变,说明实验犬的身体状况很稳定,没有产生很大的波动变化。嗜酸乳杆菌微胶囊对肠道菌群的平衡调节效果很好,抵抗了一些致病菌导致机体代谢的紊乱,pH值变化幅度大的不稳定情况。
3 结 论
在pH6.0、多孔淀粉添加量5g、温度20℃、振速200r/min振荡50min条件下制备的嗜酸乳杆菌微胶囊的包埋率为67.12%;经喂养幼犬后,实验犬肠道的大肠杆菌、产气荚膜杆菌数量得到很好的控制,双歧杆菌、乳酸菌等肠道益生菌菌群占据优势,帮助机体提高免疫力、消化吸收功能等,维持机体生理状况的稳定平衡。
[1] 赵瑞香. 嗜酸乳杆菌及其应用研究[M]. 北京: 科学出版社, 2007.
[2] 刘齐, 卢娜. 嗜酸乳杆菌的研究现状与趋势[J]. 科技创业月刊, 2009(12): 79-80.
[3] LI Xiaoyan, CHEN Xiguang, SUN Zhongwu, et al. Preparation of alginate/chitosan/carboxymethyl chitosan complex microcapsules and application in Lactobacillus casei ATCC 393[J]. Carbohydrate Polymers, 2011, 83(4): 1479-1485.
[4] 张兆俊. 微孔淀粉包埋乳酸菌功能性研究[D]. 重庆: 西南大学, 2006.
[5] 庄海宁, 金征宇. 微孔淀粉在食品微胶囊化中的应用[J]. 食品与机械, 2007(2): 129-130.
[6] 姚卫蓉, 姚惠源. 多孔淀粉包埋益生菌的工艺研究[J]. 广州食品工业科技, 2004(B11): 31-33.
[7] 王学佩, 刘霞, 王金玲. 多孔淀粉在乳酸菌微胶囊制剂上的开发与利用[C]//中国畜牧兽医学会动物微生态学分会第四届第九次学术研讨会论文集. 北京: 国家食品药品监督管理局, 2008: 70-78.
[8] 孙欣. 吸附与包埋技术固定化乳酸菌及其性质研究[D]. 青岛: 中国海洋大学, 2007.
[9] 冯琼, 李保国, 黄志强, 等. 微胶囊技术在益生菌中的应用[J]. 食品科技, 2007(10): 230-235.
[10] REN Zhihua, PAN Cuiling, JIANG Luyan, et al. Oxalate-degrading capacities of lactic acid bacteria in canine feces[J]. Veterinary Microbiology, 2011, 152(3/4): 368-373.
[11] 郭佳, 陈琳, 张柏林. 膳食纤维微胶囊化包埋益生菌的研究[J]. 乳业科学与技术, 2008, 31(5): 201-206.
[12] 韩迪. 影响益生菌存活率因素的研究[D]. 西安: 陕西科技大学, 2007.
[13] SEMYONOV D, RAMON O, KAPLUN Z, et al. Microencapsulation of Lactobacillus paracasei by spray freeze drying[J]. Food Research International, 2010, 143: 193-202.
[14] MINNA R, KATRI J, ELIAS W, et al. Interaction between probiotic lactic acid bacteria and canine enteric pathogens: a risk factor for intestinal Enterococcus faecium colonization?[J]. Veterinary Microbiology, 2003, 92(1/2): 111-119.
[15] 王菡, 代海兵, 桂艺方. 嗜酸乳杆菌冻干菌粉制备[J]. 牡丹江医学院学报, 2012, 33(1): 16-18.
[16] 国家加工食品质量监督检验中心(广州). GB/T 4789.35—2010食品卫生微生物学检验标准[S]. 北京: 中国标准出版社, 2010.
[17] 聂实践. 饲用微生态制剂调节动物肠道菌群研究及应用[C]//中国畜牧兽医学会小动物医学分会成立大会暨学术报告会. 北京: 中国畜牧兽医学会, 2005: 174.
[18] 段永兰. 益生菌与动物饲料[J]. 郑州牧业工程高等专科学校学报, 2007(2): 31-32.
[19] 孙鸣, 潘宝海, 陈伟兴, 等. 益生菌、益生元及合生素的作用机制和相互关系[J]. 饲料研究, 2008(4): 62-64.
[20] 马嫄, 王德纯, 李庆, 等. 益生菌在宠物食品中的应用[J]. 西华大学学报: 自然科学版, 2011, 30(1): 103-106.
[21] 曾子丹, 姚朔影. 益生菌的研究前景及国内外发展状况[J]. 食品工业科技, 2007, 28(8): 251-254.
[22] 霍军, 宋予震, 胡青妞. 犬用微生态制剂对幼犬生长影响的研究[J].郑州牧业工程高等专科学校学报, 2008, 28(2): 5-7.
Preparation by Double-Layer Embedment and Application of Lactobacillus acidophilus Microcapsules
MA Yuan,DUAN Xian-ping,LIU Yun,GONG Li
(School of Bioengineering, Xihua University, Chengdu 610039, China)
Lactobacillus acidophilus microcapsules were prepared by means of double-layer embedment using porous starch as wall material to overcome unfavorable conditions such as mechanical compression and gastric acid and promote the probiotic effect of Lactobacillus acidophilus in the gut. Operating parameters such as pH, oscillation time, porous starch dosage and temperature were optimized by one-factor-at-a-time method and orthogonal array design. The embedment efficiency of Lactobacillus acidophilus microcapsules was 67.12% under the optimized conditions of5 g of porous starch, pH 6.0 and oscillation at 200 r/min for 50 min. Ingestion of Lactobacillus acidophilus microcapsules could effectively improve the intestinal microflora as demonstrated by its effect on Bifidobacterium, Lactobacillus, Escherichia coli, Clostridium perfringens and pH in the feces of young dogs.
Lactobacillus acidophilus;microencapsulation;porous starch;embedment
TS20
A
1002-6630(2013)04-0099-05
2012-07-31
教育部“春晖计划”项目(Z2010104);食品生物技术四川省重点实验室项目(SZJJ2011-004);四川省教育厅重点项目(12ZA157);食品科学四川省重点学科建设项目(SZD0803-09-1)
马嫄(1978—),女,副教授,硕士,研究方向为食品生物技术。E-mail:summerpony@yahoo.cn
