外源性八肽胆囊收缩素对吗啡所致SH-SY5Y和PC12细胞毒的保护作用
2013-03-03孟雁欣杨胜昌马春玲
李 冬,孟雁欣,杨胜昌,文 迪,丛 斌,马春玲
(河北医科大学基础医学院法医学系,河北省法医学重点实验室,河北石家庄050017)
外源性八肽胆囊收缩素对吗啡所致SH-SY5Y和PC12细胞毒的保护作用
李 冬,孟雁欣,杨胜昌,文 迪,丛 斌,马春玲*
(河北医科大学基础医学院法医学系,河北省法医学重点实验室,河北石家庄050017)
目的观察外源性八肽胆囊收缩素(cholecystokinin octapeptide,CCK-8)对吗啡处理SH-SY5Y及PC12细胞毒性作用的影响。方法应用二甲基噻唑二苯基四噻唑盐[3-(4,5)-dimethylthiazo(-2-yl)-3,5-diphenytetrazoliumromide,MTT]法观察吗啡对SH-SY5Y及PC12细胞毒性作用的剂量和时间依赖关系,并且观测外源性CCK-8对吗啡细胞毒性作用的影响。结果①吗啡在100~10 000μmol/L浓度范围内显著降低SH-SY5Y和PC12细胞的生存率,半数抑制率分别为2 520μmol/L和680μmol/L;上述作用在孵育48h明显,随时间延长逐渐增强;CCK-8(10-6和10-8mol/L)可明显抑制3 000μmol/L吗啡作用48h后SH-SY5Y细胞生存率的下降,CCK-8(10-6、10-8和10-10mol/L)可明显抑制1 000μmol/L吗啡作用48h后PC12细胞生存率的下降;②3 000μmol/L和1 000μmol/L吗啡分别处理SH-SY5Y细胞和PC12细胞48h后,可见细胞胞体变圆,突触变短或消失,失去原有的细胞形态。CCK-8(10-6和10-8mol/L)可明显改善吗啡作用后SH-SY5Y和PC12细胞的形态改变。结论外源性CCK-8可浓度依赖地对抗吗啡产生的细胞毒性作用。
受体,胆囊收缩素;吗啡;法医毒理学
吗啡成瘾被认为是一种慢性复发性脑病,长期研究[1]表明其与吗啡导致的神经元毒性密切相关。吗啡的神经毒性及其机制的研究日渐引起广泛关注,有研究[2]表明吗啡可抑制细胞增殖,诱导神经元凋亡,并且在体模型也显示吗啡可导致不同脑区神经元出现相应的病理学改变。长期应用阿片类物质可引起体内抗阿片物质的释放来维持体内的平衡状态,八肽胆囊收缩素(cholecystokinin octapeptide,CCK-8)作为目前已知最强的内源性抗阿片肽,已被证实在吗啡镇痛耐受和成瘾过程中具有重要的拮抗作用[3]。本室以往研究也显示CCK-8在吗啡依赖和戒断中发挥了重要的作用[4]。本课题在体外培养SH-SY5Y和PC12细胞的基础上,采用二甲基噻唑二苯基四噻唑盐[3-(4,5)-dimethy lthiazo(-2-yl)-3,5-di-phenytetrazoliumromide,MTT]法观察了吗啡细胞毒性及不同浓度CCK-8对其的影响,为探讨吗啡的神经毒性和CCK-8的神经保护作用提供细胞学证据。
1 材料与方法
1.1 材料与仪器:PC12细胞系(上海细胞生物学研究所细胞库),SH-SY5Y细胞系(上海拜力生物科技有限公司);DMEM F12及RPMI培养基(美国Gibco公司),胎牛血清(英国PAA公司);盐酸吗啡注射液(沈阳第一制药厂),CCK-8(美国Sigma公司),MTT(美国Sigma公司);酶标仪(美国Molecular Devices公司),细胞自动计数仪(美国Invitrogen公司),Olympus光学显微镜。
1.2 SH-SY5Y以及PC12细胞的培养:SH-SY5Y细胞接种于含有10%的胎牛血清、100U/mL青、链霉素的DMEM F12培养基中,PC12细胞接种于含有10%的胎牛血清、100U/mL青、链霉素的RPMI培养基中,37℃下持续通入5%CO2和95%空气培养。
SH-SY5Y和PC12细胞均呈贴壁生长状态,50mL培养瓶底贴壁密度达70%~80%时,取对数生长期的细胞,以1×105/mL密度接种于96孔板,100μL/孔。过夜孵育培养使细胞进入G0期后给予药物干预。
1.3 MTT法检测细胞生存率:MTT比色法,是一种检测细胞存活和生长的方法。其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为不溶于水的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。分别于各组作用结束前4h加入10μL/孔MTT,4h后再加入150μL/孔,10%SDS终止反应,孵育过夜,待颗粒溶解后以酶标仪(570nm)测定各孔光密度值(optical density,OD)。细胞生存率=检测组OD/对照组OD×100%。
1.4 实验设计
1.4.1 不同浓度吗啡对细胞生存率影响:吗啡工作液依次10倍比稀释为0.1~10 000μmol/L,作用48h,每个浓度设立6个副孔。计算其半数抑制率(halfmaximal inhibitory concentration,IC50)值,观测吗啡作用的浓度依赖性,以筛选吗啡作用浓度。
1.4.2 吗啡作用不同时间对细胞生存率的影响:根据筛选得到的吗啡浓度,分别作用不同时间点,3、6、12、24、48、96h,观测吗啡作用的时间依赖性。
1.4.3 CCK-8对吗啡作用的影响:CCK-8依次100倍稀释为10-6~10-12mol/L,作用48h,观察单独CCK-8对SH-SY5Y细胞和PC12细胞生存率的影响。并且在吗啡作用前15min加入不同浓度的CCK-8,以观测CCK-8对吗啡处理2种细胞生存率的影响。
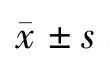
2 结果
2.1 不同浓度吗啡对SH-SY5Y及PC12细胞生存率的影响:吗啡作用于SH-SY5Y和PC12细胞48h,细胞生存率随浓度增加而逐渐下降,显示出明显的浓度依赖性。对于SH-SY5Y细胞,0.1~100μmol/L吗啡对细胞生存率无明显影响(P>0.05),1 000μmol/L吗啡作用48h后细胞生存率降低了24.8%,而10 000μmol/L作用细胞48h后,细胞生存率仅为2.2%,与对照组相比差异有统计学意义(P<0.01)。对于PC12细胞,0.1~10μmol/L吗啡对细胞生存率无明显影响(P>0.05),100~
1 000μmol/L吗啡可浓度依赖地抑制PC12细胞的生存率,与对照组相比均明显下降(P<0.01)(图1)。同时我们通过计算求得吗啡对SH-SY5Y及PC12的IC50分别为2 520μmol/L和680μmol/L,因此我们筛选吗啡浓度分别为3 000μmol/L及1 000μmol/L对SH-SY5Y及PC12细胞进行下一步的实验。
2.2 吗啡作用不同时间对SH-SY5Y及PC12细胞生存率的影响:3 000μmol/L及1 000μmol/L吗啡分别作用于SH-SY5Y及PC12细胞3、6、12、24、48、96h。随着吗啡作用时间的增加,2种细胞的生存率逐渐下降,与对照组相比差异有统计学意义(P<0.01),显示出明显的时间依赖性。见表2。
2.3 CCK-8对吗啡作用SH-SY5Y及PC12细胞的影响:单独10-6、10-8、10-10以及10-12mol/L CCK-8分别作用于SH-SY5Y和PC12细胞48h,细胞生存率与对照组相比差异无统计学意义(P>0.05)。对于SH-SY5Y细胞,10-6和10-8mol/L的CCK-8可明显升高3 000μmol/L吗啡处理SH-SY5Y细胞48h后的细胞生存率(P<0.01),而10-10以及10-12mol/L的CCK-8无明显作用(P>0.05)。对于PC12细胞,10-6、10-8和10-10mol/L的CCK-8可明显升高1 000μmol/L吗啡作用48h的细胞生存率(P<0.01),而10-12mol/L的CCK-8则无明显影响(P>0.05)。见图3,4。
2.4 吗啡对SH-SY5Y及PC12细胞形态的影响及CCK-8对其的改善作用:3 000μmol/L和1 000μmol/L吗啡分别处理SH-SY5Y细胞和PC12细胞48h后,可见细胞胞体变圆,突触变短或消失,失去原有的细胞形态。CCK-8(10-6和10-8mol/L)可明显改善吗啡作用后细胞的形态改变,可见细胞胞体长梭形,存在细长突触,呈现了较为正常的细胞形态(与对照组相比),10-10和10-12mol/L的CCK-8则无明显作用。见图5。
3 讨论
自从吗啡被提取纯化之后,强大、长效的镇痛作用使其被广泛应用于临床,然而吗啡的神经毒性近几十年才被关注。虽然对吗啡镇痛作用及其机制有被深入研究,但对其神经毒性的探讨仍留有很多难点、疑点。吗啡滥用引发的社会、健康问题日益凸显,吗啡的神经毒性在其成瘾机制中发挥了什么作用?对神经细胞的影响究竟基于怎样的分子通路?都有待于我们进一步研究。本室以往研究发现CCK-8可减缓吗啡依赖并减轻吗啡戒断症状[4]。CCK-8属于小分子肽类物质,参与调节中枢神经、内分泌、免疫等多系统机能活动,CCK-8通过与其受体结合发挥拮抗吗啡的作用。目前,CCK-8的神经保护作用机制尚不明确,其对吗啡神经毒性的作用尚未见报道。
SH-SY5Y和PC12细胞株分别来源于人神经母细胞瘤和大鼠肾上腺髓质嗜铬细胞瘤,在细胞形态、生理、生化等功能上与正常的神经细胞相似,是神经细胞研究比较理想的细胞模型[5]。研究[6]发现,由于个体耐受性不同吗啡致死量存在较大差别,吗啡成瘾者对吗啡有极强的耐受性,可耐受正常量的35~40倍,约70μmol/L,而不发生中毒,根据本次研究的结果,吗啡成瘾者体内的吗啡浓度对神经细胞的生存率已产生影响,达到细胞毒水平。本研究发现:①3 000μmol/L吗啡作用于SH-SY5Y细胞48h后可导致其细胞形态发生明显改变,表现为细胞胞体变圆,突触变短或消失。MTT结果也显示,吗啡可浓度和时间依赖地抑制SH-SY5Y细胞的生存率,与以往文献报道一致。SH-SY5Y细胞主要表达μ阿片受体。以往研究对吗啡导致SH-SY5Y细胞的增殖抑制和凋亡的机制研究较为明确,μ阿片受体在细胞介导信号转导、ROS产生、caspase级联反应中起重要作用。吗啡可能通过作用于SH-SY5Y细胞表面的μ阿片体诱导细胞内ROS的产生[7],通过氧化还原修饰影响细胞信号传导系统进而诱导细胞的凋亡。②1mmol/L吗啡作用于PC12细胞48h后可导致其细胞形态出现类似于SH-SY5Y细胞的改变。MTT结果也同样显示,吗啡可浓度和时间依赖的抑制PC12细胞的生存率。PC12细胞表面主要表达κ受体。以往也有研究报道吗啡可与κ受体结合,通过调节细胞外调节蛋白激酶和C-Jun氨基末端激酶信号通路而影响细胞的活性[8-9]。
然而吗啡对SH-SY5Y细胞和PC12细胞IC50的不同提示受体类型与吗啡对细胞的活性影响的差异可能存在一定的相关性。已知吗啡对μ阿片受体的亲和力远高于κ受体,而本研究得到的结果却显示PC12细胞对吗啡细胞毒性表现出较SH-SY5Y细胞更高的敏感性,我们推测存在除受体以外多种因素共同参与了吗啡的神经毒性作用。
本室以往研究发现,外源性CCK-8可减缓吗啡依赖并减轻吗啡戒断症状[4]。近期研究发现CCK-8可浓度依赖的抑制谷氨酸引起的细胞损伤或死
亡[10]。选择性CCK2受体拮抗剂L-365,260可以完全阻断CCK-8类似物蓝肽保护作用,提示CCK2受体可能介导了CCK-8对抗谷氨酸的毒性作用。也有研究[11]显示CCK-8、CCK-8类似物蓝肽、CCK-8NS可以通过作用于CCK2受体抑制N-甲基-D-天冬氨酸(N-methyl-D-asportic acid,NMDA)受体介导的谷氨酸对大鼠大脑皮层神经元的毒性作用;CCK-8在体内及体外均能明显改善谷氨酸所致的神经元病理损害;谷氨酸激活NMDA受体后促进Ca2+内流,Ca2+与钙调素结合激活一氧化氮合酶,进而生成大量一氧化氮引起细胞损伤[12]。对培养的神经细胞的研究[13]发现,胆囊收缩素对NMDA受体激活引起的Ca2+内流无影响,但可通过胞内某种信号转导系统抑制Ca2+与钙调素的结合而减少一氧化氮合成,发挥拮抗谷氨酸的神经毒性作用。
本研究发现CCK-8可浓度依赖地抑制吗啡诱导的SH-SY5Y细胞和PC12细胞生存率的下降,改善细胞形态。虽然吗啡神经毒性的细胞机制尚未完全明确,但其最终都是通过细胞内信号转导途径诱导细胞的增殖抑制或凋亡。研究[14]发现,吗啡可通过对核因子-κB的直接抑制以及降低肿瘤坏死因子-α的表达和释放,在体外诱导许多癌细胞系的凋亡。CCK-8可通过激活腺苷-3',5-环化-磷酸-蛋白激酶A通路,抑制蛋白激酶通路进而抑制大鼠肺组织及大鼠肺间质巨噬细胞内核因子-κB的活性[15],或通过其他途径抑制蛋白激酶C而降低核因子-κB的活性[16]。目前CCK-8发挥神经保护的作用机制仍不明确,对于CCK-8是通过影响吗啡诱导的细胞增殖抑制还是细胞凋亡进而发挥其神经保护作用,仍有待我们进一步探索。(本文图见封二)
[1] MAO J,SUNG B,JIRR,etal.Neuronal apoptosis associated with morphine lerance:evidence for opioid-induced neurotoxic mechanism[J].JNeurosci,2002,22(17):7650-7661.
[2] OZMEN I,NAZIROGLU M,ALICI HA,et al.Spinal morpine administration reduces the faty acid contents in spinal cord and brain by increasing oxidative stress[J].Neurochem Res,2007,32(1):19-25.
[3] FARISPL,KOMISARUK BR,WATKINS LR,et al.Evidence for the neuropeptide cholecystokinin as an antagonist of opiate analgesia[J].Science,1983,219(4582):310-312.
[4] 文迪,马春玲,丛斌,等.CCK-8与内源性阿片系统在吗啡依赖中的相互作用[J].中国药理学通报,2010,26(11):1445-1450.
[5] PEREZ-CASTRO R,PATEL S,GARAVITO-AGUILAR ZV,et al.Cytotoxicity of local anesthetics in human neuronal cells[J].Anesth Analg,2009,108(13):997-1007.
[6] 刘良,张国华.法医毒理学[M].北京:人民卫生出版社,2010:110-111.
[7] LU L,SUWJ,YUEW,etal.Attenuation ofmorphine dependence and withdrawal in rats by venlafaxine,a serotonin and noradrenaline reuptake inhibitor[J].Life Sci,2001,69(1):37-46.
[8] GLASEL JA,AGARWAL D.Theoretical analysis of a morphine withdrawal phenotype in a cultured cell line[J].Life Sci,1997,61(21):305-313.
[9] AGARWAL D,GLASEL JA.Differential effects of opioid and adrenergic agonists on proliferation in a cultured cell line[J].Cell Prolif,1999,32(4):215-229.
[10] KATSUURA G,SHINOHARA S,SHINTAKU H,et al.Protective effect of CCK-8 and ceruletide on glutamate-induced neuronal cell death in rat neuron cultures:possible involvement of CCK-B receptors[J].Neurosci Lett,1991,132(2):159-162.
[11] AKAIKE A,TAMURA Y,SATO Y,et al.Cholecystokinininduced protection of cultured cortical neurons against glutamate neurotoxicity[J].Brain Research,1991,557(1/2):301-307.
[12] 梁英武,张国荣,单魏松,等.胆囊收缩素八肽拮抗谷氨酸神经毒性作用的病例研究[J].中国神经精神疾病杂志,1997,23(4):210-212.
[13] TAMURA Y,SATO Y,AKAIKE A,et al.Mechanisms of cholecystokinin-induced protection of cultured cortical neurons against N-methyl-D-aspartate receptor-mediated glutamate cytotoxicity[J].Brain Res,1992,592(1/2):317-325.
[14] SUEOKA N,SUEOKA E,OKABE S,et al.Anti-cancer effects of morphine through inhibition of tumor necrosis factor-alpha release and mRNA expression[J].Carcinogenesis,1996,17(11):2337-2341.
[15] GAOWJ,XU SJ,CONG B,et al.Activation of cAMP-PKA signal pathway by CCK-8 in rat pulmonary interstitialmacrophages[J].Chin Pharmacol Bull,2007,23(3):321-326.
[16] LI SJ,YAO YX,ZHU GJ,et al.Cholecystokinin octapeptide inhibits tumor necrosis factor-αtranscription and nuclear factorκB activity induced by lipopolysaccharide in rat pulmonary interstitialmacrophages[J].Chin J Pathophys,2004,20(8):635-638.
(本文编辑:刘斯静)
CCK-8 PROTECTSMORPHINE-INDUCED CYTOTOXICITY IN SH-SY5Y AND PC12 CELLS
LIDong,MENG Yanxin,YANG Shengchang,WEN Di,CONG Bin,MA Chunling*Department of Forensic Medicine,the School of Basic Medical Sciences,Hebei Medical University;
Hebei Key Laboratory of Forensic Medicine,Shijiazhuang 050017,China)
Objective To explore the effect of exogenous cholecystokinin octapeptide(CCK-8)on morphine-induced cytotoxicity.M ethods 3-(4,5)-dimethy lthiazo(-2-yl)-3,5-diphenytetrazoliumromide(MTT)assay was used to assess the dose-and time-dependent response of morphine-induced cytotoxicity in SH-SY5Y and PC12 cells,also the effectof CCK-8 onmorphine-induced cytotoxicity was observed.Results ①The concentration of morphine was from 100μmol/L to 10 000μmol/L which reduced the survival rate of SH-SY5Y and PC12 cells significantly.And the half maximal inhibitory concentration was 2 520μmol/L and 680μmol/L respectively,meanwhile this role became obviously after 48h and then gradually increased with time.CCK-8(10-6and 10-8mol/L)could obviously inhibit the effect ofmorphine on the survival rate of SH-SY5Y cells,while CCK-8(10-6,10-8and 10-10mol/L)could obviously inhibit the effectofmorphine on PC12 cells.②After treating SH-SY5Y cells and PC12 cellswith 3 000μmol/L and 1 000μmol/Lmorphine separately for 48 hours,both of the cells lost their normal shape with synapse shorten or lost,CCK-8(10-6and 10-8mol/L)could
receptors,cholecystokinin;morphine;forensic toxicology
R894.2
A
1007-3205(2013)01-0001-04
2012-09-12;
2012-10-22
国家自然科学基金(30672355,81172900);河北省应用基础研究重点基础研究项目(10966911D)
李冬(1984-),女,满族,河北石家庄人,河北医科大学基础医学院医学硕士研究生,从事物质成瘾研究。
*通讯作者。E-mail:chunlingma@126.com
10.3969/j.issn.1007-3205.2013.01.001
significantly improve cellmorphological alternation induced bymorphine.Conclusion Exogenous CCK-8 could inhibitmorphine-induced cytotoxicity in a concentration-dependentway.
