不同药用辅料对人α防御素5抗菌活性影响的单因素实验研究
2013-03-03周小林申明强贺赐安王军平第三军医大学军事预防医学院防原医学教研室全军复合伤研究所创伤烧伤与复合伤国家重点实验室基础部外科应用解剖与手术学教研室重庆400038
周小林,王 成,申明强,陈 默,贺赐安,王军平 (第三军医大学:.军事预防医学院防原医学教研室,全军复合伤研究所,创伤、烧伤与复合伤国家重点实验室;2.基础部外科应用解剖与手术学教研室,重庆400038)
半个多世纪以来抗生素的广泛使用给临床感染性 疾病的治疗产生了革命性的深远影响。然而细菌多药耐药性的产生,给疾病的治疗带来了极大的困难,逐渐成为了世界性普遍关注和难以解决的问题,新型抗菌药物的研制迫在眉睫。近年来发现的防御素,作为机体天然防御系统重要组成部分,广泛分布于生物体内,以其广谱抗微生物活性和在有效剂量内不产生耐药性的特点备受关注。人α防御素5(human α-defensin 5,HD5)是由35~55个氨基酸组成,分子量只有3~5 kD的富含半胱氨酸残基的阳离子短肽,主要在人小肠潘氏细胞、生殖道上皮细胞及鼻黏膜细胞分泌表达,对革兰氏阴性菌、阳性菌、病毒均有较强的杀灭作用[1]。HD5具有特定的空间结构,广泛的抗菌活性、细胞毒性和免疫趋化作用[2]。为了进一步的新药应用的研究,我们选择了不同药用辅料进行单因素实验,为下一步制剂配方的研制提供实验依据。
1 材料与方法
1.1 材料与设备
配制LB培养基所需的胰蛋白胨、酵母提取物、琼脂粉等购自英国Oxoid公司,配制缓冲液所使用的磷酸二氢钾和磷酸氢二钾,辅料甘油、蔗糖、NaCL等试剂均为国产分析纯试剂。药用辅料羟丙基-β-环糊精(HP-β-CD)、吐温80、尼泊金甲酯钠购自生工生物工程(上海)股份有限公司。原始大肠埃希菌(ATCC25922)菌株为本室冻存。多肽由杭州中肽生化有限公司合成(干粉状),用灭菌超纯水配制,-70℃保存,取用时临时用超纯水配制成需要的浓度。其他设备如超净台、-70℃及4℃冰箱、pH计、培养箱、摇床、烘干机等设备均为本室所有。
1.2 方法
1.2.1 HD5抗菌活性检测 原始大肠埃希菌E.coli菌株活化后,挑单克隆接种于5 mL LB液体培养基中,37℃、200 r/min震荡培养过夜约12 h形成种子液。将种子液1∶1 000接种于LB液体培养基中,37℃、200 r/min扩增3 h至菌液OD(600)值为0.5 ~0.6 时取出,低温(4℃)10 000 r/min 离心5 min。将菌体用缓冲液洗涤2次,再次测定菌液 OD(600)值,并将 OD(600)值调定为0.5,稀释100 倍,制成2.5 ×106/mL 的悬液,加入96孔培养板中,每孔20 μl(总体积50 μl),加入反应终浓度分别为 25.00、12.50、6.25、3.12 μg/mL 的 HD5 多肽,每个终浓度设置2个复孔,同时设置各浓度辅料未加入HD5作为对照组。37℃、150 r/min震荡培养2 h后取出20 μl加入含1%LB液体的缓冲液中稀释1 000倍,取出100 μl制作LB平板。将平板置于37℃培养箱中连续培养超过12 h,计数平板菌落数,分别计算细菌抑菌率[抑菌率=(1-实验组平均菌落数/空白对照组平均菌落数)×100%]。根据结果数据为后续加入药用辅料的实验选择合适的HD5浓度。
1.2.2 单因素实验选择辅料种类及其浓度 根据辅料对HD5的保护机理以及辅料筛选的一般原则,结合有关该方面文献报道和本实验室对药用辅料的前期研究,分别选取蔗糖、甘油、NaCl、吐温80、HP-β-CD、尼泊金甲酯钠作为单因素考察对象,并以抑菌率为响应值,筛选出HD5的适宜的辅料及其浓度范围。实验以各浓度辅料未加HD5为对照组,其中将未添加HD5和辅料的对照组称为空白对照组,而各浓度辅料加入HD5为实验组。具体做法是:将菌液稀释至2.5×106/mL后加入96孔板与12.5 μg/mL HD5和不同浓度的辅料反应后计数菌落数,从而计算出抑菌率,方法同前,统计并比较抑菌率。
1.2.3 抑菌率计算公式 实验组抑菌率=(1-实验组平均菌落数/空白对照组平均菌落数)×100%;对照组抑菌率=(1-对照组平均菌落数/空白对照组平均菌落数)×100%。
1.3 统计学方法
2 结果
2.1 HD5抗菌活性检测
不同终浓度HD5的抑菌率见图1,随着HD5质量浓度的增加,抑菌率明显升高。数据提示HD5终浓度为12.50 μg/mL时,其抑菌率在90% ~100%之间,既能达到较好的抑菌效果,又小于最低杀菌浓度,可以很好地反映HD5抗菌活性的量效关系,可将此浓度作为后续实验的HD5终浓度。
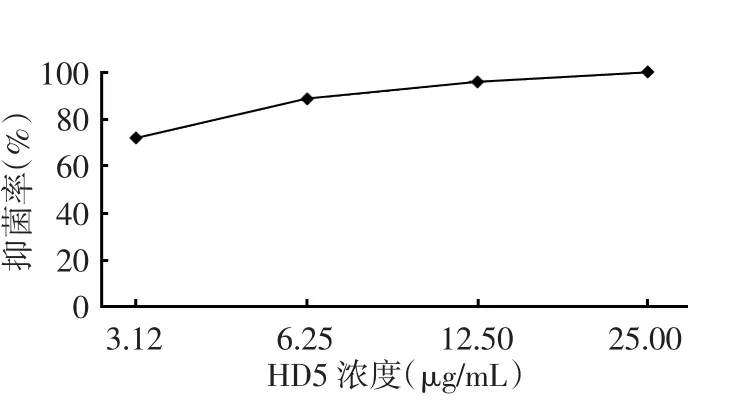
图1 不同浓度的HD5的抑菌率
2.2 保湿剂甘油对HD5抗菌活性的影响
本组数据显示,与甘油浓度0组比较,实验组各浓度辅料的抑菌率均没有统计学差异,但是对照组抑菌率随甘油体积浓度变化比较大(图2)。10%甘油的抑菌率显著低于其他组,且与甘油浓度0组比较,差异有统计学意义。而加入20%甘油处理时,对照组抑菌率略有下降,差异没有统计学意义;而40% ~50%甘油处理对照组抑菌率接近于实验组抑菌率,但由于40%~50%的甘油本身具有显著的抑菌活性,无法判断此浓度甘油是否会影响甘油的抑菌活性。因此,可选择低于10%体积浓度的甘油作为HD5的保湿剂和润滑剂,这个剂量不会影响到HD5的抗菌效果,又可以避免甘油表现出抑菌活性干扰实验结果,40%以上甘油可作为防腐剂使用。
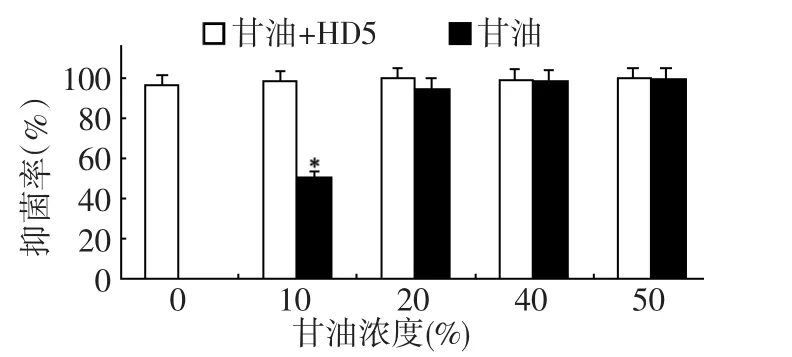
图2 不同浓度甘油对HD5抑菌率的影响
2.3 稳定剂NaCl和蔗糖对HD5抗菌活性的影响
实验结果数据显示(图3),随着NaCl质量浓度的增加,实验组和对照组抑菌率均呈现明显的下降趋势,说明NaCl可明显抑制HD5的抗菌活性。与只加HD5组比较,差异有统计学意义(P<0.05),因此NaCl不适合作为HD5的稳定剂。而终浓度为3%~12%蔗糖的实验组和对照组比较抑菌率均没有统计学差异,P >0.05。

图3 加入不同浓度NaCl对HD5抑菌率的影响
2.4 防腐剂尼泊金甲酯钠对HD5抗菌活性的影响
各浓度尼泊金甲酯钠加入后,HD5抗菌活性检测数据结果提示:与只加HD5组比较,质量浓度0~1%的尼泊金甲酯钠的抑菌率无明显变化,差异没有统计学意义(图5)。随着尼泊金甲酯钠质量浓度的增加,单独加入尼泊金甲酯钠的抑菌率呈现上升的趋势,到1%时抑菌率与单独加入HD5组抑菌率相同,差异没有统计学意义。数据提示加入1%尼泊金甲酯钠的抑菌活性在加和不加HD5是相同的,很难判断这个浓度的尼泊金甲酯钠是否影响HD5的抗菌活性,因此此浓度不作备选。根据防腐剂的使用规则,尽量选取小剂量的防腐剂,即0.05%尼泊金甲酯钠可作为HD5防腐剂浓度备选。
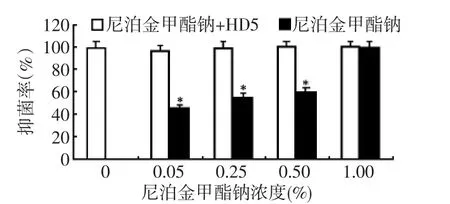
图4 加入不同浓度尼泊金甲酯钠对HD5抑菌率的影响
2.5 HP-β-CD和吐温80对HD5抗菌活性的影响
从表面活性剂HP-β-CD的实验数据可以看出:与HP-β-CD浓度0组比较,实验组10% ~20%HP-β-CD的抑菌率呈现明显的下降趋势,差异有统计学意义,P<0.05(图5)。而单纯加入各浓度HP-β-CD的对照组抑菌率均非常低,但呈现一定的上升趋势,抑菌率均低于相应浓度的实验组。因此在选取HP-β-CD作为抗氧化剂时质量浓度应控制在5%及以下,以不影响HD5抗菌活性和发挥HP-β-CD对HD5的抗氧化作用及表面活性剂作用最佳状态的基础上选择较低浓度。各质量浓度吐温80的实验组HD5抗菌活性检测数据结果提示:与吐温80浓度0组比较,实验组的抑菌率没有明显变化,差异没有统计学意义。但对照组中0.5%吐温80的抑菌率明显低于其他各组,2.5%~10%吐温80的抑菌率与实验组比较无显著差异,无法判断是否影响了HD5的抗菌活性,因此可将0.5%吐温80作为HD5的备选辅料浓度,见图6。
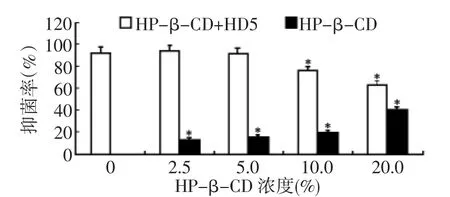
图5 加入不同浓度HP-β-CD对HD5抑菌率的影响
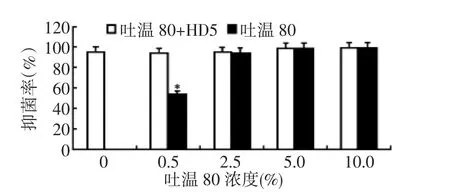
图6 加入不同浓度吐温80对HD5抑菌率的影响
3 讨论
随着分子生物学技术和基因重组技术的发展,蛋白质与多肽类药物凭借其独特的优势已逐渐成为一种重要的临床药物类型。目前已经批准上市的抗菌肽药物并不多,如多黏菌素和短杆肽菌是最早应用于临床的抗菌肽制剂,而2003年9月上市,用于治疗由金黄色葡萄球菌(包括耐甲氧西林金黄色葡萄球菌)、链球菌以及肠球菌引起的皮肤感染的达托霉素则是一种Ca2+依赖的阴离子多肽药物[3-4]。HD5作为一种阳离子小分子肽,抗致病微生物种类广泛、抗菌活性高,但其抗菌机制目前仍然不是很明确,根据同源抗菌肽推测其机制可能为:HD5吸附到细胞膜上致使膜结构通透性破坏,胞内重要矿物质、代谢物及小分子泄漏,致细菌死亡[5]。因此HD5可避免微生物产生耐药,有望开发成为新型的抗菌药物。但由于这类药物稳定性差,半衰期短,人体内广泛存在的各种酶类可以很快使其降解,失去活性[6]。因此HD5在生产、保存、运输和给药过程中都容易丧失活性,极大地限制了其在临床上的广泛应用。药用辅料是指在制剂处方设计过程中,为了解决制剂的有效性、稳定性、安全性和成型性,加入到主药中的一切药物用料的统称,是药物制剂生产和发展的物质基础,在制剂和药物生产中起着非常关键的作用。因此,在HD5制剂中添加各种辅料可起到稳定药物及延长使用期限等作用,这些辅料在有效浓度范围内不影响HD5抗菌活性,使药物抗菌效果稳定,在使用期间内避免失活,最好还能与HD5起到协同抗菌作用。
本实验结合相关文献及对于HD5的前期研究选取了甘油、NaCl、吐温80、HP-β-CD 等辅料进行了 HD5抗菌活性检测的单因素实验,为后期制剂配方的选取提供实验依据。文献报道HD5的体外抗菌浓度在10~100 μg/mL[7],这个浓度范围对正常功能的细胞无毒害作用[8-9]。根据本实验结果可知,随着HD5浓度的降低,HD5的抗菌活性逐渐降低,在不影响实验结果的前提下,选择12.5 μg/mL作为后期辅料筛选的HD5的终浓度。根据HD5的生物特性,选择HP-β-CD和吐温80作为助溶剂和抗氧剂及表面活性剂。由于在制备液体药剂过程中,防腐措施并不能完全保证无细菌污染,必要时应添加适当的防腐剂抑制微生物的生长繁殖,甚至杀灭微生物,但原则上应不用或少用防腐剂。因此本组选用尼泊金甲酯钠作为防腐剂被纳入实验。HP-β-CD易溶于水,对许多化合物具有优良的包络作用,可提高包络物质的稳定性,在生物体内可提高被包络药物的释放速度和生物利用度,对人体无毒,是一种很好的药物载体[10-11]。根据中国药典记述的吐温80不能与含酚羟基的消毒防腐剂配伍,如吐温80与尼泊金类、三氯叔丁醇、苯甲醇等联用时会导致其抑菌力减低。因此选用尼泊金甲酯钠作为防腐剂时不宜选用吐温80作为表面活性剂。甘油是较好的溶剂、保湿剂和润滑剂,而NaCl和蔗糖分别作为稳定剂纳入实验[12]。单因素实验结果表明0.29%NaCl和10%以上的HP-β-CD可使HD5的抑菌率明显下降(P<0.05),说明这些辅料对HD5的抗菌活性有影响。且随着NaCl浓度的增高,HD5的抑菌率呈现明显的下降趋势,这与文献报道的一致[13]。尼泊金甲酯钠、甘油、吐温80在设定的浓度范围内实验组抑菌率无明显变化,但1%尼泊金甲酯钠的对照组抑菌率和实验组相同,此浓度下无法判断是否影响了HD5的抗菌活性,故此浓度的尼泊金甲酯钠不适合作为HD5的辅料。另外2.5%及以上的吐温80、40%及以上的甘油的对照组抑菌率也和实验组相同,因此这些浓度最好不作为备选辅料。由于较高浓度的吐温80、甘油和尼泊金甲酯钠本身具有显著抑菌活性,因此在这些浓度范围内即使不加HD5,抑菌率也很高[14],很难判断这种情况下HD5的活性有没有受到影响,因此后期在选取这些辅料浓度时要注意区分二者的抑菌作用的主次关系。另有文献报道,NaCl在5%以下即可对大肠杆菌起到抑制作用,因此如果继续加大NaCl用量也可能起到抑菌作用,但这个作用可能不是HD5所赋予的,要注意区分[15]。
由于HD5是小分子物质,有不稳定、易被酶类分解等特性,用药方式还是以局部应用为主,主要通过皮肤、黏膜等给药,而系统用药比较少见。因此剂型主要是以外用和局部系统给药为主,如膏剂、喷雾剂、洗液等。在HD5中加入适当的药用辅料是药物制剂的必要步骤,也是药物研究非常重要的一个环节。
[1]Hazrati E,Galen B,Lu W,et al.Human alpha-and beta-defensins block multiple steps in herpes simplex virus infection[J].J Immunol,2006,177(12):8658-8666.
[2]杨 荣,嵇 武.防御素的生物学活性及与疾病的关系[J].肠外与肠内营养,2011,18(3):185-188.
[3]Fuchs PC,Barry AL,Brown SD.Daptomycin susceptibility tests:interpretive criteria,quality control,and effect of calcium on in vitro tests[J].Diagn microbiol Infect Dis,2000,38(1):51-58.
[4]方 超,张晓巩,周 颖,等.抗菌肽开发与应用的研究进展[J].中国抗生素杂志,2010,35(11):809-814.
[5]吴学敏,卢 颖,单 颖,等.人防御素5基因毕赤酵母重组表达系统的构建[J].现代预防医学,2010,37(13):2496-2497.
[6]Tanabe H,Ayabe T,Maemoto A,et al.Denatured human alpha-defensin attenuates the bactericidal activity and the stability against enzymatic digestion[J].Biochem and Biophys Res Commun,2007,358(1):349-355
[7]Benson VL,Khachigian LM,Lowe HC.DNAzymes and cardiovascular disease[J].Br J Pharmacol,2008,154(4):741-748.
[8]Dass CR,Choong PF,Khachigian LM.DNAzyme technology and cancer therapy:cleave and let die[J].Mol Cancer Ther,2008,7(2):243-251.
[9]Marquet R,Isel C,Ehresmann C,et al.tRNAs as primer of reverse transcriptases[J].Biochimie,1995,77(1-2):113-124
[10]陈星宇,辛剑宇,李建树.环糊精及其衍生物在多肽蛋白质药物非注射给药体系中的应用[J].中国生物工程杂志,2010,30(12):111-115.
[11]王亚南,王洪权,窦媛媛.羟丙基-β-环糊精在药剂学中的应用与研究[J].食品与药品,2007,7(4):47-50.
[12]秦华明,宗敏华,梁世中.糖在蛋白质药物冷冻干燥过程中保护作用的分子机制[J].广东药学院学报,2001,17(4):305-307.
[13]吴琼英,茅 妍.乳源抗菌肽的抑菌活性及其影响因素[J].江苏科技大学学报(自然科学版),2010,24(2):184-187.
[14]王 健,侯百友,孙玉梅,等.吐温-80、乙醚、NaCl对烃降解菌HB29产糖脂的影响[J].中国酿造,2010,(5):113-115.
[15]孙之南,王 娟,鲁梅芳,等.氯化钠对几种常见菌的抑制作用[J].盐业与化工,2007,36(1):12-15.
