虾蛄多肽的酶解工艺及其抗肿瘤活性的初步研究
2013-03-03林焕乐王泽峰马剑茵
林焕乐 王泽峰 马剑茵
浙江海洋学院食品与药学学院 医学院,浙江 舟山 316004
虾蛄多肽的酶解工艺及其抗肿瘤活性的初步研究
林焕乐 王泽峰 马剑茵
浙江海洋学院食品与药学学院 医学院,浙江 舟山 316004
目的:通过正交试验优化酶解条件,提取分离虾蛄软体组织,根据其体外抗肿瘤活性,筛选最佳酶解条件。方法:采用L16(45)正交试验设计方法,通过探索其抗前列腺癌作用,优化胰蛋白酶酶解虾蛄多肽的提取条件。结果:虾蛄多肽酶解最佳条件为:料液比1∶2,pH为7.5,加酶量为1000u/g,温度40℃,时间为4h,其对前列腺癌PC-3细胞株的体外抑制率为60.9%。结论酶解所得的虾蛄多肽对前列腺癌细胞具有一定的抑制生长作用。
虾蛄多肽;酶解;前列腺癌细胞;正交试验
近年来,有关生物活性肽的研发极为活跃,目前已有多种产品问世。来自海洋生物的活性肽尽管研发历史较短,但因其具有的独特生理功能而异军突起,成为活性肽领域的研究热点。海洋生物活性物质抗肿瘤研究是海洋生物活性物质开发与抗癌药物研究的一个重要领域。从众多的海洋生物中寻找有效的抗癌药物,提取制备海洋生物活性物质并对其抗肿瘤活性进行筛选是其中的研究重点[1-3]。
虾蛄在江浙一带俗称虾拔弹、虾钩弹,在北方一带俗称虾爬子,日本人称之为螳螂虾。它隶属于节肢动物门、甲壳纲、口足目。虾蛄与其他品种相比,具有能自然越冬、抗害避难和养殖风险小的优点,值得推广养殖[4]。近年来,规模化养殖虾蛄的水产业越来越多。本文采用胰蛋白酶水解虾蛄软体组织,通过正交试验优化酶解条件,提取制备虾蛄多肽,研究其体外抗肿瘤活性,筛选最佳酶解条件。
1 仪器与材料
1.1 材料 虾蛄采集自舟山群岛海域;前列腺癌细胞PC-3(原购自中国科学院上海细胞库,由本实验室传代保存);胰蛋白酶等试剂均为国药集团化学试剂有限公司 (分析纯)。
1.2 主要仪器与设备 HH-S型水浴锅(巩义予华仪器有限责任公司);FD-1000冷冻干燥机(上海爱朗仪器有限公司);BS-100A自动部分收集器(上海泸西分析仪器厂有限公司);CR21G冷冻离心机(日本日立);DHG-9023A型电热恒温鼓风干燥箱 (上海一恒科技有限公司);FiveEosy实验室pH计;JJ-2组织捣碎机(上海梅香仪器有限公司);RE-2000旋转蒸发仪(上海亚荣生化仪器厂);EYELA CA-III循环冷冻仪(上海爱朗仪器有限公司);SHB-III循环水式多用真空泵(郑州长城科技有限公司);Sephadex G-25凝胶柱。
2 实验方法
2.1 酶解工艺 酶解工艺参照Sheih等[5]的方法,采用胰蛋白酶水解虾蛄软体组织。将虾蛄洗净去壳,将虾蛄肉进行匀浆,用0.1mol/L的HCl和0.5mol/L的NaOH溶液调pH值,加入胰蛋白酶进行保温水解,水解完成后100℃、10min进行灭酶,将水解液8000r/min离心20min,取上清液,旋转蒸发,冷冻干燥。
2.2 细胞培养 选取人前列腺癌细胞PC-3(原购自中国科学院上海细胞库,由本实验室传代保存),用含10%胎牛血清的F12完全培养基于37℃,5%CO2的培养箱中培养,细胞呈单层贴壁生长,0.25%的胰蛋白酶消化,每2~3天传代1次,实验时选用对数生长期细胞。
2.3 细胞增殖抑制率的测定 采用MTT法检测。配制PBS溶液(pH值为7.2)和分别配置上述16组正交实验的虾蛄多肽溶液。取对数生长期的前列腺癌PC-3细胞制成悬液,接种至96孔板,每孔200μL,置5%CO2,37℃培养箱中分别培养24h。然后分别加入不同酶解工艺制得的虾蛄多肽(10mg/mL),每组分别设3个平行孔,同时设不加药作为对照组,置5%CO2,37℃培养箱中孵育72h。培养结束后,加PBS溶液(pH值为7.2)清洗3次,再加MTT继续培养4h。吸弃MTT,加二甲基亚砜每孔150μL,置酶联免疫检测仪在490nm测吸光度,计算细胞增殖抑制指数(IR),按下列公式计算:

2.4 酶解工艺的影响因素和优化 观察A(料液比)、B(pH)、C(加酶量)、D(温度)、E(时间)等因素对酶解工艺的影响,每个因素选四个水平进行L16(45)的正交实验,比较胰蛋白酶在不同水解条件下的抗肿瘤活性,从而确定最佳酶解条件。
3 结果与讨论
3.1 酶解工艺条件对抗肿瘤活性的影响
3.1.1 料液比对PC-3细胞增殖抑制率的影响
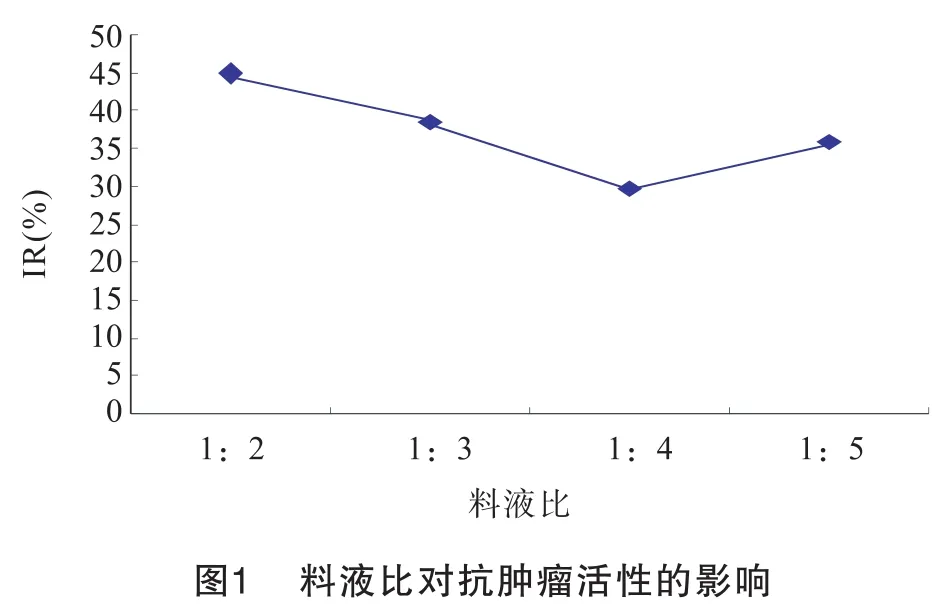
如图1所示:在一定的料液比例下,随着料液比的增
加,抗肿瘤活性下降,但当比例继续增大时,抑制率又有所增加,料液比对胰酶酶解虾蛄多肽有较大的影响。本实验测得当料液比为1:2时,抗肿瘤活性最优。
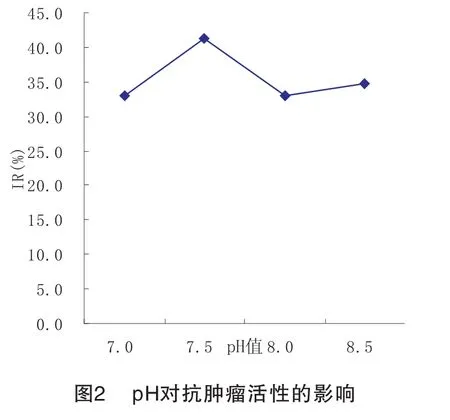
3.1.2 pH值对PC-3细胞增殖抑制率的影响 如图2所示:在一定的范围内,随着pH值的增加,抗肿瘤活性呈现先上升趋势,再继续增加pH值,抗肿瘤活性又有所下降,继而又缓慢上升。本实验测得当pH值为7.5时抗肿瘤活性最高。
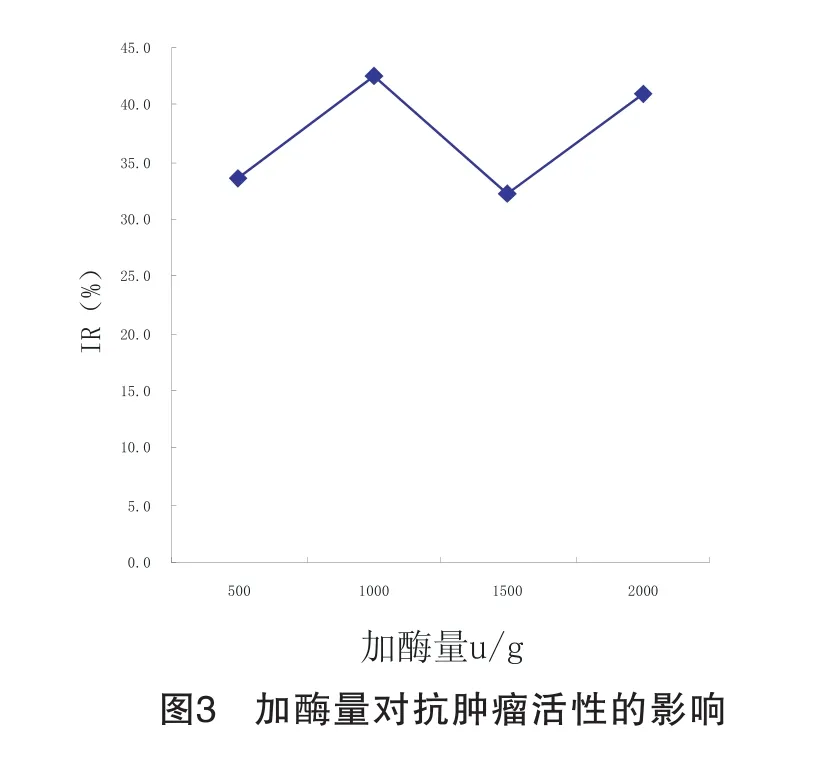
3.1.3 加酶量对PC-3细胞增殖抑制率的影响 如图3所示:加酶量的改变,虾蛄抗肿瘤活性呈现交替现象,当加酶量为500-1000u时抗肿瘤活性增加;当加酶量为1000-1500u时,抗肿瘤活性下降;继续增加500u抗肿瘤活性又呈现下降趋势。
3.1.4 酶解温度对PC-3细胞增殖抑制率的影响 如图4所示,酶解温度对胰蛋白酶酶解虾蛄多肽的抗肿瘤活性变化明显。在一定范围内,随着温度增加,抗肿瘤活性上升,继续增加温度,抗肿瘤活性又下降。当温度为40℃时,抗肿瘤活性最佳。
3.1.5 酶解时间对PC-3细胞增殖抑制率的影响 如图5所示:随着酶解时间的增加,抗肿瘤活性先缓慢增加,继而呈现迅速下降,再逐渐趋于平缓。其中,4h时的抗肿瘤活性最强。可见,酶解时间对胰酶酶解虾蛄多肽有一定的影响,以4h最优。
3.2 正交实验优化酶解工艺
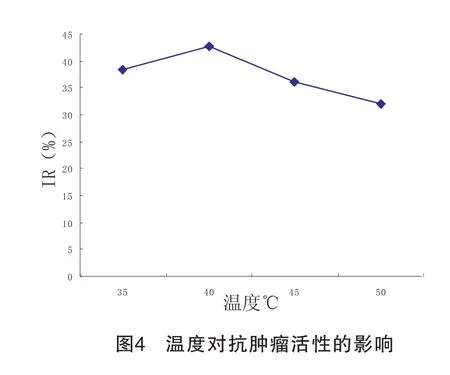


表1 Trypsin正交试验设计及结果L16(45)
结果表明,影响前列腺癌PC-3细胞增殖抑制率的各因素的主次顺序为:A(料液比)>E(时间h)>D(温度℃)>C(加酶量u/g)>B(pH值)。IR值最大时的水解条件为A1B2C2D2E2,即料液比为料液比1:2,pH为7.5,加酶量为1000u/g,温度40℃,时间为4h,其对前列腺癌PC-3细胞株的体外抑制率为60.9%。
4 讨论
本实验针对虾蛄多肽体外抗前列腺癌PC-3细胞活性进行了正交试验分析,筛选出了胰蛋白酶酶解的最优条件,其抗肿瘤活性多肽的进一步分离纯化以及作用机制有待于深入研究。
[1]欧阳高亮,李祺福,田长海.海洋生物抗肿瘤活性物质及其作用机理研究进展[J].海洋科学,2003,27(7):21-24.
[2]李盛英,郑忠辉.国外海洋抗肿瘤活性物质的研究与开发 [J].海洋通报,2003,22(2):76-82.
[3]洪水根.海洋生物活性物质在肿瘤治疗及临床检测中的应用 [J].厦门科技,2003,2:55-58.
[4]曹根庭,裘迪红,张义浩,等.虾蛄的综合利用 [J].浙江水产学院学报,1996,15(1):74-76.
[5]Sheih JC,Wu TK,Fang TJ.Antioxidant properties of a new antioxidative peptide from algae protein waste hydrolysate in different oxidation saystems[J]. Bioresour Technol,2009,100:3419-3425.
R931.4
A
1007-8517(2013)10-0016-03
2013.04.15)
林焕乐(1990-),女,大学本科.
马剑茵※(1962-),女,教授,硕士生导师,从事海洋生物活性成分的药理研究.E-mail:chymjy@zjou.edu.cn.
