HPLC法测定羌活中紫花前胡苷的含量
2013-03-03黄育生袁贤琳钟瑜王汝俊
黄育生袁贤琳钟 瑜王汝俊
1.广州中医药大学脾胃研究所,广东 广州 510405;2.广东省广州花海药业股份有限公司,广东 广州 510370
HPLC法测定羌活中紫花前胡苷的含量
黄育生1袁贤琳2*钟 瑜2王汝俊1
1.广州中医药大学脾胃研究所,广东 广州 510405;2.广东省广州花海药业股份有限公司,广东 广州 510370
目的:建立HPLC法测定羌活中紫花前胡苷含量的方法。方法:HPLC条件:色谱柱为Agilent HC-C18柱(5μm,4.6× 250mm),流动相为甲醇-水(32∶68),流速为1.0ml·min-1,检测波长为335nm,柱温为35℃。结果紫花前胡苷范围为4.00μg·ml-1~100.00μg·ml-1,平均回收率为99.90%,RSD为1.50%。结论:该法操作简单,重现性好,结果准确,可作为羌活中紫花前胡苷的含量测定方法提供参考依据。
羌活;紫花前胡苷;HPLC
羌活为伞形科植物羌活Notopterygium incisum Ting ex H.T.Chang或宽叶羌活Notopterygium franchetii H.de Boiss.的干燥根茎和根。本品具有解表散寒,祛风除湿,止痛的功效,常用于治疗风寒感冒,头痛项强,风湿痹痛,肩背酸痛[1]。其主要成分有香豆素类成分 (如紫花前胡苷、羌活醇及异欧前胡素等)、挥发油、阿魏酸等[2]。有研究表明紫花前胡苷是羌活的有效成分,具有镇痛、抗炎作用[3]。但是2010年版药典第一部只收载了羌活醇和异欧前胡素总量的含量测定方法,且目前对于HPLC法测定羌活中的紫花前胡苷含量的报道很少。本文研究建立了HPLC法测定羌活中的紫花前胡苷含量,为羌活的质量控制及复方制剂中羌活的有效成分转移率提供新的参考依据。结果表明本方法操作简单,准确,重现性好。
1 仪器与试药
高效液相色谱仪:SPD-20A紫外检测器,LC-20AT泵(日本岛津公司);Sartorious BT 25S电子天平(北京赛多利斯科学仪器有限公司);HH-6数显恒温水浴锅 (常州澳华仪器有限公司);KQ-100DE型超声清洗器(昆山市超声仪器有限公司)。
羌活中药饮片(批号20100702,佛山市中药饮片厂有限公司);紫花前胡苷对照品(批号111821-201102,中国食品药品检定研究所);甲醇为色谱纯,其余试剂均为分析纯。
2 色谱条件与系统适用性
Agilent HC-C18色谱柱(5μm,4.6×250mm);流动相:甲醇-水(32∶68);流速:1ml·min-1;柱温:35℃;检测波长:335nm。紫花前胡苷峰与前后峰的分离度均在1.5以上,理论板数按紫花前胡苷峰计算应不低于3000。
3 实验方法与结果
3.1 对照品溶液的制备 精密称取紫花前胡苷对照品,加甲醇制成每1ml含40μg的溶液,即得。
3.2 供试品溶液的制备 取药材粉末 (过三号筛)约0.5g,精密称定,置于具塞锥形瓶中,精密加入50%甲醇50m l,称定重量,超声30min。放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,精密量取续滤液25ml,置于蒸发皿中,水浴蒸干,残渣用水约20ml使溶解,并转移至分液漏斗中,用水饱和正丁醇萃取4次,每次20ml,合并正丁醇液,水浴蒸干,残渣用甲醇溶解并转移至25ml量瓶中,稀释定容至刻度,摇匀,滤过,取续滤液,即得。
3.3 测定法 分别精密吸取对照品溶液5μl和供试品溶液10μl,注入液相色谱仪,按上述色谱条件测定,见图1。

3.4 线性关系考察 精密称取紫花前胡苷对照品5.00mg置于25m l的量瓶,用甲醇稀释至刻度,即得浓度为0.20mg ·m l-1的对照品溶液贮备液,分别精密量取上述贮备液0.2、0.5、1、2、3、4、5ml,置于10m l量瓶中,用甲醇稀释至刻度,即得浓度为4.00、10.00、20.00、40.00、60.00、80.00、100.00μg·m l-1的梯度对照品溶液,精密量取上述梯度对照品溶液各5μl,按上述色谱条件测定,以对照品峰面积Y为纵坐标,对照品溶液 (μg/ml)为横坐标,绘制标准曲线。结果表明:紫花前胡苷浓度在4.00μg ·m l-1~100.00μg·ml-1范围内与峰面积具有良好的线性关系,回归方程为:Y=270.85+1.3598×104X,r=0.9999。
3.5 精密度试验 精密吸取同一对照品溶液5μl连续进样
6次,记录峰面积,计算紫花前胡素峰面积的RSD(n=6)为0.4%,表明仪器精密度良好。
3.6 重复性试验 取同一批药材,按供试品溶液制备方法平行制备6组供试品溶液,按上述色谱条件测定,结果样品中紫花前胡苷的平均含量(n=6)为0.266%,RSD为2.9%。
3.7 稳定性考察 取同一个供试品溶液,分别于0、2、4、6、8、10、12h进样,按上述色谱条件测定,结果紫花前胡苷峰面积的RSD(n=7)为0.3%,表明供试品溶液在12小时内稳定。
3.8 加样回收率试验 精密称取“3.6”项下已知紫花前胡苷含量的羌活药材粉末(过三号筛)约0.25g,分取6份,精密称定,置于具塞锥形瓶中,分别精密加入浓度为0.0133mg·m l-1的对照液50m l(精密称取紫花前胡苷对照品6.65mg,置于500ml量瓶,用50%甲醇稀释至刻度,即得浓度为0.0133mg·ml-1的对照液),称定重量,超声30min。放冷,再称定重量,用浓度为0.0133mg/m l的对照液补足减失的重量,摇匀,滤过,按 “3.2”项下方法制备供试品溶液,按上述色谱条件测定,计算回收率,结果平均回收率(n=6)为99.64%,RSD为1.22%。见表1。
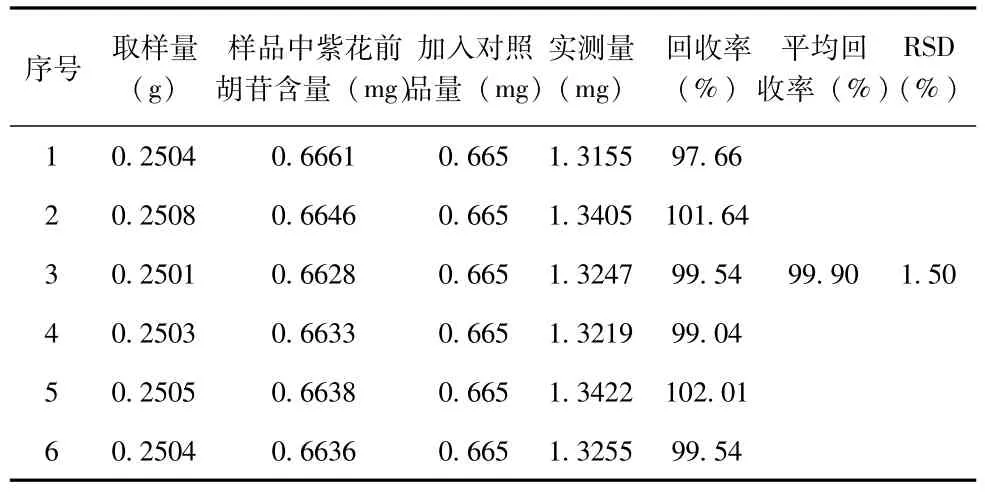
表1 加样回收率试验测定结果
3.9 样品测定 取产地为四川的羌活药材,共5批,按“3.2”项下的方法制备供试品溶液,按上述色谱条件测定,结果见表2。
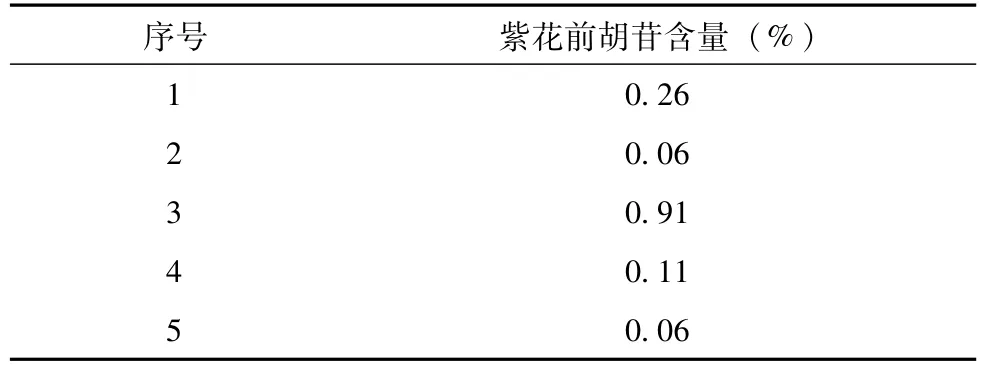
表2 不同批次羌活的紫花前胡苷含量
4 讨论
4.1 样品萃取纯化 试验中发现,只对羌活进行超声处理,供试品中杂质较多,而用水饱和正丁醇萃取之后与前者比较,杂质大大减少,并且紫花前胡苷的含量无明显差异,故从保护色谱系统,减少杂质干扰方面考虑,选择用水饱和正丁醇处理纯化供试品溶液。试验比较结果亦表明萃取四次后,第五次的萃取液几乎不含紫花前胡苷。
4.2 样品提取方法的选择 试验中对加热回流提取1h和超声处理30min的样品中的紫花前胡苷提取效果进行对比,结果表明两种方法对紫花前胡苷的提取效果无明显差异,但超声处理方法简便快捷,故选择超声处理30min。
4.3 提取溶剂的选择 试验中对比了甲醇和50%甲醇对紫花前胡苷提取效果的影响,结果表明,两者对紫花前胡苷的提取效果无明显差异,故从成本及环保等方面考虑,选择50%甲醇为提取溶剂。
4.4 超声时间的选择 试验中对比了20、30、40min三个超声时间对紫花前胡苷提取效果的影响,结果表明30min和40min的提取效果无明显差异,而比20min的提取效果略高,故选择超声处理30min。
4.5 吸收波长与流动相比例选择 取紫花前胡苷对照品的甲醇溶液,在紫外分光光度计190~400nm波长扫描。结果在335nm波长处有最大吸收,故选择335nm为本品的测定波长,见图2。
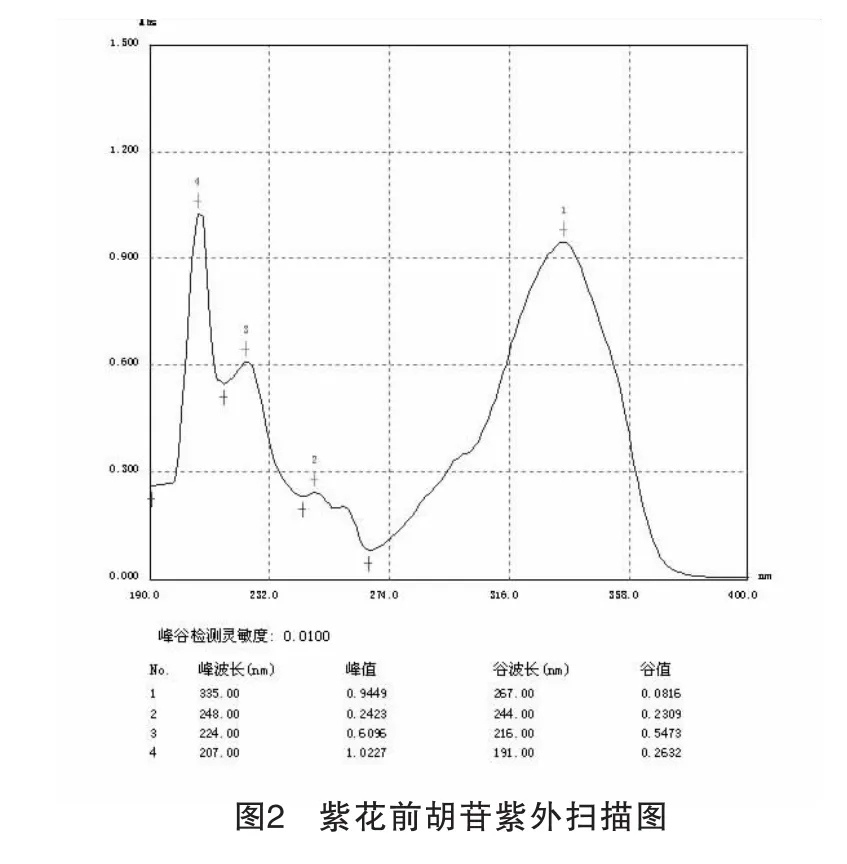
流动相甲醇-水的比例调节为32:68时,紫花前胡苷峰与前后峰的分离度均大于1.5。
4.6 孙玉茹等[4]的研究,流动相为甲醇-水-乙腈(6∶71∶21)测定羌活中紫花前胡苷含量,紫花前胡苷的保留时间较小,试验中发现,供试品杂质较多,较小保留时间可能会有峰的重叠,分离度不符合要求。朱美晓等[5]的研究,以乙腈-水(15∶85)为流动相,使用不同色谱柱Phenomenex Synergi4u Hydro-RPC18,Phenomenex Luna C18和Agilent Extend-C18测定羌活中紫花前胡苷含量,只有Phenomenex Synergi4u Hydro-RP C18能达到最佳分离效果,而其他色谱柱都不能有效分离。而本试验使用Agilent HCC18色谱柱(5μm,4.6×250mm),以甲醇-水(32∶68)亦能达到有效分离。
某些中药亦含有紫花前胡苷,如紫花前胡、前胡等,并有HPLC法紫花前胡苷含量测定的相关标准[6]文献报道[7]。
本试验参考上述相关标准及文献的方法,考察各个因素对紫花前胡苷提取效果及HPLC色谱分离效果的影响,最终优化建立了HPLC法测定羌活中紫花前胡苷含量的方法,该法操作简单,重现性好,结果准确,可作为羌活中紫花前胡苷的含量测定方法提供参考依据。尤其是中药复方制剂成分复杂,使用水饱和正丁醇萃取可有效地纯化紫花前胡苷,减少杂质,这对含羌活的复方制剂的质量控制有重大的参考意义。
[1]国家药典委员会.中华人民共和国药典 (一部).北京:中国医药科技出版社,2010:170.
[2]李云霞,高春华.中药羌活化学成分及药理作用研究进展 [J].辽宁中医学院学报,2004,6(1):22-23.
[3]秦彩玲,张毅,刘婷,等.中药羌活有效成分的筛选试验 [J].中国中药杂志,2001,25(10):639.
[4]孙玉茹,李先端,孙有富.高效液相色谱法测定不同产地羌活中紫花前胡苷的含量[J].中国中药杂志,2001,26(11):737.
[5]朱美晓,陈燕,易进海,等.羌活药材薄层色谱鉴别与含量测定 [J].时珍国医国药,2011,22(1):116-117.
[6]国家药典委员会.中华人民共和国药典 (一部).北京:中国医药科技出版社,2010:317-318.
[7]徐勤,刘布鸣.高效液相色谱法测定前胡属植物中紫花前胡苷的含量[J].中国中药杂志,2000,25(12):731-732.
Determination of the contents of nodakenin in Notopterygii Rhizoma et Radix by HPLC
HUANG Yu-sheng1,YUAN Xian-lin2*,ZHONG Yu,WANG Ru-jun1
objective:To establish a method for determination of the contents of nodakenin in Notopterygii Rhizoma et Radix by HPLC.Methods:The chromatographic condition:Agilent HC-C18 column(5μm,4.6×250mm),CH3OH-H2O(32-68)as mobile phase,the flow rate is1.0ml·min-1,the detection wavelength is335 nm,the column temperature is 35℃.Results:The calibration curves showed good linearlty in the range of 4.00μg·m l-1~100.00μg·ml-1,the average recoveries is 99.90%,RSD is 1.50%.Conclusion:This method is simple,with exact result and good repeatiton and can be used as the
for determination of the contents of nodakenin of Chinese medicine qianghuo.
Notopterygii Rhizoma et Radix;nodakenin;HPLC
R284.1
A
1007-8517(2013)10-0014-02
2013.03.26)
