帕瑞昔布钠对肢体缺血再灌注损伤炎症介质的影响
2013-02-28吴从月杭州市第三人民医院麻醉科杭州310009
张 华 周 洁 吴从月 杭州市第三人民医院麻醉科 杭州 310009
缺血后再灌注不仅不能使组织器官功能恢复,反而加重组织、器官的功能障碍和结构损伤,这种现象称为缺血再灌注损伤。本研究观察新型的选择性COX-2抑制剂帕瑞昔布钠对人体肢体缺血再灌注损伤中炎症介质释放的影响,报道如下。
1 临床资料
2011年11月—2012年6月,选择美国麻醉师协会(ASA)分级标准Ⅰ~Ⅱ级,在本院行择期单侧下肢血管外科手术病例40例,采用随机数字表法分为帕瑞昔布钠组20例,男14例,女6例,平均年龄(45.1±10.7)岁,平均体质量(63.6±9.2)kg,平均身高(164.1±7.9)cm。缺血对照组 20例,男12例,女 8例,平均年龄(42.5±8.8)岁,平均体质量(65.9±11.1)kg,平均身高(161.5±9.1)cm。两组术前均无明显心肺疾患,无特殊用药史,术前血常规、尿常规、肝肾功能、血电解质处于正常范围。排除术前服用非甾体类抗炎药物和糖皮质激素的患者以及术中失血超过400mL或Hb<70g/L者。本研究已获医院伦理委员会批准,所有患者或家属签署知情同意书。
2 方法
2.1 麻醉方法 常规监测心电图、血压、脉搏血氧饱和度等,开放静脉后静滴乳酸钠林格氏液8~10mL/(kg·h)。两组均采用蛛网膜下腔麻醉,选择腰3/4或者腰2/3进行穿刺,穿刺成功后给予重比重布比卡因10~15mg(含10%葡萄糖1mL),控制麻醉上平面在胸8至胸10水平。给予鼻导管吸氧,流量1.5L/min。两组患者自患肢远端向近端用驱血带驱血后,在大腿中上1/3处上止血带,压力60kPa。术中未使用其他静脉麻醉药物,未予输血。当平均动脉压<55mmHg或下降幅度大于基础值的30%时给予麻黄素6mg静脉注射,必要时追加;若心率<50次/min,给予阿托品0.3~0.5mg静脉注射。术后送至恢复室观察120min后,达到恢复室出室标准后送回病房。帕瑞昔布钠组在麻醉前15min予帕瑞昔布钠40mg加入5mL生理盐水中静脉注射,对照组在麻醉前15min静脉注射5mL生理盐水。于上止血带前(T1)、松止血带后 5min(T2)、松止血带后 30min(T3)、松止血带后120min(T4)四个时间点抽取上臂肘正中静脉血。所有患者止血带时间均不超过90min。
2.2 观察指标 采用酶联免疫检测(ELISA法)测定血浆丙二醛(MDA)、白细胞介素 8(IL-8)和肿瘤坏死因子α(TNF-α)的浓度(均使用美国CUSABIO公司的试剂盒,MDA试剂盒批号:C0202070101,IL-8试剂 盒 批 号 :M13018937;TNF-α 试 剂 盒 批 号 :J26018936),使用HITACHI-7600全自动生化仪(日立公司生产)测定肌酸激酶(CK)的血浆浓度。
2.3 统计学方法 应用SPSS13.0统计软件,使用GraphPad Prism4软件进行制图。所有计量资料进行正态性检验,以均数±标准差(x±s)表示,各炎症介质血浆浓度组间比较采用两组独立样本t检验;性别比较采用χ2检验;各炎症介质血浆浓度进行组内比较先采用重复测量资料的方差分析,组内两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
3 结果
帕瑞昔布钠组上止血带时间(58.8±16.5)min,对照组为(54.5±19.3)min,两组比较差异无统计学意义(P>0.05)。各时点 MDA、TNF-α、IL-8、CK 组内比较:与上止血带前(T1)比较,帕瑞昔布钠组CK血浆浓度在松止血带后 5min(T2)、30min(T3)、120min(T4)显著升高(P<0.05);MDA、TNF-α、IL-8 血浆浓度在松止血带后 30min(T3)、120min(T4)显著升高(P<0.05);对照组MDA、CK血浆浓度在松止血带后5mim(T2)、30min(T3)、120min(T4)显著升高(P<0.05),TNF-α、IL-8 血浆浓度在松止血带后 30min(T3)、120min(T4)显著升高(P<0.05)。两组 TNF-α、MDA、IL-8、CK各时点比较差异无统计学意义(P>0.05);帕瑞昔布钠组MDA浓度在松止血带后5min(T2)较对照组明显降低(P<0.05)。见表 1,图 1~4。
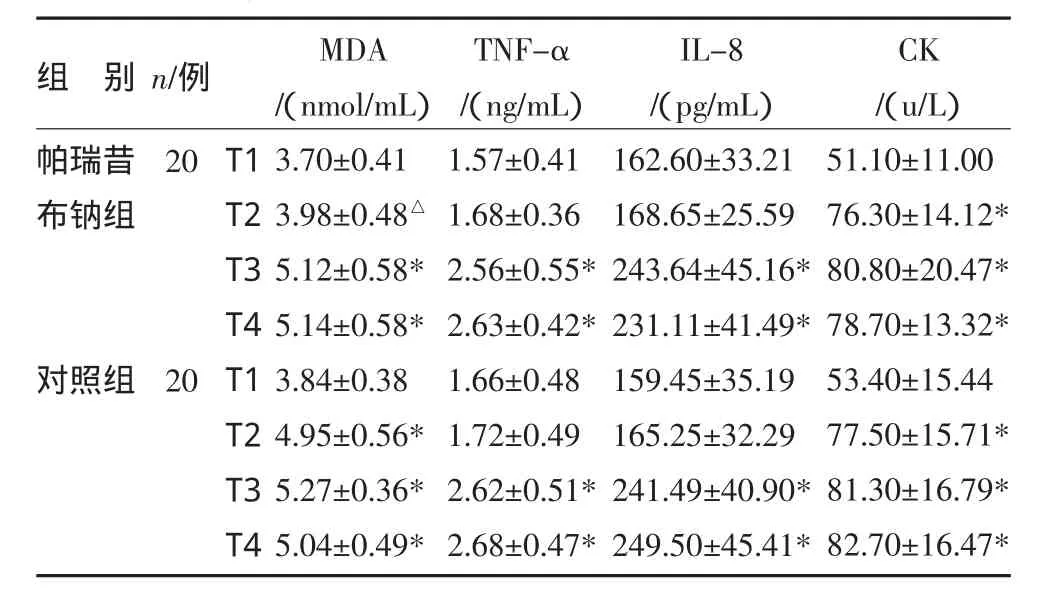
表1 两组四项炎症指标比较(x±s)
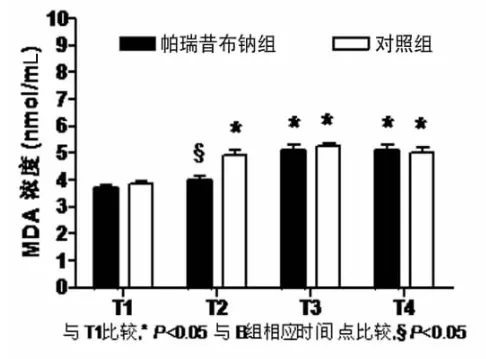
图1 MDA
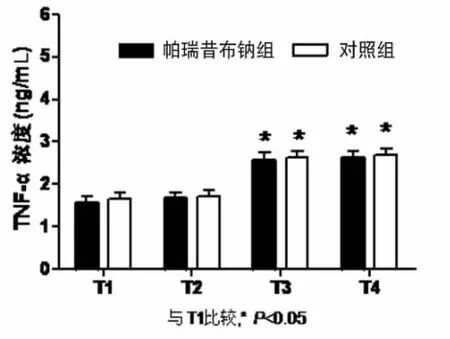
图2 TNF-α
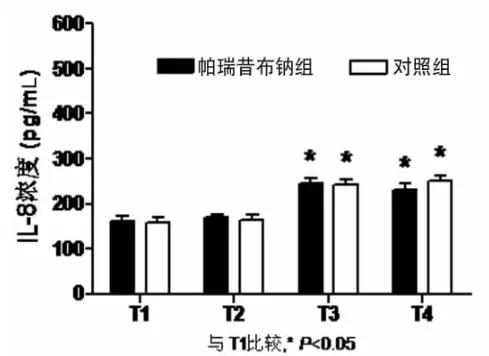
图3 IL-8
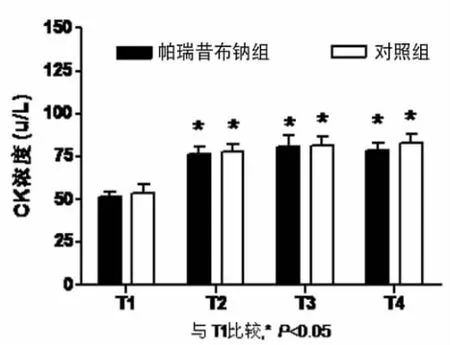
图4 CK
4 讨 论
下肢手术经常使用止血带,会导致肢体缺血,长时间应用止血带可以诱发骨骼肌的缺血再灌注损伤[1]。本实验选择下肢血管外科手术进行研究。缺血组织获得氧供可产生氧自由基,使细胞膜脂质过氧化,破坏细胞膜的脂质双分子层,形成脂质过氧化物(LPO)。丙二醛(MDA)是LPO的终末代谢产物,通过测定MDA含量可反映氧自由基引起的再灌注损伤的程度。肿瘤坏死因子α(TNF-α)是一种重要的初级细胞因子,可活化多种促炎因子,在炎症介质的释放过程中,TNF-α可能起核心作用,诱发IL-6、IL-8以及继发性炎症介质的释放,激发炎症连锁反应[2]。白细胞介素-8(IL-8)是一种小分子量的活性多肤,被认为是促炎性反应因子[3],缺血再灌注后,IL-8可显著增高。CK是催化骨骼肌中磷酸原(ATP-CP)供能系统的一个关键酶。正常情况下,肌细胞膜完整,CK储存于肌细胞内。当肌细胞膜的结构完整性受损时,CK可漏出肌细胞进入血液循环,表现为血清中CK活性升高[4]。止血带应用过程中骨骼肌的超微结构也有破坏。因此,检测血清中CK的水平,也可以间接反映缺血再灌注损伤的程度。
在选择性COX-2抑制剂和缺血再灌注损伤的研究中,较多研究选择性COX-2抑制剂对心脏、脑和肾缺血后的影响,而有关选择性COX-2抑制剂和肢体缺血再灌注损伤的研究较少。COX-2通过酶诱导方式表达,正常情况几乎不产生,当应激反应及炎症反应发生时,可急剧增长8~10倍,促使前列腺素E1、E2及前列环素的合成增加,加剧炎症反应[5]。帕瑞昔布钠为高选择性COX-2抑制剂,其本身无生物学活性,在静注或肌注后经肝脏酶水解,迅速转化为伐地昔布。伐地昔布对COX-2的选择性是对COX-1的28 000倍,通过抑制COX-2,在发挥抗炎镇痛作用的同时,不影响胃黏膜、血小板及肾功能,减轻应激反应,有利于患者恢复[6]。
实验中对照组MDA和CK血浆浓度从T2开始即显著高于T1,TNF-α和IL-8的T2与T1比较无明显差异,直到T3时点才增高,说明MDA和CK对肢体的缺血再灌注损伤较为敏感,在止血带松开之后就有变化,TNF-α和IL-8在止血带松开30min以后显著升高说明TNF-α和IL-8的变化相对于MDA和CK有一定的滞后性,与TNF-α和IL-8参与全身的炎症反应和级联放大有一定关系。
帕瑞昔布钠组MDA血浆浓度在T2相比于T1无变化,T3、T4时点显著高于T1,与对照组比较,增高的反应略显滞后,但总体升高趋势相同。两组TNF-α、IL-8和CK比较差异无统计学意义(P>0.05)。本组结果显示,40mg帕瑞昔布钠超前镇痛并不能减少由止血带引起的炎症介质的释放。
文献[7]报道,提前7天给予小鼠选择性COX-2抑制剂塞来昔布10mg/(kg·d),可以减少肢体缺血再灌注损伤中炎症介质的释放,对其他远隔器官如肝、肾、肺的保护也有一定意义。也有研究发现,抑制COX-2的表达能明显阻断心肌的自我保护作用,可以加重心肌的缺血后损伤[8];使用选择性COX-2抑制剂可以造成前列环素(prostacyclin,PGI2)和促凝血素(thromboxane,TAX2)的失平衡,亦是对心血管的不利因素[9]。由此可见,选择性COX-2抑制剂在缺血再灌注损伤中具有双重作用,既有保护的作用,也有不利的因素。本实验的给药剂量和用药周期均未达到动物实验的水平,这或许是两组结果差异不显著的原因,不过这也说明了使用临床剂量的帕瑞昔布钠对于肢体缺血再灌注损伤中炎症介质的释放无影响,即提前给予临床剂量的帕瑞昔布钠40mg,并不能有效抑制肢体缺血再灌注损伤中炎症介质的释放,既不提供肢体缺血再灌注损伤的保护作用,也不加重肢体缺血再灌注损伤中的不利影响。
本研究上止血带时间与压力均未超过临床上止血带的安全时限90min、压力60kPa。本研究的观察时间为松开止血带后2h内,而国内其他研究观察的时间窗多为24~48h内。在本研究中,患者进入手术室后至离开恢复室前的这段时间内可以做到尽可能排除各种干扰因素,但难以控制离开恢复室进入病房后的某些干扰因素,如在病房内使用止血药和抗凝剂、使用其他血管活性药物、卧床时间长短、抗生素使用以及体温变化和退热剂的使用等等,这些因素都有可能对研究结果产生影响。今后拟加大样本量,延长观察时间至48h,同时监测体温变化,对肢体缺血再灌注损伤进行更全面的研究。
综上所述,临床使用止血带可诱发肢体缺血再灌注后炎症介质的释放,临床剂量的帕瑞昔布钠对于肢体缺血再灌注损伤后 120min内 CK、MDA、TNF-α、IL-8等炎症介质的释放无影响。
[1] Tountas CP,Bergman RA.Tourniquet ischemia:ultrastructural and histochemical observations of ischemic human muscle and of monkey muscle and nerve[J].JHand Surg Am,1977,2(1):31-37.
[2]张延龄.严重创伤后的免疫抑制及其调节治疗[J].国外医学外科学分册,2000,27(1):2-5.
[3] Drabe N,Zund G,Gyunenfelder J,et al.Genetic predisposition in patients undergoing cardiopulmonary bypass surgery is associated with an increase of inflammatory cytokines[J].Eur JCardiothorac surg,2001,(20):609-613.
[4] Brancaccio P,Maffulli N,Buonauro R,et a1.Serum enzyme monitoring in sportsmedicine[J].Clin Sports Med,2008,27(1):1-18.
[5]Katagiri H,Ito Y,Ishii K,et al.Role of thromboxane derived from COX-1 and-2 in hepaticmicrocirculatory dysfunction during endotoxemia in mice[J].Hepatology,2004,39(1):139-150.
[6]Talley JJ,Bertenshaw SR,Brown DL,et al.N-[[(5-methyl-3-phenylisoxazol-4-yl)-phenyl]sulfonyl]propanamide,sodium salt,parecoxib sodium:A potent and selective inhibitor of COX-2 for parenteral administration[J].JMed Chem,2000,43(9):1661-1663.
[7]Malek HA,Saleh DM.Cyclooxygenase-2 inhibitor celecoxib in a ratmodel of hindlimb ischemia reperfusion[J].Can J Physiol Pharmacol,2009,87(5):353-359.
[8] Shinmura K,Kodani E,Xuan YT,et al.Effect of aspirin on late preconditioning against myocardial stunning in conscious rabbits[J].J Am Coll Cardiol,2003,41(7):1183-1194.
[9]FitzGerald GA,Patrono C.The coxibs,selective inhibitors of cyclooxygenase-2[J].N Engl JMed,2001,345(6):433-442.
