卵子玻璃化冷冻技术在IVF-ET中的应用(附7 例报告)
2013-02-24王长华朱元伍琼芳辛才林赵琰
王长华,朱元,伍琼芳,辛才林,赵琰
(江西省妇幼保健院生殖中心,南昌330006)
自1986 年澳大利亚Chen[1]首次报道用冷冻卵子进行体外受精(IVF)并成功妊娠后,玻璃化冻融技术及胞浆内单精子注射(ICSI) 很大程度上为卵子冷冻解决了困难, 大大提高了冷冻卵子的复苏率及受精率。 胚胎的玻璃化冷冻技术已经很成熟[2,3],而卵子的玻璃化冷冻还在摸索阶段。实际上卵子冷冻比胚胎冷冻有更广泛的应用前景。 卵子冷冻为建立卵子库提供可行性, 可有效储备妇女生育力, 对于因卵巢功能早衰、盆腔疾病、手术或放、化疗等而可能丧失卵巢功能的女性是保存其生育力的一种手段。 此外, 卵子冷冻可缓解胚胎冷冻面临的伦理、法律、道德、宗教等多方面问题。 建立卵母细胞库,为少卵、无卵、卵巢早衰等妇女提供卵子等[4-6], 是生殖领域的研究热点。尤其在IVF-ET 中,面对未预期的取精失败、睾丸活检无精子,发生在经促超排卵已采集到卵母细胞时, 冷冻卵母细胞可作为一种补救手段。 现回顾性分析2011 年1 月-2012 年12 月体外受精周期中16 对不孕不育夫妇因取卵日男方未预期的取精失败、 睾丸取精失败或者男方无法到场等各种原因无法行体外受精而接受卵子冷冻的周期。 及其中7 对不孕不育夫妇随后行卵子解冻及ICSI-ET 周期的胚胎发育及临床结局, 从而探讨卵子玻璃化冷冻技术在体外受精周期中临床应用的可行性。
1 资料和方法
1.1 研究对象 江西省妇幼保健院生殖中心2011年1 月-2012 年12 月实施体外受精-胚胎移植周期(in vitro fertilization-embryo transfer, IVF-ET)取卵日因男方取精困难行睾丸取精失败或者男方无法到场等各种原因无法行体外受精而接受卵子冷冻的16 对不孕症夫妇。冻卵者临床资料:女性年龄24-41(31.9±5.7)岁,不孕年限(4.5±3.1)年。 月经第3d FSH 值为(9.2±11.9) IU/L, LH 为(4.2±1.9) IU/L,E2为(43.8±19.5) pg/L。
1.2 超长方案 于月经第2d 肌肉注射长效达菲林(天津-益普生公司,下同)3.75mg, 28-35d 后,达到降调标准后启动GN 治疗(果纳芬,默克雪兰诺),启始剂量为75-112.5U, 视卵巢反应调整GN 量,直至HCG 注射日止。
1.3 常规长方案 患者于黄体中期监测排卵后7d根据基础窦卵泡数及基础内分泌水平给予长效达菲林1.1-1.25mg 单次肌肉注射或达必佳0.1mg/d皮下注射进行垂体降调节; 排卵障碍者于月经第3d 始给予妈富隆(每片含去氧孕烯0.15mg、炔雌醇0.03mg,荷兰欧加侬)1 片/d, 16d 后根据卵巢储备情况用同样方法降调。 于月经第3d 行B 超及内分泌检查,若垂体完全降调节,根据患者年龄、BMI、卵巢储备、 前次卵巢反应情况给予适当剂量FSH 启动超排卵治疗, 必要时联用HMG, 直至HCG 注射日止。
患者于启用Gn5d 后每日或隔日行阴式B 超检查监测卵泡发育情况,同时监测血清LH、E2及P水平, 当至少有1 个卵泡直径≥20mm 或2 个卵泡直径≥19mm 时于当晚给予HCG(艾泽,瑞士雪兰诺公司)250μg 皮下注射, 36h 后在阴道B 超引导下取卵。
1.4 经皮睾丸精子抽吸术(testicular sperm aspiration,TESA)+开放性睾丸精子分离术(testicular sperm extraction,TESE) 术前签署知情同意书。2%利多卡因7ml 行精索浸润局部麻醉,如TESA 取精失败,再行TESE。 具体步骤如下:术者一手紧握固定睾丸,切开阴囊各层,随机选择不同部位黄色饱满的曲细精管,若获取组织不理想,可剖开睾丸内组织,但深度不超过0.5cm。分离组织后倒置显微镜下观察,如无精子同法采取对侧。 双侧均不能采到精子时,应留取组织标本,日后观察组织学改变。 以1 号丝线间断缝合,术后应用抗生素。 签署冻卵知情同意书(包括可能出现的低存活、低受精及低妊娠率等风险)。
1.5 卵子玻璃化冷冻及解冻 卵子冷冻在取卵后2 h 进行, 将卵冠丘复合物(cumulus-ocyte complexs,COCs)经60IU/ml 透明质酸酶(Sigma 公司)40 s 去除颗粒细胞。 卵子玻璃化冷冻:采用vitrolife 玻璃化冷冻试剂盒行玻璃化冷冻。 准备1 个四孔板,按顺序每孔加入0.5ml 冷冻1 液、冷冻2 液、冷冻3 液,并将盛有冷冻液的四孔板预热至37℃。 整个冷冻过程在37℃的热台上进行。 先将卵子置入冷冻1 液5-10min, 再转入冷冻2 液2min, 在冷冻2液中卵子会漂浮起来,反复吹打让其尽快沉下去。在冷冻2 液中还剩10s 时,开始将卵子转入冷冻3液,30s 内将卵子载入冷冻麦管并浸入液氮。 卵子玻璃化解冻:采用vitrolife 玻璃化解冻试剂盒行玻璃化解冻。 准备1 个四孔板,按顺序每孔加入1ml解冻1 液、解冻2 液、解冻3 液和解冻4 液,并将盛有解冻液的四孔板预热至37℃。 整个解冻过程在37℃的热台上进行。 将载有卵子的麦管从液氮中取出后快速将卵子置入解冻1 液,30s 内用吸管抓取卵子并转入解冻2 液,放置1min 后转入解冻3 液,放置2min 后转入解冻4 液,并在4 液中平衡5min。
1.6 体外受精及胚胎移植 以有正常细胞质结构、透明带完整、卵周间隙小为卵子存活标志。孵育2h后倒置显微镜下观察。 仅将有明显第一极体的成熟卵子行ICSI 受精, 16-18h 后观察受精;以出现雌雄原核(2 pronucleus, 2PN)为正常受精标志。 随后将正常受精的卵子转移到专用的卵裂培养基中培养,培养约48h、72h 时均显微镜下观察胚胎。 72h时细胞数在7-9 个细胞之间,卵裂速度正常、卵裂球大小均一或大致均一、碎片≤20%、胞浆饱满,质地均匀或大致均匀的胚胎定为优质胚胎, 挑选优质胚胎2-3 枚移植,剩余有价值胚胎冷冻,没有冷冻价值的胚胎行囊胚培养, 养成的有价值的囊胚行玻璃化冷冻。 移植后14d 测尿和血清HCG 阳性为生化妊娠, 35dB 超检查妊娠囊和胎心搏动情况,确定临床妊娠。
1.7 实验数据计算标准 存活率=存活卵子数/冷冻卵子数×100%; 正常受精率=2PN 卵子数/成熟卵子数×100%; 优胚率=优胚数/正常受精卵卵裂总数×100%;种植率=孕囊数/移植胚胎数×100%;移植周期率=移植周期数/解冻周期数×100%;临床妊娠率=妊娠周期数/移植周期数×100%。 计量资料以(±s)表示,计数资料以率(%)表示。
2 结果
2.1 卵子复苏后的临床结局 16 例患者接受卵子冷冻,共冷冻卵子167 枚,7 例患者接受卵子解冻,共解冻卵子86 枚, 其中存活66 枚, 存活率为76.7%(66/86);其中66 枚成熟卵子行ICSI 受精,正常受精率为68.2%(45/66),卵裂率为91.1%(41/45),优质胚胎率为14.6%(6/41);1 例患者因胚胎差取消移植,12 枚胚胎移植给6 例患者, 平均移植胚胎数为(2.0±0.6)个。 (见表1)。 种植率为16.7%(2/12)。 3 例患者生化妊娠,生化妊娠率为50%(3/6)2 例患者获得了临床妊娠,临床妊娠率为33.3% (2/6),其中1例患者已足月顺利分娩1 女婴, 体重为3.15kg,发育均正常,另1 例孕中期流产。
2.2 胎儿出生情况 2 例患者获得了临床妊娠,均为宫内单活胎,其中1 例患者孕39+5周顺利分娩1女婴,体重为3.15kg,发育均正常,另1 例患者孕中期自然流产。
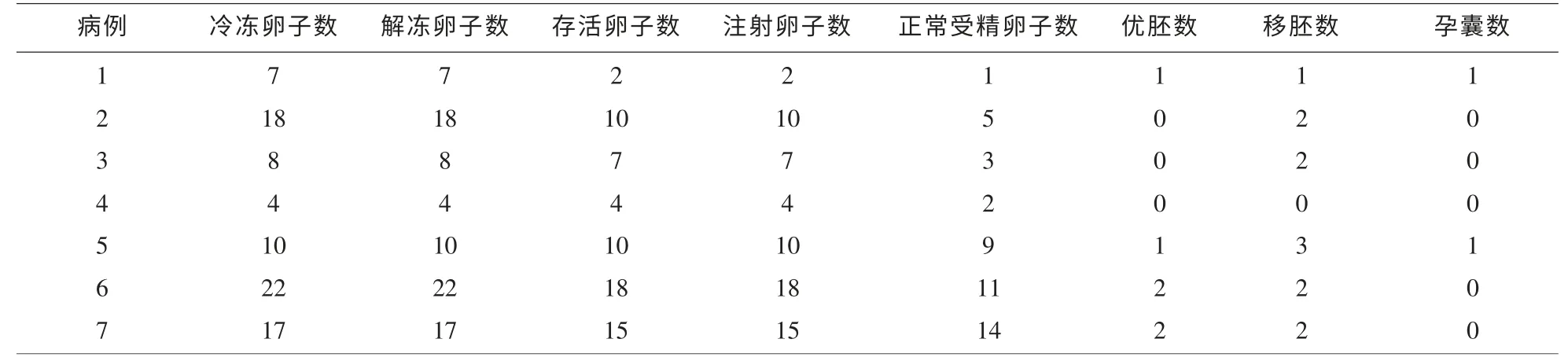
表1 卵子冻融后ICSI-ET的受精、胚胎及妊娠情况(n)
3 讨论
在辅助生育技术中,未预期的取精失败、睾丸活检无精子,发生在经促超排卵已采集到卵母细胞时,冷冻卵母细胞可作为一种补救手段。 人卵母细胞由于体积大,胞质内精细的结构,特别是纺锤体对冷冻敏感,冷冻后透明带硬化将影响精子穿入等因素,因不同于胚胎及精子而冻融困难。 玻璃化冷冻采用高浓度的细胞内冷冻保护剂,使细胞迅速脱水, 投入液氮后使细胞内物质形成透明玻璃样状态, 避免慢速冷冻过程中冰晶形成所引起的损伤,可提高卵母细胞冷冻存活率。 稳定成熟的卵子冷冻技术是临床应用的前提。
近年来卵子玻璃化冷冻获得了较好的妊娠结局, 已有若干妊娠胎儿出生的报道[7-9], 但是其临床应用国内外报道有限, 临床可行性尚需大样本证实。 本文中16 例患者接受卵子冷冻,共冷冻卵子167 枚,7 例患者接受卵子解冻, 共解冻卵子86枚,其中存活66 枚,存活率为76.7%;其中66 枚成熟卵子行ICSI 受精,正常受精率为68.2%,卵裂率为91.1%,优质胚胎率为14.6%;1 平均移植胚胎数为(2.0±0.6)个。 种植率为16.7% 。 3 例患者生化妊娠, 生化妊娠率为50%2 例患者获得了临床妊娠,临床妊娠率为33.3% (2/6),其中1 例患者已足月顺利分娩1 女婴,另1 例孕中期流产。 取得了较好的解冻复苏率及临床妊娠率, 与文献报道的冷冻卵子和新鲜精子受精的结果一致[10]。本研究表明我中心卵子冷冻技术成熟稳定, 可以较好的在临床应用, 卵子解冻后行ICSI 可以作为未预期的取精困难、 睾丸取精失败及其他原因取卵日男方不能到场患者的一种临床补救措施。 随着科学发展,通过卵子冷冻技术及卵子库的建立,使用女性生殖能力的储备成为可能。
[1]Chen C. Pregnancy after human oocyte cryopreservation[J].Lancet,1986,1(8486):884-886.
[2]丁涛,黄志辉,辛才林,等.玻璃化冻融胚胎临床妊娠成功1 例报道[J].江西医药,2010,45(11):1117.
[3]聂玲,伍琼芳,曾韩,等.激光辅助孵化在反复种植失败及冻融胚胎移植患者中的应用[J].江西医药,2012,47(1):1.
[4]Antinori M, Licata E, DaniG,et al. Cryotop vitrification of human oocytes results in high survival rate and healthy deliveries[J]. Reprod Biomed Online, 2007, 14(1): 72-79.
[5]Selman H, Angelini A, Barnocchi N, et al. Ongoing pregnancies after vitrification of human oocytes using a combined solution of ethylene glycol and dimethyl sulfoxide [J]. Fertil Steri,2006, 86(4):997-1000.
[6]Barritt J, Luna M, Duke M, et al. Report of four donor recipient oocyte cryopreservation cycles resulting in high pregnancy and implantation rates[J]. Fertil Steril,2007, 87(1): 189. e13-17.
[7]Polak de,Fried E. Pregnancy after human donor oocyte cryopreservation and thawing in association with intracytoplasmic sperm injection in a patient with ovarian failure [J]. Fertil steril, 1998, 69(3):555-557.
[8]Chen GA, Cai XY, Lian Y,et al. Normal birth from cryopreserved embryos after intracytoplasmic sperm injection of frozen semen into vitrified human oocytes. Hum Fertil(camb), 2008, 11(1): 49-51.
[9]Tjer GC, Chiu TTY, Cheung LP, et al. Birth of a healthy baby after transfer of blastocysts derived from cryopreserved human oocytes fertilized with frozen spermatozoa [J]. Fertil Steril, 2005, 83(5):15471-15479.
[10]Homburg R, Veen F, Silber SJ. Oocyte vitrification women’s emancipation set in stone. Fertil Steri-l 2009, 91 (4 Suppl): 1319-1320.
