杨凌番茄黄化曲叶病毒外壳蛋白基因的克隆与其核心序列分析
2013-02-24李云洲王巧丽
李云洲 梁 燕 王巧丽 李 翠 崔 霞 秦 蕾
(西北农林科技大学园艺学院,陕西杨凌 712100)
番茄黄化曲叶病毒(Tomato yellow leaf curl vius,TYLCV)属于双生病毒科(Geminiviruses)菜豆金色花叶病毒属(Begomoviruses),能侵染6科13种植物(Cohen & Nitzany,1966;Cohen et al.,1995;Navas-Castillio et al.,1999;Sánchez-Campos et al.,1999,2000;Ji et al.,2012),主要通过烟粉虱传播(Cohen & Antignus,1994;Gafni,2003),感病植株表现明显矮化,叶缘黄化,叶片变小并卷曲,以植株上部幼嫩叶片症状典型,严重危害番茄生长、开花和坐果,导致毁灭性绝产。该病于20世纪50年代末始发于以色列,20世纪90年代以来,由于全球气候变暖和烟粉虱的空前扩展,该病害在40 多个国家大面积暴发并逐年加重,目前,该病已成为威胁世界番茄生产的主要因素之一(Czosnek & Laterrot,1997)。由于双生病毒为单链DNA 病毒,存在基因重组现象,病毒变异频率高,越来越多的此类病毒在世界各地被分离出来。
迄今为止,世界各地已经相继报道了几十个分离物全序列,根据分离物地区不同可分为:TYLCV-Is(以色列番茄黄化曲叶病毒),TYLCV-Sar(撒丁番茄黄化曲叶病毒),TYLCV-Th(泰国番茄黄化曲叶病毒),TYLCV-Ye(也门番茄黄化曲叶病毒),TYLCV-Ch(中国番茄黄化曲叶病毒),TYLCV-Ng(尼日利亚番茄黄化曲叶病毒),TYLCV-Tz(坦桑尼亚番茄黄化曲叶病毒),TYLCV-SSA(沙特阿拉伯番茄黄化曲叶病毒)等(Moriones & Navas-Castillo,2000)。目前,该病已遍布我国各主要番茄主产区,引起该病的病毒也发生不同程度的变异。
因此有必要将我国番茄黄化曲叶病分离物进行鉴定、分类,CP基因的同源性是病毒株系划分主要的依据之一(Padidam et al.,1999),本试验通过克隆我国陕西杨凌(中国农业高新技术产业示范区)地区番茄作物上的TYLCV 外壳蛋白基因,对其核心序列tCP进行测序和同源性分析,并且根据核酸同源性进行分类,以期为番茄黄化曲叶病抗病育种提供分子生物学依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 试验于2011年8月~2012年7月在西北农林科技大学园艺学院番茄种质创新实验室进行,选取陕西杨凌地区感病番茄植株生长点及上部幼嫩叶片,锡箔纸包裹后置液氮冷冻5 min后冻于-80℃超低温冰箱中保存备用。
1.1.2 载体与菌株 pMD18-T 购于大连宝生物公司。大肠杆菌(Escherichia coli)感受态DH5α 购自天根生化公司(北京)。
1.2 方法
1.2.1 总DNA 的提取 采用改良CTAB 法提取番茄植株总DNA(Yan et al.,2008)。
1.2.2 引物设计及扩增 双生病毒特异引物(吴剑柄,2008)、CP基因及tCP引物序列见表1。PCR 反应体系为50 μL:20 μL ddH2O+20 μL MiX+2 μL PA+2 μL PB+6 μL DNA 模板。反应条件:94℃预变性3 min;94℃变性30 s,54℃退火30 s,72℃延伸30 s,35个循环;4℃保存,PCR 产物经琼脂糖凝胶电泳检测,然后进行回收纯化(Bio Kete 琼脂糖凝胶回收试剂盒),用于下一步反应。
1.2.3 PCR 产物的克隆与测序 由高保真Pfu聚合酶扩增得到PCR 产物纯化后,用A-tailing 试剂盒加A 尾与pMD18-T 载体连接成pMD18-T+tCP(Pfu聚合酶 pMD18-T 以及A-tailing 试剂盒均购于沃尔森生化试剂公司),参照萨布鲁克等(1999)所述的热激法将此连接质粒转化到大肠杆菌DH5a 感受态细胞中,重组子经鉴定后送上海桑尼生物科技有限公司测序。

表1 用于PCR 扩增和测序的引物序列
1.2.4 序列分析与同源性比较 采用DNAstar 中MegAlign 软件的ClustalW 方法,将TYLCVCP核心序列tCP进行同源性分析,构建系统进化树。在http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopm.html 网址完成对tCP序列二级结构的分析。
2 结果与分析
2.1 分离物的初步鉴定
根据吴剑柄(2008)的双生病毒特异引物PA、PB 进行PCR 扩增,得到500 bp 左右的双生病毒特异产物(图1),初步断定所得到的杨凌分离物为双生病毒,根据其田间发病特征:叶片褪绿黄化、变小,叶缘皱缩,叶片增厚,叶质变硬,番茄植株矮化生长停滞,推断该病毒为番茄黄化曲叶病毒引起,暂时命名该病毒分离物为TYLCV-Yl(GenBank 序列号:KC293824)。
2.2 TYLCV-Yl 外壳蛋白全序列的克隆与测序
为了保证目的片段扩增和测序的准确性,设计引物时在目的片段CP5′和3′端分别延伸350 bp 左右,克隆出的目的片段为1 400 bp(图2),TYLCV-Yl 外壳蛋白全基因序列如图3,ATG为起始序列,TAA 为终止序列,共计777个核苷酸。该序列与NCBI 中以色列番茄黄化曲叶病毒序列(X15656)基因同源性高达97%。
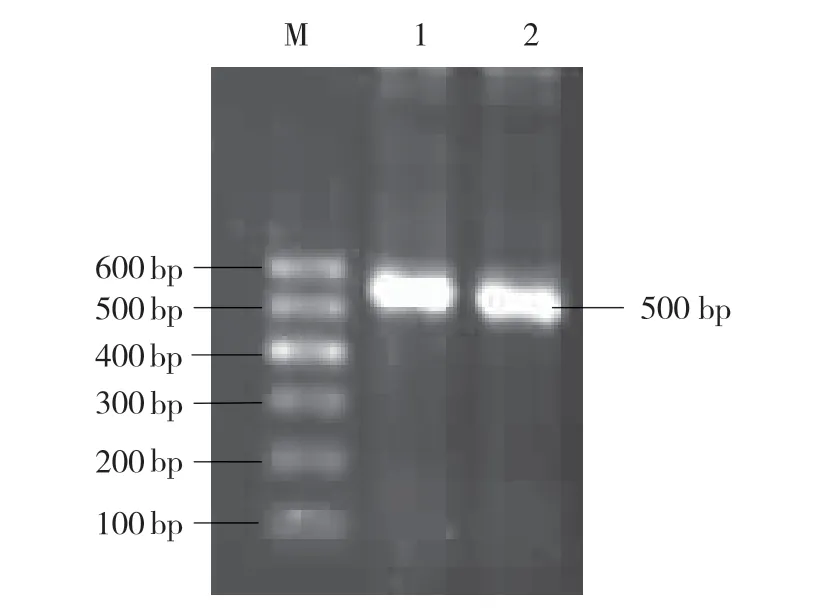
图1 TYLCV-YL 的初步PCR 鉴定结果

图2 TYLCV-Yl CP PCR 产物扩增结果
2.3 基于CP 蛋白核苷酸序列多重比较
图4是基于CP蛋白基因的核苷酸序列多重比较结果,可见编码CP蛋白基因的5′端高度保守,19个TYLCV 的起始密码均为ATG,起始密码之后最长的连续保守序列为TCATTTCCAC。
2.4 TYLCV-Yl 外壳蛋白核心序列tCP 的克隆

图3 杨凌番茄黄化曲叶病毒外壳蛋白全基因序列
利用引物tCP-F 和tCP-R 进行PCR 扩增,得到1条420 bp 左右的片段(tCP)(图5),1~5 点样孔为同一植株毒源PCR 产物。回收产物进行再次验证(图6),显示克隆结果良好。使用Dnstar 软件分析tCP,其包含1个开放性阅读框,编码137个氨基酸(图7)。
2.5 tCP 序列特征分析
核苷酸序列同源性比对结果表明,本试验克隆的TYLCV-YlCP基因与NCBI 中的18个TYLCV 病毒序列的同源性如表2所示。如图4所示该tCP基因序列5′端在诸多TYLCV 核酸序列中非常保守。
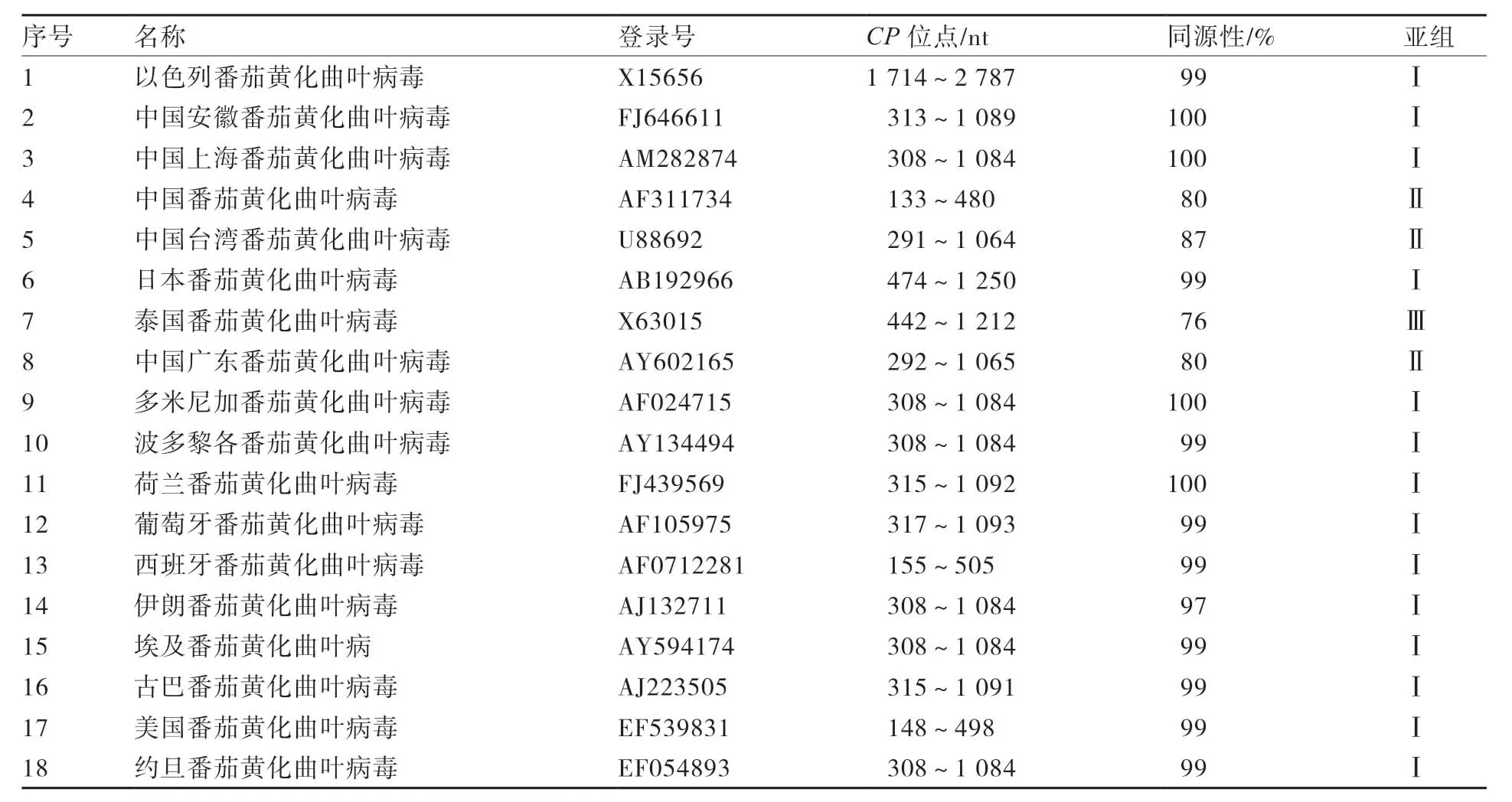
表2 NCBI 中18个TYLCV 登录号及其CP位点

图4 19个TYLCV 的tCP 基于核苷酸序列的多重比对结果

图5 tCP基因片段PCR 扩增结果
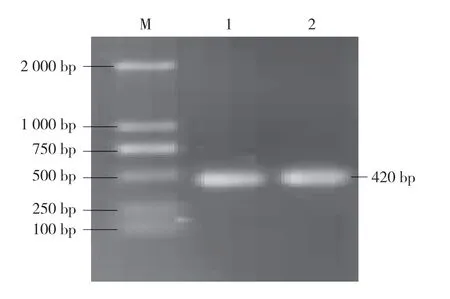
图6 tCP 回收产物PCR 验证结果

图7 杨凌番茄黄化曲叶病毒外壳tCP片段序列及推测氨基酸序列
tCP核苷酸序列中GC含量为46.28%,预测蛋白分子量为15 813.83 D,等电点为11.336。跨膜分析结构显示(图8):tCP具有1个跨膜结构,该跨膜结构位于79~97个氨基酸之间。

图8 tCP 蛋白跨膜区的预测结果
2.6 系统进化树分析
将tCP基因序列与NCBI 中已登录的18种TYLCV 的CP蛋白构建进化树(图9),这19个TYLCV CP蛋白序列可以明显的分为3个亚组:亚组Ⅰ,亚组Ⅱ,亚组Ⅲ。亚组Ⅰ同源性>90%,亚组Ⅱ同源性>80%,亚组Ⅲ同源性>70%。说明CP在TYLCV 进化过程中保守性非常强。其中tCP基因序列被归为亚组Ⅰ。由本试验结果可知,中国番茄黄化曲叶病由两个病毒亚组引起,即TYLCV 亚组Ⅰ和TYLCV 亚组Ⅱ。

图9 基于CP基因序列构建的分离物TYLCV-YL 与其他株系的系统树
3 结论与讨论
本试验将番茄黄化曲叶病毒划分3个亚组,中国境内番茄黄化曲叶病毒有2个亚组,即TYLCV 亚组Ⅰ和TYLCV 亚组Ⅱ。其中TYLCV 亚组Ⅰ中的TYLCV-Is(以色列)TYLCV 和TYLCV-Sar(意大利撒丁地区)是最早分离并且报道其全基因序列的(Kheyr-Pour et al.,1991;Navot et al.,1991)。随后越来越多的TYLCV 分离物的全基因组序列被公布。经过序列比较分析,发现侵染番茄的一系列Begomoviruses病毒亲缘关系或近或远,仅用TYLCV 对这类复杂的病毒进行命名明显已不恰当了。国际病毒分类委员会将双生病毒科病毒全基因组核苷酸序列同源率小于90% 的往往定名为不同病毒(Regenmortel & Fauquet,2000),因此本试验的TYLCV病毒划分是有科学依据的。而且本试验将亚组用于区分当前众多的TYLCV 分离物,并不是先例,Palukaitis 等(1992)、Rizos 等(1992)曾将亚组用于区分同CMV 病毒的纵多分离物,这样根据病毒核酸序列的同源性将TYLCV 划分成3个亚组不仅可以明白诸多TYLCV 病毒的进化关系,也有利于针对相应病毒展开防治工作。
本试验结果可知,中国番茄黄化曲叶病由两个病毒亚组引起,即TYLCV 亚组Ⅰ和TYLCV亚组Ⅱ,杨凌番茄黄化曲叶病毒(TYLCV-Yl)属于以色列番茄黄化曲叶病毒株系。一方面说明地源近的番茄黄化曲叶病可能由同一病毒亚组引起,如台湾番茄黄化曲叶病毒和广东番茄黄化曲叶病毒均属于TYLCV 亚组Ⅱ,另一方面也证明番茄黄化曲叶病毒在中国境内传播过程中确实存在变异。
除此之外,应该加强对中国境内其他TYLCV-CP蛋白的研究,以期为抗病育种提供分子生物学依据。Abel 等(1986)首次将烟草花叶病毒(TMV)外壳蛋白基因转入烟草并成功的获得了抗烟草花叶病毒TMV 侵染的转基因植株。到目前为止,这一技术已成功应用在十几个属30余种病毒上。同时CP蛋白作为病毒的结构基础由ORFν1编码,Gafni 和Epel(2002)发现番茄黄化曲叶病毒外壳蛋白(TYLCV-CP)对于病毒的侵染和移动是非常必要的。Noris 等(1996)也发现TYLCSV(撒丁番茄黄化曲叶病)CP突变体可以干扰病毒的侵染。而本试验对TYLCVYlCP核心序列tCP进行分析,因为tCP有一个跨膜结构,一旦该片段缺失,将影响到病毒结构的完整性,以至于影响其功能,因此通过抑制番茄黄化曲叶病毒外壳蛋白(CP)基因核心序列tCP的表达,以阻止病毒在植物体内继续组装、扩繁,达到抗病的作用。
吴剑柄.2008.我国五种双生病毒的分子鉴定及致病性研究〔博士论文〕.杭州:浙江大学.
萨布鲁克J,弗里克E F,曼尼阿蒂斯T.1999.分子克隆指南.北京:科学出版社.
Abel P P,Nelson R S,De B,Hoffmann N,Rogers S G,Frakey R T,Beachy R N.1986.Delay of disease development in transgenic plants that express theTobacco mosaic viruscoat protein gene.Science,232(4751):738-743.
Cohen S,Antignus Y.1994.Tomato yellow leaf curl virus,a whitefly-borne geminivirus of tomatoes.Advances in disease vector research,10:259-288.
Cohen J,Gera A,Ecker R,Ben J R,Perlsman M,Gokkes M,Lachman O,Antlgnus Y.1995.Lisianthus leaf curl-a new disease of lisianthus caused byTomato yellow leaf curl virus.Plant Disease,79(4):416-420.
Cohen S,Nitzany F E.1966.Transmission and host range of theTomato yellow leaf curl virus.Phytopathology,56(10):1127-1131.
Czosnek H,Laterrot H.1997.A worldwide survey ofTomato yellow leaf curlviruses.Arch Virol,142(7):1391-1406.
Gafni Y,Epel B L.2002.The role of host and viral proteins in intra-and inter-cellular trafficking of geminiviruses.Physiological and Molecular Plant Pathology,60(5):231-241.
Gafni Y.2003.Tomato yellow leaf curl virus,the intracellular dynamics of a plant DNA virus.Molecular plant pathology,4(1):9-15.
Ji Y H,Cai Z D,Zhou X W,Liu Y M,Xiong R Y.2012.First report ofTomato yellow leaf curl virusin common bean in China.Plant Disease,96(8):1229-1230.
Kheyr-Pour A,Bendahmane M,Matzeit V,Accotto G P,Crespi S,Gronenborn B.1991.Tomato yellow leaf curl virusfrom sardinia is a whitefly-transmitted monoparatite geminivirus.Nucleic acids research,19(24):6763-6769.
Moriones E,Navas-Castillo J.2000.Tomato yellow leaf curl virus,an emerging virus complex causing epidemics worldwide.Virus Res,71(1-2):123-134.
Navas-Castillo J,Sánchez-Campos S,Antonio Diaz J,Moriones Enncue.1999.Tomato yellow leaf curlvirusiscauses a novel disease of common bean and severe epidemics in tomato in Spain.Plant Disease,83(1):29-32.
Navot N,Pichersky E,Zeidan M,Zamir D,Czosnek H.1991.Tomato yellow leaf curl virus:a whitefly-transmitted geminivirus with a single genomic component.Virology,185(1):151-161.
Noris E,Accotto G P,Tavazza R,Brunetti A,Crespi S,Tavazza M.1996.Resistance toTomato yellow leaf curl geminivirusinNicotiana benthamianaplants transformed with a truncated viral C1 Gene.Virology,224(1):130-138.
Padidam M,Sawyer S,Clande M F.1999.Possible emergence of new geminiviruses by frequent recombination.Virology,265(2):218-225.
Palukaitis P,Roossinck M J,Dietzgen R G,Francki Richard L B.1992.Cucumber mosaic virus.Adv Virus Res,41(2):281-341.
Regenmortel M H V,Fauquet C M.2000.Virus taxonomy:classification and nomenclature of viruses.Seventh report of the International Committee on Taxonomy of Viruses.Waltham:Academic Press.
Rizos H,Gunn L V,Pares R D,Gillings M R.1992.Differentiation ofCucumber mosaic virusisolates using the polymerase chain reaction.Journal of General Virology,73:2099-2103.
Sánchez-Campos S,Navas-Castillo J,Camero R,Soria C,Diaz A,Moriones E.1999.Displacement ofTomato yellow leaf curl virus(TYLCV)-Sr by TYLCV-Is in tomato epidemics in Spain.Phytopathology,89(11):1038-1043.
Sánchez-Campos S,Navas-Castillo J,Monci F,Diaz J A,Moricnes E.2000.Mercurialis ambigua andSolanum luteum:two newly discovered natural hosts ofTomato yellow leaf curl geminiviruses.European Journal of Plant Pathology,106(4):391-394.
Yan Miaomiao,Wei Guangcheng,Pan Xiaohong,Ma Huailei,Li Weizhen.2008.A method suitable for extracting genomic DNA from animal and plant-modified CTAB method.Agricultural Science & Technology,9(2):39-41.
