放疗增强对转染p Ad KDR/CD/TK自杀基因系统的SW480大肠癌细胞的杀伤作用
2013-02-24刘志毅翟春亮
刘志毅,金 虎,翟春亮,刘 明
(吉林大学第四医院 普通外科,吉林 长春 130011)
目前对大肠癌的治疗,除了外科手术、化疗和放疗外,生物治疗成为研究热点,其中基因治疗研究较多,而自杀基因最为深入。所谓自杀基因就是药物敏感基因,能够将无毒的药物前体在体内转变成有毒的药物杀死肿瘤细胞。该疗法不但能直接杀伤转基因的肿瘤细胞,还可利用其独特的“旁观者效应”杀伤周围大量未转基因的瘤细胞。放射治疗是通过辐射诱导肿瘤细胞原发损伤或者细胞凋亡,从而导致肿瘤细胞的死亡。在放疗过程中,射线不但杀死肿瘤细胞,同时也会对周围正常组织造成损害,而且会随着剂量的增加而加大。研究表明,放射线可以增加基因的转染率[1,2],增强基因的稳定表达;而自杀基因可以增加肿瘤的放射敏感性[3]。自杀基因联合放疗治疗肿瘤,目前以单自杀基因研究较多,而对双自杀基因的研究刚刚开始,还比较少。本实验用以构建的p KDR-CD/TK融合基因,联合γ射线,进一步探索双自杀基因与放疗对大肠癌SW480细胞的杀伤协同作用。
1 材料与方法
1.1 主要试剂
重组腺病毒(recombinant adenovirus with KDR promoder,p Ad Easy-KDR-CD p Ad Easy-KDR-TK p Ad Easy-KDR-CDgly TK)由吉林大学普通外科实验室构建。DMEM、RPMI 1640、MTT、小牛血清(Gibco公司);转染试剂PolyFect(Qiagen公司);GCV (Roche Pharma 公司),5-FC(Sigma公司)。
1.2 SW480细胞的培养
①于15 ml锥形试管内加入10 ml PRMI1640细胞生长液。②37℃水浴处理冰冻SW480细胞小瓶40-60 s,并轻轻摇动之,室温下,体积分数70%乙醇浸泡去除污染。③将细胞悬液加入含10 ml PRMI 1640细胞生长液的15 ml锥形试管内,(200×g)离心,5 min,吸除细胞生长液,加入5 ml新鲜细胞生长液。④组织培养瓶,内含新鲜PRMI 1640细胞培养液10 ml,将细胞悬液5 ml加入其中,体积分数5%CO2,37℃孵育;当细胞达到70%汇合时行1∶3传代。⑤吸除PRMI 1640细胞培养液,用磷酸盐缓冲溶液(PBS)10 ml清洗细胞,用Tyrosine-EDTA 1 ml消化3 min。⑥用新鲜PRMI 1640细胞生长液8.5 ml灭活Tyrosine,将细胞悬液1 ml加入培养瓶内,在加入新鲜PRMI 1640细胞液9 ml,在体积分数5%CO2,37℃下孵育。⑦细胞70%汇合时传代。
1.3 p Ad Easy-CDglyTK,p Ad Easy-KDR-CDglyTK重组腺病毒的转染
先将2份3×105LOVO细胞分别接种于2个10 ml培养皿中,体积分数5%CO2,37℃培养过夜,再分别加入10μl重组腺病毒p Ad Easy-CDgly TK p Ad Easy-KDR-CDgly TK 终 质 量 浓 度 为 mg/L,37℃,体积分数5%CO2培养6 h。之后更换新鲜PRMI 1640细胞培养液,体积分数5%CO2,37℃培养24 h。荧光显微镜下观察转染效果。
1.4 γ射线对重组腺病毒的SW480细胞感染率的影响
取对数生长期的SW480细胞,以1×104/孔的浓度接种于96孔培养板,体积分数5%CO2,37℃培养过夜,待细胞丰度达约90%,加入不同感染复数(multiplicity of infection,MOI)的目的腺病毒(分别加入10、20、50、100、200、300MOI),加少许培养基振荡2-3 h后,补足培养基继续在37℃、5%CO2孵箱内培养,分别用γ射线照射,剂量为1.0Gy,每日照射1 h,分为照射组与对照组,3 d后在荧光显微镜下计数GFP阳性细胞百分比。
1.5 60 Coγ射线对转染重组腺病毒的SW480细胞的杀伤增敏作用
1.5.1 取对数生长期的转染 p Ad KDR/CD/TK SW480细胞,及对照组SW480细胞(未做任何处置),以2×105/L,接种于96孔板上,每组设3个复孔。共分4组:
γ射线的照射的剂量分别为0、0.2、0.5、0.8、1.0、1.5Gy,GCV浓度为10 mg/l,5-FC浓度为100 mg/l,GCV+5-FC浓度为10 mg/l+100 mg/l。然后于37℃、5%CO2培养箱内静止培养,4 d后MTT法计算细胞生长抑制率。
1.5.2 取对数生长期的转染p Ad KDR/CD/TK,p Ad KDR/CD,p Ad KDR/TK 的SW480细胞,及对照组SW480细胞(未做任何处置),以2×105/L,接种于96孔板上,每组设3个复孔。共分8组:γ射线的照射的剂量分别为1.0,GCV浓度为10、20、40、60、和100 mg/l;5-FC浓度为:100、200、400、600和1 000 mg/l;GCV+5-FC浓度为:10+100、20+200、40+400、60+600和100+1 000 mg/l。,然后于37℃、5%CO2培养箱内静止培养,4 d后 MTT法计算细胞生长抑制率。
1.6 细胞克隆形成实验检测γ射线增敏作用
将转染p Ad KDR/CD/TK的SW480细胞用胰酶消化,使细胞呈单个悬浮于培养液中。单个细胞百分率在95%以上,将1×105的细胞接种于6孔板中 ,实验分为4组:① 对照组;② 单纯用药组(GCV浓度1μg/ml+5-FC10 g/ml);③ 单纯照射组,给予Coγ射线照射,吸收剂量为400cGy;④ 联合治疗组:先加入1μg/mlGCV+5-FC10 g/mlG处理,后进行照射,吸收剂量为400cGy,置37℃、5%CO2培养箱培养14 d,用PBS小心清洗2遍,空气干燥,甲醇固定15 min,Giemsa染色15 min,流水缓慢洗去染液,再空气干燥,显微镜下计数大于50个细胞的克隆。然后按下式计算克隆形成率:克隆形成率(%)=(克隆数/接种细胞数)×100%;相对克隆形成率(%)=(照射组克隆形成/对照克隆形成率)×100%。
1.7 统计方法
实验数据用SPSS11.5软件处理,采取独立样本t检验和单因素方差分析,组间比较用SNK法。
2 结果
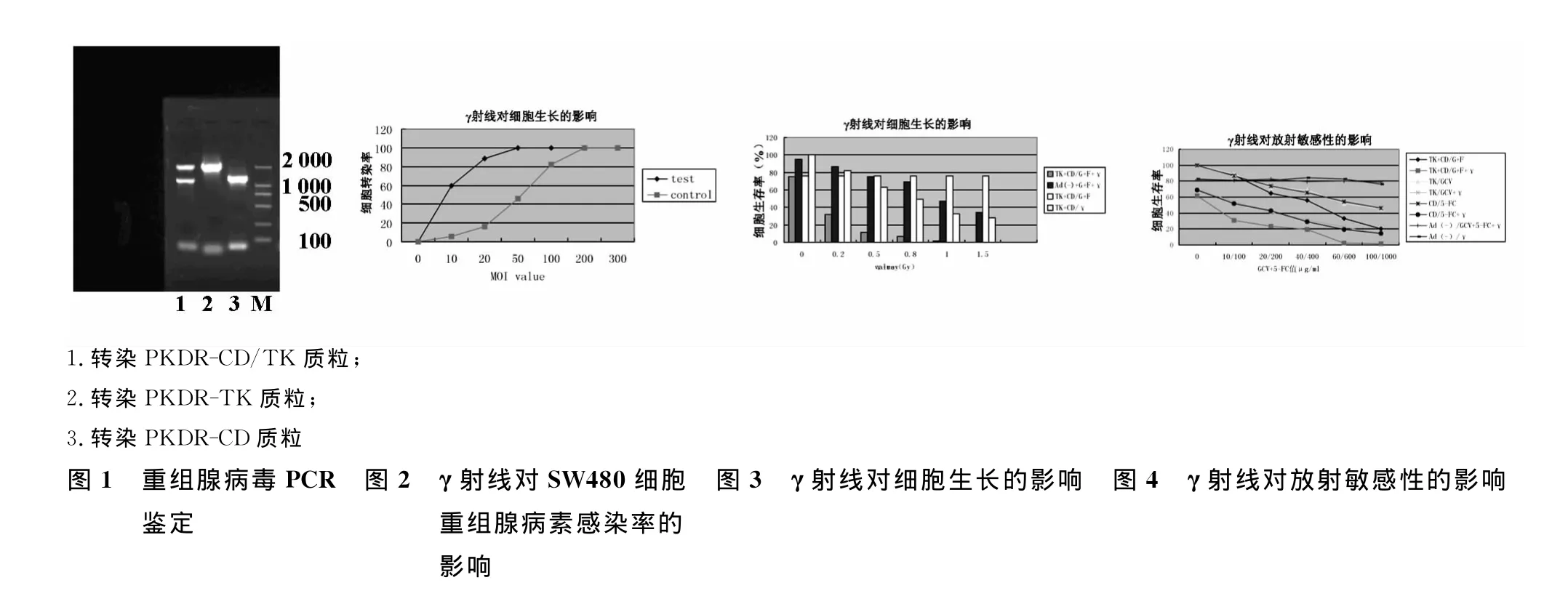
2.1 重组腺病毒的PCR鉴定
重组质粒经PCR鉴定,均检测到目的基因表达(见图1)。
2.2 γ射线对重组腺病毒对SW480细胞感染率的影响
分为照射组与对照组,3 d后在荧光显微镜下计数GFP阳性细胞百分比。结果(图2)转染双自杀基因的大肠癌细胞照射组和对照组转染率有明显差异(P<0.01)。
2.3 前药对γ射线对转染重组腺病毒的SW480细胞的杀伤协同作用
2.3.1 转染p Ad KDR/CD/TK SW480细胞和对照的SW480细胞,均给予GCF+5-FC和γ射线照射,其生长率如图3。γ射线0.2Gy时,生存率分别为(32.2±4.3)%和(86.6±4.6)%;γ射线0.5Gy时,生存率分别为(11.3±3.1)%和(75.2±4.8)%;γ射线0.8Gy时,生存率分别为(6.5±1.4)%和(68.8±5.2)%;γ射线1.0Gy时,生存率分别为(1.6±0.3)%和(47.2±3.7)%;γ射线1.5Gy时,生存率分别为(0.2±0.06)%和(33.9±2.4%);提示转染p Ad KDR/CD/TK SW480细胞比对照组对前药+γ射线更为敏感(各组P<0.001)。
2.3.2 取对数生长期的转染p Ad KDR/CD/TK,p Ad KDR/CD,p Ad KDR/TK的SW480细胞,及对照组SW480细胞(未做任何处置),分别给予不同浓度GCV、5-FC及 GCV+5-FC。MTT法计算细胞生长抑制率。结果(图4):TK+CD/G+F组和TK+CD/G+F+γ组比较,前药为10/100时细胞生长率分别为(87.4±5.2)%和(31.2±3.8)%;20/200时细胞生长率分别为(64.9±5.6)%和(23.5±4.1)%;40/400时细胞生长率为(56.2±4.8)%和(19.7±3.2)%;60/600时分别为(33.1±2.6)%和(2.1±0.2)%;100/1000时分别为(20.9±2.3)%和(1.3±0.3)%。两组比较有统计学意义(P<0.01)。
2.4 细胞克隆形成实验检测γ射线增敏作用
见表1。单纯用药组和对照组比较有统计学意义(P<0.01)。联合治疗组和单纯用药组比有显著差异(P<0.0005)。而联合治疗组(G+F)与单纯放射组比相对克隆率分别为16.8%和59.6%,联合用药(G+F)与单药(G)、(F)的相对克隆形成率分别为16.8%和43.8%、46.0%。提示γ射线对联合应用GCV+5-FC比单独应用GCV或5-FC具有明显的曾敏作用;TK/CD双自杀基因的曾敏作用明显高于单自杀基因TK或CD(P<0.001)。
3 讨论
研究表明,自杀基因对大肠癌细胞具有杀伤作用[4-8],Takeharu kanazawa等[9]报道 γ射线照射能够增强TK/GCV在癌细胞中的转染率和表达。本实验利用已构建的Adp KDR-TK/CD腺病毒载体,转染大肠癌SW480细胞,给予前药联合γ射线照射,观察双自杀基因和γ射线照射的协同增效作用。①转染率:用不同的MOI转染SW480细胞,并用γ射线1Gy照射,当MOI值为10、20、50时对照组分别是对照组的10.2倍、5.5倍、2.1倍,说明γ射线照射能明显提高双自杀基因的转染效率,并且MOI值较低时作用明显。其原理可能是因为辐射使受照细胞表面受损及穿孔,引起细胞膜通透性和跨膜电位的改变,便于带负电荷的外源基因主动进人细胞,随着辐射剂量的增加细胞内基因产物的量也相应增加。再有辐射导致受体细胞DNA损伤,从而激活细胞的修复机制,在修复过程中由于剪切和重组的发生,很容易使外源DNA和受体DNA发生重组整合。Stevens等[10]发现用9Gy的γ射线照射可以将质粒载体介导的DNA的初始转染效率提高1400倍。虽然本实验γ射线量较小,但转染率提高也很明显。②自杀基因+前药对γ射线的增敏作用:转染 p Ad KDR/CD/TK SW480 细 胞/γ 组 和 转 染p Ad KDR/CD/TK SW480细胞/GCV+5-FC+γ组相比,分别给予 GCV/5-FC100μg/ml+1 000μg/ml,当γ射线0.2Gy、0.5Gy、0.8Gy、1.0Gy、1.5Gy其细胞生存率前者分别是后者的2.6倍、5.6倍、7.6倍、20.3倍和141.5倍。其可能的机制是辐射使受照细胞基因转染率升高,DNA受损、断裂,并且射线对处于G1期细胞杀伤作用强,而5-FU对于处于S期的细胞杀伤作用明显;放疗可使药物从受到损伤的细胞中释放出来,因而强化了基因治疗的“旁观者效应”。③γ射线对自杀基因的增敏作用:TK+CD/G+F组和TK+CD/G+F+γ组比较,给予γ射线1.0Gy照射,并给予前药GCV+5-FC分别为10μg/ml+100μg/ml、20μg/ml+200μg/ml、40μg/ml+400μg/ml、60μg/ml+600μg/ml、100 μg/ml+1 000μg/ml。两组比较前者的细胞生存率是后者的2.8倍、2.8倍、2.8倍、16倍、16倍。提示自杀基因对γ射线的增敏作用,其机制可能是:前药改变肿瘤细胞敏感性,主要是通过促进促凋亡基因bax的转录、抑制凋亡基因bcl-2的转录,以增强肿瘤细胞对放疗的敏感性;或者使肿瘤细胞阻滞于G1期,而G1后期对放疗敏感,从而提高肿瘤细胞对辐射的敏感性,磷酸化的前体药物搀入DNA中可干扰放射损伤的修复,还可对抗放疗后肿瘤细胞的再增殖。

表1 SW480细胞克隆形成率与相对克隆形成率
综上所述,通过本实验提示我们,自杀基因联合放疗:① 放射线可提高基因转移的效率[11],因而提高了基因治疗的效果。② 磷酸化的前体药物搀入DNA中可干扰放射损伤的修复。③ 放疗可使药物从受到损伤的细胞中释放出来,因而强化了基因治疗的“旁观者效应”。④ 基因治疗可增强放疗的疗效 ,例如直接杀伤或抑制,肿瘤细胞的基因治疗联合放疗不但能提高肿瘤细胞的杀伤能力,还可对抗放疗后肿瘤细胞的再增殖,从而提高疗效。⑤ 基因治疗可增强放疗的疗效,提高其放射敏感性,减少前药的用量,降低射线照射的剂量,可减轻前药的副作用和正常组织的放射性损伤,为提高放疗疗效提供了可能性。
[1]Miller N,Whelan G.Progress in transcriptionally targeted and ragulatable vectors for genetic therapy[J].Hum Gene Ther,1997,8(7):803.
[2]Zeng M,Cerniglia GJ,Eck SL,et al.Higher efficiency stable gene transfer of adenovirus into mammalian cells using ionizing radiation[J].Hum Gene Ther,1997,8(9):1025.
[3]Rogulski KR,Wing MS,Paielli DL,et al.Double suicide gene therapy augments the anti-tumor activity of a replication-competent lytic adenovirus though enhanced cytotoxicity and radiosensitization[J].Hum Gene Ther,2000,11(1):67.
[4]刘志毅,宋 燕,武鸿斌,等.KDR启动子启动双自杀基因对LOVO细胞的杀伤作用[J].中国实验诊断学,2008,12(1):50.
[5]陈海金,黄宗海,吴爱国等.慢病毒介导的双自杀基因对大肠肿瘤细胞的靶向杀伤作用[J].南方医科大学学报,2007,27(5):624.
[6]魏 冬,韦军民,黄美雄等.TK/GCV,CD/5-FC双自杀基因系统治疗结肠癌的试验研究[J].消化外科,2006,5(6):466.
[7]Wang ZY,Huang ZH,Li Q,et al.A double suicide gene system driven by KDR promoter selectively kills human colon adneocarcinoma SW480 cells[J].Nan Fang Yi Ke Da Xue Xue Bao,2010,30(2):224.
[8]Luo XR,Li JS,Niu Y et al.Adenovirus-mediated double suicide gene selectively kills gastric cancer cells[J].Asian Pac Cancer Prev,2012,13(3):781.
[9]Takeharu Kanazawa,Masashi Urabe,Hiroake,et al.γ-Ray enhance Raav-mediated trnsgene expression and cytocidal effect of AAV-HSVtk/gancicilovir on cancer cells[J].Cancer Gene Therapy,2001,8(2):99.
[10]Stevens CW,Zeng M,Cerniglia CJ,et al.Ionizing radiation greatly improves gene transfer efficiency in mammalian cells[J].Hum Gene Ther,1996,7(14):1727.
[11]Jain PT,Cexirtz DA.Sustained enhancement of liposome-mediated gene delivery and gene expression in human breast tumor cells by ionizing for radiation[J].Int Radiat Biol,1999,75:217.
