温热对胃癌MKN-45细胞凋亡及基因Bax表达的影响
2013-02-24蒋莉萍吴凤珍
蒋莉萍,邱 瑜,肖 凤,吴凤珍
(1.吉安市妇幼保健院 病理科,江西 吉安 343000;2.井冈山大学 病理教研室,江西 吉安 343000)
自从1975年在华盛顿召开的第一届国际热疗会议以来,热疗作为一种新的肿瘤治疗方法越来越引起人们的兴趣与关注,唯独热疗不开刀,无副作用,被誉为治疗肿瘤的“绿色疗法”。是继临床上常规抗癌疗法之后的另一种新的抑癌方法[1,2]。目前研究认为,温热刺激能引起细胞凋亡[3,4],而且温热疗法和免疫、化疗等疗法联合应用,还会提高免疫,化疗等疗法的效果[5,6]。本研究对胃癌 MKN-45细胞采用临床有效且相对安全的43℃作为温热的条件,进行不同时间点的水浴热处理,旨在通过观察温热作用对MKN-45细胞凋亡及Bax基因表达的影响,为临床温热疗法提供一定的理论依据。
1 材料和器材
1.1 材料 人胃癌细胞株MKN-45胃癌细胞由江西省消化系疾病研究所馈赠;0.25%胰蛋白酶、高糖DMEM培养液(美国GIBCO公司);DMSO(美国Amresco公司);胎牛血清(杭州四季青公司);TUNEL细胞凋亡检测试剂盒(南京凯基公司KGA7031-50);DEPC(美国 Amresco公司);Trizol Reagent(美国Invitrogen公司);700 bp DNA ladder Marker(北京全式金生物技术有限公司);Bax(上游5′-GGCCCACCAGCTCTGAGCAG-3′,下游5′-GCCACGTGGGCGTCCCAAAC-3′,575 bp)及β-actin(上游5′-TCAGGTCATCACTATCGGCAAT-3′,下游5′-AAAGAAAGGGTGTAAAACGCA-3′,432 bp)PCR引物(美国Invitrogen公司)。
1.2 器材 超净工作台(新加坡ESCO公司);二氧化碳培养箱(美国NUAIRE公司);35 mm玻底培养皿(香港耐思科学有限责任公司);RT-PCR电泳仪(美国Bio-rad公司)。
2 方法
2.1 细胞培养
用含10%胎牛血清的DMEM培养液常规培养(37℃、5%CO2饱和湿度)。
2.2 温热实验
对照组37℃常规培养,不给予加热处理,实验组加热温度设置43℃,根据加热时间不同分为0.5 h、1 h、2 h及3 h。将处于对数生长期内的MKN-45细胞常规消化、离心、重悬混匀,计数后,接种于35 mm NEST培养皿,置37℃、5%CO2恒温孵育箱培养至贴壁。用封口膜封口后放入43℃的电热恒温水浴箱加热(温度波动<±0.1℃)。确保整个培养皿底部平放淹没于水中,将温热处理后的细胞换新鲜的10%FBS-高糖DMEM培养液,并放置37℃、5%CO2恒温孵育箱培养24 h。倒置显微镜下观察各温热时间组胃癌细胞MKN-45的形态改变。
2.3 原位末端标记(TUNEL)法检测细胞凋亡
按本实验2.2细胞样品制备后,将自然晾干的细胞样本(细胞爬片)浸入4%多聚甲醛固定液,室温(25℃)固定30 min,样本片浸入PBS漂洗2次,每次5 min;样本片浸入通透液中,室温促渗5 min,样本片浸入PBS漂洗2次,每次5 min;样本片浸入封闭液中,封闭10 min,样本片浸入PBS漂洗2次,每次5 min;每张样本片上滴加100μl上述配制好的DNaseⅠ反应液,25℃处理30 min,浸入1×PBS漂洗2次,每次5 min;每个样本上滴加50μl Td T酶反应液,加盖玻片放入温盒中,37℃避光反应60 min,反应连接后的样本片浸入PBS漂洗2次,每次5 min,注意避光;每个样本上滴加50μl Streptavidin-HRP工作液,加盖玻片放入温盒中,37℃避光反应30 min,反应连接后的样本片浸入PBS漂洗2次,每次5 min,DAB显色。
凋亡细胞半定量分析:在普通光学显微镜下,每组培养皿随机观察5个视野,每个视野计数500个细胞,以计算平均凋亡细胞数所占百分比作为凋亡指数。
2.4 RT-PCR法检测温热后胃癌细胞Bax的mRNA表达
MKN-45细胞接种于25 cm2培养瓶中,待细胞贴壁长至70%左右,分组温热处理后24 h,将温热处理后的各组细胞用预冷的PBS液洗3次,吸弃PBS液,依次加入Trizol、氯仿、异丙醇等,按常规抽提法提取细胞总RNA。琼脂糖凝胶电泳结果显示RNA的完整性,紫外分光光度法确定RNA的量和纯度。以总RNA为模板按逆转录试剂盒上的说明进行逆转录反应。将扩增的DNA产物与1μl 6×上样缓冲液(0.25%溴酚蓝,50%甘油,10 m M EDTA)混合,加样于含0.5%溴化乙锭的2%琼脂凝胶,100 V电泳15 min,紫外线灯下观察结果。然后用Quantity One4.6.2软件分析灰度值,再计算灰度系数比。
3 结果
3.1 温热后胃癌细胞的形态结构改变
倒置显微镜观察:与对照组相比,温热0.5 h部分贴壁MKN-45细胞出现皱缩,从胞膜伸出胞外的伪足逐渐减少,细胞逐渐变圆,细胞内颗粒成分逐渐增多,细胞漂浮,1 h相对较少,2 h细胞皱缩、变圆、漂浮明显增多,细胞数目减少,3 h大部分细胞出现漂浮现象,提示温热0.5 h、1 h,2 h和3 h可明显杀伤胃癌MKN-45细胞。
3.2 TUNEL检测细胞凋亡情况
利用TUNEL荧光素原位末端标记技术,在荧光显微镜下观察,凋亡细胞呈现黄绿色荧光,而非凋亡细胞不发黄绿色荧光,温热0 h、0.5 h、1 h、2 h和3 h后 MKN-45细胞凋亡率分别为11.3%、42.7%、33.4%、48.8%、44.3%,各温热时间组 MKN-45细胞凋亡率均明显高于0 h时间组细胞的凋亡率(P<0.01),并且温热1 h后的细胞凋亡率低于温热0.5 h,提示胃癌细胞自身对温热可产生一定的应激能力(表1,图1)。
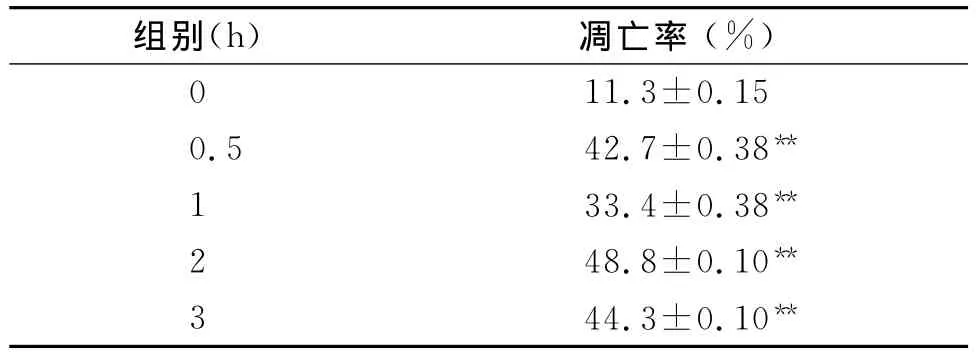
表1 不同温热时间组胃癌MKN-45细胞的凋亡率

图1 不同温热时间组胃癌MKN-45细胞的TUNEL染色
3.3 RT-PCR法检测Bax的mRNA表达
RT-PCR电泳结果显示,与0 h对照组比较,0.5 h至3 h各温热时间组的细胞Bax的m RNA表达水平均明显升高(P<0.05);3 h组达最高峰,1 h组低于0.5 h组;与TUNEL法测凋亡的趋势相一致,提示温热可能诱导胃癌MKN-45细胞促凋亡基因过程中Bax基因激活,从而促进细胞凋亡(图2)。
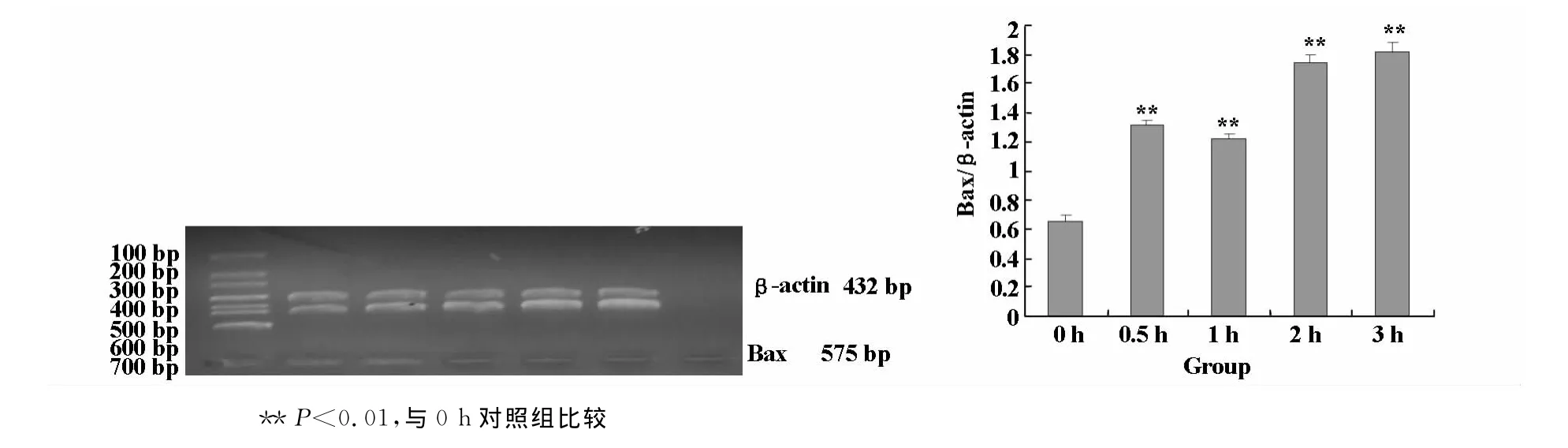
图2 不同温热时间组胃癌MKN-45细胞Bax m RNA的RT-PCR检测(β-actin为内参照)
3.4 统计分析
应用SPSS13.0统计软件行统计分析,数据均采用均数土标准差表示(±SD),以单因素方差分析(one-way ANOVE)计算多组间差异,两两比较采用q检验,P<0.05为有统计学差异,P<0.01为有显著性统计学差异。
4 讨论
热疗是用人工加热的方法治疗恶性肿瘤,利用各种物理能量在人体组织中产生热效应,使肿瘤细胞升温到一定程度并维持一定时间,达到引起癌细胞凋亡和杀灭癌细胞及避免正常细胞遭受损伤的目的,另外热疗可增强免疫治疗和化学药物治疗的效果,所以在目前的肿瘤综合治疗中倍受关注。当前研究表明,温热疗法治疗恶性肿瘤的作用机制主要是:1)改变细胞内环境,妨碍膜转运蛋白及细胞表面受体的功能,直接导致癌细胞的死亡;2)抑制肿瘤血管生成及肿瘤转移[7];3)可促进免疫细胞包括自然杀伤细胞、T淋巴细胞和巨噬细胞的活性,促进细胞因子的合成及增强免疫效应,提高机体的免疫功能[8];4)诱导肿瘤细胞凋亡[9]。有研究表明43℃~45℃温热作用可诱导肿瘤细胞凋亡[10],但不同类型的肿瘤细胞对热疗的反应和敏感性也存在明显差异[11]。本实验首先采用倒置显微镜观察到温热后MKN-45细胞体积变小变圆,核膜皱缩,核染色质均质化,呈细颗粒状,随着时间的延长,细胞内颗粒成分逐渐增多,细胞凋亡数增加。然后采用TUNEL法检测温热诱导胃癌MKN-45细胞凋亡率情况,随着温热时间的延长,细胞凋亡率也逐渐增加,另外温热1 h细胞活力比0.5 h时略高,提示 MKN-45细胞在热刺激的持续作用下,很可能在1 h进入一个热适应期。而3 h细胞组活力比2 h时略低,考虑随着时间的延长,热刺激3 h细胞组出现了大批细胞的死亡。
Bax是一种Bcl-2家族的前凋亡蛋白,而且是Bcl-2家族中最主要的凋亡基因。一般出现在胞浆中,并作为一种细胞损伤和刺激的传感器。响应损伤和刺激,Bax将重新定位于线粒体表面并破坏在正常状态下抗凋亡的Bcl-2蛋白的功能,可与线粒体上的电压依赖性离子通道相互作用,介导细胞色素C的释放,具有促凋亡作用[12]。在本研究中,温热作为一种应激,为此,我们推测Bax参与温热诱导胃癌细胞凋亡的过程。我们采用RT-PCR法检测MKN-45细胞43℃温热下0.5 h、1 h、2 h和3 h后的Bax mRNA水平的表达情况。与对照组比较,MKN-45细胞各温热时间组Bax mRNA水平的表达明显升高,温热3 h组达最高峰,1 h组低于0.5 h组(P<0.01)。这与前面的凋亡实验结果相吻合。提示温热可明显抑制胃癌细胞增殖,诱导细胞凋亡,并可能是通过上调Bax水平的表达而促进胃癌细胞凋亡。
[1]Dahl O,Dalene R,Schem B C,et al.Status of clinical hyperthermia[J].Acta Oncologica,1999,38(7):863.
[2]Wust P,Hildebrandt B,Sreenivasa G,et al.Hyperthermia in combined treatment of cancer[J].The lancet oncology,2002,3(8):487.
[3]Klostergaard J,Leroux M,Auzenne E,et al.Hyperthermia engages the intrinsic apoptotic pathway by enhancing upstream caspase activation to overcome apoptotic resistance in MCF-7 breast adenocarcinoma cells[J].Journal of cellular biochemistry,2006,98(2):356.
[4]曹智刚,郭启勇,马 力,等.热化疗对人胆管癌细胞增殖和凋亡的影响[J].中国医学影像技术,2006,2(006):804.
[5]陈声池,张长其,陈映雪.热疗联合长春瑞滨和顺铂方案治疗晚期非小细胞肺癌临床疗效观察[J].中华肿瘤防治杂志,2008,15(10):778.
[6]黄 波,王晓东,郎贤平.热疗联合顺铂对小细胞肺NCI-H446细胞凋亡的影响及机制探讨[J].山东医药,2012,52(18):1.
[7]Fukao H,Ikeda M,Ichikawa T,et al.Effect of hyperthermia on the viability and the fibrinolytic potential of human cancer cell lines[J].Clinica chimica acta,2000,296(1-2):17.
[8]蔡素霞,田晓予,米建强,等.Tween 80联合42℃温热对人卵巢癌SKOV-3细胞增殖及 HSP70蛋白表达的影响[J].肿瘤,2009,29(004):337.[9]Sharif-Khatibi L,Kariminia A,Khoei S,et al.Hyperthermia induces differentiation without apoptosis in permissive temperatures in human erythroleukaemia cells[J].International journal of hyperthermia,2007,23(8):645.
[10]HONMA T.Characteristics of hyperthermia-induced apoptotic cell death[J].Nippon rinsho Japanese journal of clinical medicine,1996,54(7):1949.
[11]汤 睿,朱正纲,瞿 颖,等.温热体外对人胃癌细胞株生物学行为的影响[J].世界华人消化杂志,2006,14(2):144.
[12]崔玉芳,夏国伟,付小兵,等.Relationship between expression of Bax and Bcl-2 proteins and apoptosis in radiation compound wound healing of rats[J].中华创伤杂志:英文版,2004,6(3):135.
