大豆低聚肽抗氧化及抗疲劳作用评价
2013-02-21徐丽萍
王 鑫,徐丽萍
(哈尔滨商业大学食品工程学院省高校食品科学与工程重点实验室,黑龙江哈尔滨150076)
大豆低聚肽是大豆蛋白经酶解作用处理后得到的蛋白质水解产物,除氨基酸组成与大豆蛋白一样具有优质蛋白的特点以外,还具有大豆蛋白所不具备的良好的溶解性、稳定性等理化性质,而且具有易吸收和低过敏原性、降低血脂和胆固醇、降低血压、促进矿物质吸收和脂肪代谢、增强运动员体能等多种生理功能[1]。随着生物技术的进步和生命科学的发展,大豆肽的生理功能逐步被人们发现,一些活性肽的结构和生理功能逐渐明确,推动了活性肽的研究,也促进了大豆肽的研究与开发。美国在70年代初研制出大豆肽产品,建成了年产5000t食用大豆肽的工厂。日本于80年代开展此方面的研究,雪印和森永等乳业公司均已成功地将大豆肽应用于食品工业中[2]。但此时他们生产的大豆低聚肽也多用酸解法、碱解法和氢解法,这样生产的肽化学物质难以除尽、苦味重[3]。我国对于大豆低聚肽的研究开发起步较晚,于80年代中后期才开始兴起,基础和应用研究都很薄弱,目前仍处于起步阶段。有研究表明,大豆分离蛋白酶解物具有清除羟自由基的能力,清除能力主要与暴露的氨基酸侧链基团和肽序列有关[4]。大豆低聚肽能够及时修复运动过程中损伤的骨骼肌细胞,维持骨骼肌细胞结构和功能的完整性。同时,能够增加睾酮的分泌,促进蛋白质合成。其抗疲劳机制可能通过提高肝糖原的储备、降低血乳酸含量,通过增强SOD活性,抑制氧自由基的释放及提高免疫功能发挥抗疲劳作用。人体实验证实,大豆低聚肽能够有助于减轻运动后疲劳[5]。
通过实验探讨大豆低聚肽对小鼠的抗疲劳及抗氧化作用,为新型营养补剂的开发提供理论依据和实验基础。对有效利用我国丰富的大豆资源,提高大豆的利用价值,并向高强度运动员提供新型健康的抗疲劳保健食品具有重要意义。
1 材料与方法
1.1 材料与仪器
大豆低聚肽 自制;纽崔莱蛋白粉 成都安利日用品有限公司;小鼠 体重18~22g,6~8周龄、基础饲料 哈尔滨医科大学实验动物室;总抗氧化能力测定试剂盒、抗超氧阴离子自由基测试盒、血尿素氮测试盒、肌糖原及肝糖原测定试剂盒 南京建成科技有限公司;水杨酸 天津市泰兴化学试剂有限公司;亚油酸 上海市精细化学品研究所;硫代巴比妥酸 国药集团化学试剂有限公司。
TGL-16G型台式离心机 上海安亭科学仪器厂;FSH-2型可调高速匀浆器,微量移液器 上海安亭微量进样器厂;TU-1900型紫外分光光度计 北京普析通用有限公司。
1.2 实验方法
准确称量25g大豆分离蛋白,木瓜蛋白酶与碱性蛋白酶按2∶1的比例加入1g,用蒸馏水溶解,搅拌混匀,然后定容到500m L,将溶液调至pH为7,于55℃水溶液中酶解2h,取滤液浓缩冷冻干燥后为大豆低聚肽,待用于小鼠的灌胃。
1.2.1 动物的分组及喂养 取40只小白鼠随机分为5个组,每组8只,雌雄各半。5个实验组分别为:阴性对照组(CG)蒸馏水灌胃,3个剂量组大豆低聚肽溶液灌胃,其剂量分别为2.0g/kg(LD)、4.0g/kg(MD)、8.0g/kg(HD);阳性对照组(WPC)纽崔莱蛋白溶液灌胃,剂量为4.0g/kg[6]。采用灌胃法,每天给小鼠灌胃不同剂量的受试物,对照组给予同等体积的蒸馏水灌胃,每天一次,小鼠自由摄食鼠粮与饮水,连续15d[7]。然后进行各项抗疲劳指标的测定。
1.2.2 大豆低聚肽抗氧化活性的研究
1.2.2.1 总抗氧化能力测定 配制不同浓度的大豆低聚肽及VC溶液,并按照总抗氧化能力测定试剂盒的说明书严格要求操作。
定义:在37℃时,每分钟每毫升样品使反应体系的吸光值每增加0.01时为一个总抗氧化能力单位。
总抗氧化能力(单位/毫升样品)=(测定管吸光度-对照管吸光度)/(0.01×30)×(反应液总体积/取样量)×样品测试前的稀释倍数
1.2.2.2 抑制超氧阴离子自由基能力测定 按照超氧阴离子自由基及产生超氧阴离子自由基测定试剂盒说明书严格要求操作。
定义:在反应系统中,每升样品在37℃反应40m in所抑制的超氧自由基相当于1mg的维生素C所抑制的超氧阴离子自由基的变化为一个活力单位。

式中:Ai—对照管吸光度;AS—测定管吸光度;Aj—标准管吸光度;C—标准管浓度(0.15mg/m L);V—1000m L;n—样品测试前稀释倍数。
1.2.2.3 抑制羟自由基能力测定 在25m L容量瓶中依次加入2mmol/L FeSO43m L、1mmol/L H2O23m L,摇匀,接着加入6mmol/L水杨酸3m L,加入蒸馏水补充至25m L,摇匀,于37℃水浴加热60m in后取出,测其吸光度A0。分别加入1mg/m L大豆低聚肽溶液及VC溶液0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0m L于25m L容量瓶中,同样加入2mmol/L FeSO43m L、1mmol/L H2O23m L,摇匀,接着加入6mmol/L水杨酸3m L,用蒸馏水定容至刻度,摇匀,水浴加热60m in,取出测其吸光度Ai。按式(2)计算待测液清除率,待测液对羟自由基(·OH)清除率为:
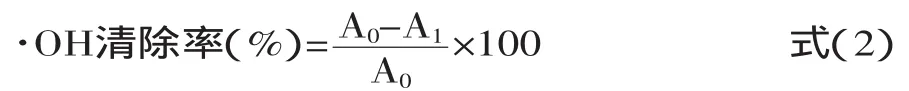
式中:A1—加样液时溶液的吸光度;A0—不加样液时溶液的吸光度。
1.2.2.4 抑制烷自由基能力测定 分别准确吸取1mg/m L大豆低聚肽溶液及VC溶液0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0m L与0.1m L亚油酸混合,加入5m L乙醇,5m L 0.1mol/L磷酸缓冲液(pH=8.0)、用10W紫外灯的紫外光照射120m in。然后加入4m L 20%三氯乙酸(W/V)、1m L 3%硫代巴比妥酸(W/V),95℃水浴反应90min,冰浴冷却,离心,于532nm处比色,A0为以蒸馏水代替试样作为空白组的吸光度。根据式(3)计算清除率,待测液对烷基自由基(ROO·)清除率为:
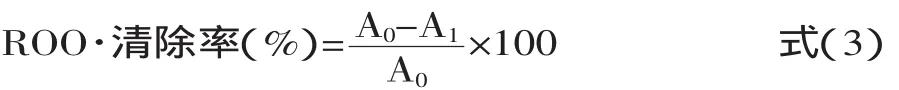
式中:A1—加样液时溶液的吸光度;A0—不加样液时溶液的吸光度。
1.2.3 大豆低聚肽抗疲劳作用的研究
1.2.3.1 力竭游泳时间的测定 连续灌胃15d,末次灌胃30m in后,将小鼠置于游泳箱中游泳。水深约25cm,水温(25±1.0)℃,鼠尾根部负荷5%体重的铅皮[4]。记录小鼠自游泳开始至力竭的时间(以鼻孔下沉为判断标准),作为小鼠力竭游泳时间[8]。
1.2.3.2 血浆尿素氮(BUN)含量的测定 连续灌胃15d,末次给小鼠灌胃后,次日,在温度为25℃的水中不负重游泳30m in。运动后休息15m in后立即断头采血0.2m L,用肝素来对血浆进行抗凝。采血后完毕,立即2000r/min离心15min,取血清20μL并于520nm波长比色,测定血浆尿素值,计算血浆尿素氮含量(测定方法及尿素氮含量计算公式详见血尿素氮试剂盒)[9]。
1.2.3.3 肝糖原含量的测定 连续灌胃15d,末次给小鼠灌胃后,次日,在温度为25℃的水中不负重游泳30m in。运动后休息15m in后立即处死,取肝脏经生理盐水漂洗后用滤纸吸干,精确称取肝脏100mg,将肝脏与碱液按1∶3加入试管后进行匀浆制成水解液,并置于沸水浴中20min,流水冷却,将肝糖原水解液配制成1%检测液,同时配制空白与标准溶液,混匀,沸水浴5m in,冷却,于620nm波长比色,计算肝糖原含量(测定方法及肝糖原含量计算公式详见肝糖原含量测定试剂盒)。
1.2.3.4 肌糖原含量的测定 连续灌胃15d,末次给小鼠灌胃后,次日,在温度为25℃的水中不负重游泳30m in。运动后休息15m in后立即处死,取股四头肌经生理盐水漂洗后用滤纸吸干,精确称取股四头肌100mg,将肌肉与碱液按1∶3加入试管后进行匀浆制成水解液,并置于沸水浴中20min,流水冷却,将肝肌糖原水解液配制成5%检测液,同时配制空白与标准溶液,混匀,沸水浴5m in,冷却,于620nm波长比色,计算肌糖原含量(测定方法及肝糖原含量计算公式详见肌糖原含量测定试剂盒)。
2 结果与讨论
2.1 动物的分组及喂养结果分析
对小鼠进行连续灌胃15d后,阴性、阳性对照组和大豆低聚肽的高、中、低剂量组小鼠体重差异结果见表1。
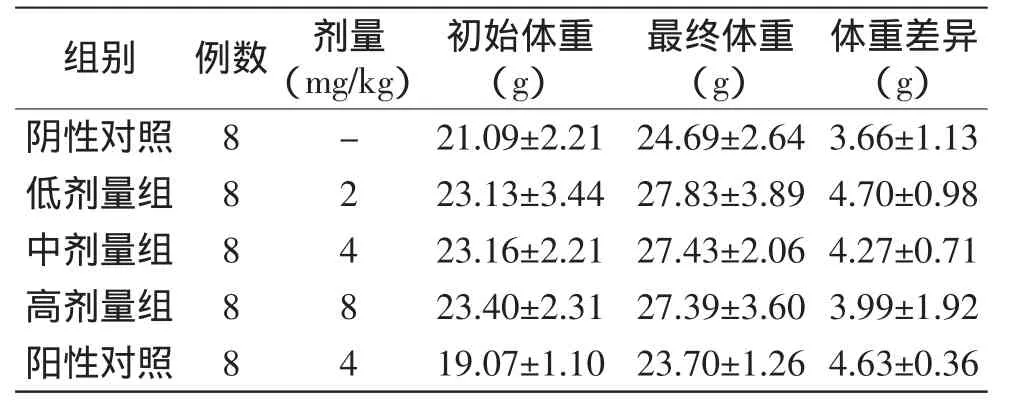
表1 实验过程对小鼠生长发育的影响Table1 The effectof the experiments onmice growth
由表1可知,小鼠在喂养15d后体重均表现出增长的趋势。说明高脂饲料能够导致小鼠体重明显增加,饲料诱导高血脂大鼠模型制备成功。
2.2 大豆低聚肽抗氧化活性的研究结果分析
2.2.1 大豆低聚肽总抗氧化能力测定结果分析 由图1可知,大豆低聚肽显现出一定的抗氧化能力,随着大豆低聚肽的浓度增大,总抗氧化能力越强,但低于参比VC的抗氧化能力。因此,在该实验中,大豆低聚肽总抗氧化能力最大为13.86U/m L。
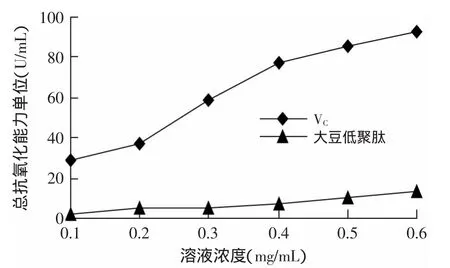
图1 总抗氧化能力测定Fig.1 Determination of total antioxidant capacity
2.2.2 大豆低聚肽抗超氧阴离子能力测定结果分析
由图2可知,不同浓度的大豆低聚肽对超氧阴离子的产生都有一定的清除作用,且随着大豆低聚肽浓度的增加,抗超氧阴离子自由基的效果增强。O·是活性氧的一种,是机体寿命最长的自由基,通常作为自由基链式反应的引发剂,产生活性更强的·OH自由基,进一步给机体造成危害。可见大豆低聚肽对O·有一定的清除作用。因此,在该实验中,大豆低聚肽抗超氧阴离子自由基能力最大为158.67U/L。
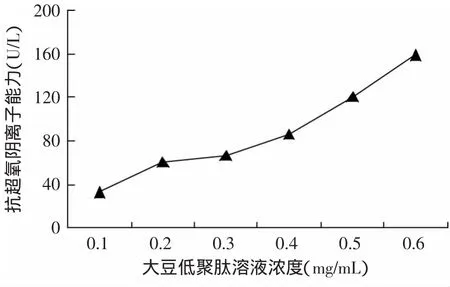
图2 抗超氧阴离子自由基能力的测定Fig.2 Determination of superoxide anion radical scavenging
2.2.3 大豆低聚肽对羟自由基清除效果的结果分析
由图3可知,随着大豆低聚肽浓度的升高,其对羟自由基的清除率逐渐升高,但是变化不明显;VC对羟自由基的清除率同样随着浓度升高而升高,但当加入大于2m L VC时,其清除率就已达到100%;在0.5~2.0m L范围内,VC的清除率约为大豆低聚肽的10倍,因此说明了大豆低聚肽对羟自由基具有一定的抗氧化效果。因此,在该实验中,大豆低聚肽抗超氧对羟自由基的最大抑制率为17.11%。
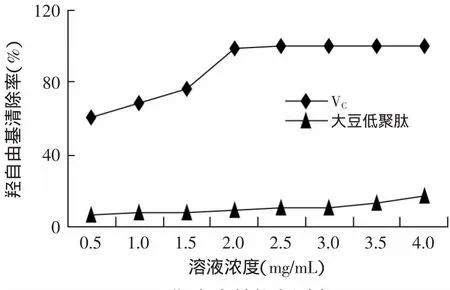
图3 羟自由基能力测定Fig.3 Determination of hydroxyl radical

图4 清除烷基自由基能力测定Fig.4 Determination of alkyl radicals capability
2.2.4 大豆低聚肽对烷基自由基清除效果的结果分析 由图4可知,随着大豆低聚肽浓度的升高,其对烷基自由基的清除率逐渐升高,变化趋势明显,但略低于参比VC清除率。因此说明了大豆低聚肽具有和VC相当的抗氧化效果。在该实验中,大豆低聚肽抗超氧对对烷基自由基的最大抑制率为31.97%。
2.3 大豆低聚肽抗疲劳作用研究结果分析
2.3.1 大豆低聚肽对小鼠力竭游泳时间的结果分析
由图5可知,力竭游泳时间最长的为高剂量组(45.51± 1.39)m in,最短的为阴性对照组(33.76±2.68)m in;三个剂量组和阳性对照组的力竭游泳时间明显高于阴性对照组,并且差异显著(p<0.05);中、高剂量组之间差异不显著。力竭游泳测试是常用的抗疲劳测试方法[10]。疲劳是机体活动到达一定程度后产生的一种自我保护的生理机制,可以防止威胁生命的过度机能衰竭,而力竭游泳时间可以最直观地体现受试物的抗疲劳功效[11]。在宏观上体现出大豆低聚肽良好的抗疲劳效果。

图5 大豆低聚肽对各组小鼠游泳时间的影响Fig.5 The effectof soybean oligopeptides on swimming time for each group ofmice

图6 大豆低聚肽对各组小鼠BUN含量的影响Fig.6 The effect of soybean oligopeptides on BUN levels for each group ofmice
2.3.2 大豆低聚肽对小鼠BUN含量的结果分析 由图6可知,在小鼠力竭游泳之后,BUN含量最高的为阴性对照组(18.15±0.38)mmol/L,含量最低的为高剂量组(17.05±0.33)mmol/L;灌喂大豆低聚肽的剂量组和阳性对照组的BUN含量均低于阴性对照组;并且剂量组的BUN含量有降低趋势。BUN是体内蛋白质代谢的最终产物,主要在肝细胞中生成。对运动时蛋白质分解代谢强度常以BUN浓度以及汗液、尿液中排出的尿素氮量来加以估计。生理条件下BUN维持稳定,蛋白质的分解代谢没有显著增强。进行长时间运动时,体力消耗则导致蛋白质分解代谢增强,BUN浓度呈坡型升高。体内缺乏糖原时,就利用蛋白质的分解来弥补糖的不足。故BUN也作为评价运动性疲劳强度的重要指标[12]。由此可见,大豆低聚肽能够减少能源物质的消耗,具有抗疲劳效果。
2.3.3 大豆低聚肽对小鼠肝糖原含量的结果分析及评价 由图7可知,在小鼠力竭游泳之后,肝糖原含量最高的为高剂量组(17.45±0.36)mg/g,含量最低的为阴性对照组(11.51±0.55)mg/g;灌喂大豆低聚肽的剂量组和阳性对照组的肝糖原含量均明显高于阴性对照组;并且剂量组的肝糖原含量有比较明显的升高趋势。研究证明,在力竭运动之后,需要通过分解肝糖原为机体提供能量。肝脏不断输出葡萄糖,是血液中葡萄糖最重要的调节器官,内源性的葡萄糖有75%左右来自肝糖原分解,其余5%来自糖异生作用[7]。因此肝糖原存储量可视为体内能源物质的评价指标[13]。由此可见,大豆低聚肽可增加体内肝糖原的含量,为机体供能,具有抗疲劳效果。

图7 大豆低聚肽对各组小鼠肝糖原含量的影响Fig.7 The effectof soybean oligopeptides on liver glycogen levels for each group ofmice

图8 大豆低聚肽对各组小鼠肌糖原含量的影响Fig.8 The effectof soybean oligopeptides onmuscle glycogen levels for each group ofmice
2.3.4 大豆低聚肽对小鼠肌糖原含量的结果分析及评价 由图8可知,在小鼠力竭游泳之后,肌糖原含量最高的为中剂量(1.53±0.09)mg/g,含量最低的为阴性对照组(0.93±0.07)mg/g;灌喂大豆低聚肽的剂量组和阳性对照组的肌糖原含量均明显高于阴性对照组;中、高剂量组的肌糖原含量相当,且均高于低剂量组。肌糖原是肌肉中糖的储存形式,在剧烈运动消耗大量血糖时,肌糖原分解供能,肌糖元不能直接分解成葡萄糖,必须先分解产生乳酸,经血液循环到肝脏,再在肝脏内转变为肝糖元或分解成葡萄糖。因此肌糖原存储量也可视为体内能源物质的评价指标。由此可见,大豆低聚肽可增加体内肌糖原的含量,为机体提供储备能量,具有抗疲劳效果。
3 结论
以大豆低聚肽为原料,对其抗氧化活性及抗疲劳作用进行了研究。通过与VC对比,对大豆低聚肽清除自由基的能力进行测定并通过动物实验研究其抗疲劳作用。得出以下结论:
3.1 大豆低聚肽具有一定的抗氧化活性,总抗氧化能力最大为13.86U/m L,抗超氧阴离子自由基能力最大为158.67U/L,对羟自由基的最大抑制率为17.11%,对烷基自由基的最大抑制率为31.97%。
3.2 大豆低聚肽具有较好的抗疲劳效果,其中力竭游泳时间最长为高剂量组45.51m in,BUN含量最低为高剂量组17.05mmol/L,肝糖原含量最高为高剂量组17.45mg/g,肌糖原最高含量为中剂量组1.53mg/g。
[1]邓成萍,张惠,魏秀英.大豆低聚肽的研究进展[J].食品科学,2004,25(增刊):236-240.
[2]张延坤,刘炳智.大豆肽在食品工业中的应用[J].食品工业,1997(3):5-6.
[3]王永桢.“生物活性多肽”:生命的活力之源[J].当代经济,2003(5):4-5.
[4]潘进权,刘耘.大豆多肽研究概况[J].中国调味品,2003,288(2):6-10.
[5]A Hirose,K Miyashita.Inhibitory effect of proteins and their hydrolysates on the oxidation of triacylylycerds containing docosahexaenoic acids inemulsio[J].Jap Soc Food Sci Technol,1999,46:799-805.
[6]刘娜,李湘浓,吴翱.大豆寡肽抗疲劳作用的实验研究[J].中国实验诊断学,2010,14(2):201-203.
[7]Ma L,CaiDL,Tong B,etal.Anti-fatigue effects of salidroside inmice[J].JournalofMedical co Ueges of PLA,2008,23:88-93.
[8]张维杰.糖复合生化技术研究[M].杭州:浙江大学出版社,1999:12-13.
[9]王彦武,傅伟忠,谭宗艳,等.枸杞多糖抗疲劳作用的实验研究[J].中国热带医学,2006,6(8):1522-1523.
[10]索有瑞,王洪伦,李玉林,等.柴达木盆地唐古特白刺籽油的抗疲劳作用[J].天然产物研究与开发,2006,18:88-91.
[11]Niranjan R,Eresha M,Won KJ,et al.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Food Research International,2005,38:175-182.
[12]胡永欣,肖国强.运动时氨基酸代谢对疲劳的影响[J].现代临床医学,2001,7(4):310-312
[13]高珊,童英,熊晓燕.蒽酮法与试剂盒法测定糖原含量的比较研究[J].首都公共卫生,2011,5(1):38-40.
