不同菌种比例对发酵桑叶茶生物活性成分含量的影响
2013-02-21黄先智丁晓雯沈以红张亚琼梁菡峪丁顺杰
肖 洪,黄先智,丁晓雯,*,沈以红,张亚琼,梁菡峪,张 迪,丁顺杰
(1.西南大学食品科学学院,重庆市农产品加工重点实验室,重庆400715;2.西南大学蚕学与生物系统研究所,重庆400715;3.家蚕基因组生物学国家重点实验室,重庆400715)
桑叶茶(Mulberry-leaf Tea)是由桑叶加工制作而成的新型茶品,目前一般采用直接烘干或自然发酵的方式生产。桑叶绿茶甘醇香甜;桑叶乌龙茶爽口醇和,有淡淡的花香;桑红茶甘甜醇厚,有近似香蕉的果香味[1]。但桑叶绿茶普遍存在汤色发黑,豆腥味重,感官品质不佳的问题,为此,人们尝试开发桑叶乌龙茶、红茶等产品。桑叶茶的主要功能成分包括生物碱、茶多酚、花青素、绿原酸、白藜芦醇、氧化芪三酚、β-胡萝卜素等生物活性物质[2-3]。桑叶茶的矿物元素含量比茶叶高出3~6倍;总糖、酚类物质、氨基酸含量都较高;同时桑叶叶面较薄,比茶叶易溶解出更多的有效成分,有利于人体的吸收[4]。脱氧野尻霉素(Deoxynojirimycin,DNJ)是一种极性含N化合物,其化学名称为3,4,5-三羟基-2-羟甲基四氢吡啶,分子式为C6H13NO4,相对分子质量为163[5-6],是一种α-葡萄糖苷酶抑制剂,具有降血糖[7-8]、降血脂[9-10]、抗肿瘤[11]、抑制变形链球菌生长[12]、抗病毒[13]等功效。桑叶是植物中DNJ含量比较高的,但不同叶位、加工工艺等诸多因素都可能影响到桑叶茶中DNJ的含量[14-15]。黄酮类物质是一类天然的抗氧化剂,能够清除人体中超氧离子、氧自由基、脂质过氧化物、过氧化氢及酶类所不能清除的羟自由基等,具有降血压、抗氧化、防癌,抗炎、抗过敏、利尿、解痉、镇咳、降血脂等生理作用[16]。桑叶中含有的多糖具有显著的降血糖作用[17],可以抑制α-葡萄糖苷酶和猪胰液α-淀粉酶的活性[18]等作用。前期实验探究了不同菌种单独或组合人工接种发酵对桑叶茶中DNJ、黄酮、多糖、多酚等主要功能成分含量的影响。发现黑曲霉、日本根酶、绿色木霉复合发酵制得的桑叶茶综合品质好,本文以不同黑曲霉、日本根酶、绿色木霉菌种比例发酵桑叶茶,分析不同菌种比例对发酵桑叶茶中DNJ、黄酮、多糖、多酚4种功能成分含量变化,为桑叶的深度开发利用提供数据。
1 材料与方法
1.1 材料与仪器
黑曲霉(AsPergillus niger) GSICC 60108,甘肃省微生物菌种保藏中心;日本根霉(Rhizopus japonicus Vuillem in) GIM 3.119,广东省微生物研究所微生物菌种保藏中心;绿色木霉(Trichoderma viride)GIM 3.443,广东省微生物研究所微生物菌种保藏中心(注以上三种菌种的安全等级均高,其生物危害程度为四类,在通常情况下不会引起人类或者动物疾病);自然发酵、人工发酵桑叶茶 由本实验室自制;DNJ标准品 北京德威钠生物技术有限公司;甘氨酸(Gly)、9-芴基氯甲酸甲酯(FMOC-Cl) Sigma公司;乙腈 色谱纯,天津市四友精细化学品有限公司;没食子酸标准品 中国药品生物制品检定所;芦丁标准品 北京德威钠生物技术有限公司;其他常用试剂 均为分析纯。
Waters 1525 HPLC 美国Waters公司;5810型台式高速离心机 德国Eppendorf公司;Spectrum lab 22可见分光光度计 上海棱光技术有限公司;KQ5200DB型数控超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 发酵桑叶茶的制备 采摘从顶芽往下数4~10片的新鲜桑叶,去柄,切为4cm×4cm的小叶片,混匀后称取100g叶片用微波杀青90s,揉捻,根据中心组合设计,设置黑曲霉∶日本根酶∶绿色木霉为1∶2∶1、2∶1∶2、1∶1∶1、2∶1∶1、1∶1∶2、1∶2∶2六种比例,加入107cfu的不同比例的黑曲霉+日本根酶+绿色木霉菌液10m L(自然发酵只加10m L无菌水),复揉,28℃发酵5h,微波干燥,制得桑叶茶。
1.2.2 DNJ的测定
1.2.2.1 测试样品的制备 取桑叶茶粉末0.5g,加入一定量超纯水,80℃水浴浸提2h(每20min摇匀一次),抽滤后,滤渣再加水浸提2次。合并浸提液,用超纯水定容至50m L,即得样品提取液。
1.2.2.2 DNJ的衍生化及测定方法 按照参考文献[19]进行。色谱条件:色谱柱:C18柱(150mm×4.6mm×5μm);流动相:乙腈-0.1%醋酸(50∶50,V/V);流速:1.0m L/min;柱温25℃;进样量10μL;紫外检测器,检测波长254nm。
1.2.3 黄酮测定 取桑叶茶粉末0.5g于50m L离心管中,加70%乙醇15m L,80℃水浴160W功率超声提取15min,7000r/min离心5min,抽滤,得到滤液。如此共提取3次,滤液用70%的乙醇定容至50m L。吸取1.0m L滤液,用AlCl3比色法[20]测定。
1.2.4 多糖测定 取桑叶茶粉末0.250g于兰盖瓶中,加入20m L沸蒸馏水,在200W功率下55℃超声提取20m in,将提取液过滤后定容至25m L。取1.0m L滤液用苯酚-硫酸法[21]测定多糖含量。
1.2.5 多酚测定 按照GB/T 8313-2008茶叶中茶多酚和儿茶素类含量的检测方法[22]进行测定。
1.3 数据统计与分析
各实验至少重复3次以上,实验数据用Excel和SPSS 16进行统计处理。
2 结果与讨论
2.1 各活性成分标准曲线线性回归方程及相关系数
按照1.2.2的实验方法,对不同浓度DNJ标准溶液进行测定,得到DNJ的标准曲线线性回归方程为y= 15776x-70392,相关系数r=0.9996。式中x为DNJ浓度,μg/m L;y为峰面积。
按照1.2.3实验方法,测定不同浓度芦丁标准溶液的吸光度,得到芦丁标准曲线线性回归方程为y= 11.622x-0.0031,相关系数r=0.9997。式中,x为芦丁浓度,μg/m L;y为吸光度。
按照1.2.4的实验方法,测定不同浓度葡萄糖标准溶液的吸光度,得到葡萄糖的标准曲线线性回归方程为y=10.909x-0.0021,相关系数r=0.9998。式中,x为葡糖糖的浓度,μg/m L;y为吸光度。
按照1.2.5的实验方法,测定不同浓度没食子酸标准溶液的吸光度,得到没食子酸的标准曲线线性回归方程为y=0.0208x+0.0034,相关系数r=0.9998。式中,x为没食子酸的浓度,μg/m L;y为吸光度。
实验结果表明,各标准曲线的相关系数均大于0.9990,线性关系良好,可用于样品中相关活性成分的测定。
2.2 DNJ标准品和样品的色谱图
将DNJ经衍生化后上高效液相色谱仪进行测定,得到如图1~图3所示的色谱图。

图1 空白色谱图Fig.1 Chromatogram of blank sample

图2 DNJ标准品色谱图Fig.2 Chromatogram of DNJstandard

图3 桑叶茶样品色谱图Fig.3 Chromatogram ofmulberry-leaf tea sample
由色谱图2可知,在本实验条件下,DNJ衍生物DNJ-FMOC的保留时间为2.731m in,与Gly-FMOC和FMOC-OH的峰间距分别相差2.719min和4.243min,表明这两种物质均不干扰DNJ的测定。
2.3 不同菌种比例对发酵桑叶茶中DNJ含量影响
分别在不同比例下加入107cfu黑曲霉+日本根霉+绿色木霉菌液10m L,在28℃发酵5h生产桑叶茶,探究其DNJ含量的变化。实验结果如图4所示。
由图4可知,与自然发酵比较,所有菌种比例发酵后DNJ含量均增加,其中黑曲霉∶日本根霉∶绿色木霉为1∶2∶1、2∶1∶2、1∶1∶1、2∶1∶1、1∶1∶2、1∶2∶2发酵的桑叶茶中DNJ含量分别为147.8、151.3、148.4、145.7、142.5、 149.7mg/100g干重,比自然发酵分别增加了6.43%、8.94%、6.85%、4.93%、2.61%、7.82%,与自然发酵比较,以黑曲霉∶日本根霉∶绿色木霉为1∶2∶1、2∶1∶1、1∶1∶2发酵的桑叶茶中DNJ含量无显著性差异(p>0.05);而以黑曲霉∶日本根霉∶绿色木霉为2∶1∶2、1∶1∶1、1∶2∶2发酵后的桑叶茶中DNJ含量有显著性差异(p<0.05),特别是黑曲霉∶日本根霉∶绿色木霉为2∶1∶2发酵后的桑叶茶中DNJ含量最高达151.3mg/100g干重,这可能是黑曲霉∶日本根霉∶绿色木霉为2∶1∶2时更利于这3种菌种相互协同作用,利用桑叶茶中的营养物质从而产生DNJ。

图4 不同发酵比例对发酵桑叶茶中DNJ含量影响Fig.4 The contentof DNJofmulberry-leaf tea by different fermentation strains rate
2.4 不同菌种比例对发酵桑叶茶中黄酮含量影响
分别在不同比例的下加入107cfu黑曲霉+日本根霉+绿色木霉菌液10m L在28℃发酵5h生产桑叶茶,探究其黄酮含量的变化。实验结果如图5所示。

图5 不同发酵比例对发酵桑叶茶中黄酮含量影响Fig.5 The contentof flavonoid ofmulberry-leaf tea by different fermentation strains rate
由图5可知,与自然发酵比较,其中以黑曲霉∶日本根霉∶绿色木霉为1∶2∶1时黄酮含量为4.22g/100g干重,增加了1.16%,无显著性差异(p>0.05)。以2∶1∶2、1∶1∶1、2∶1∶1、1∶1∶2、1∶2∶2比例发酵的桑叶茶中黄酮含量均降低,以黑曲霉∶日本根霉∶绿色木霉=1∶1∶2发酵的桑叶茶中黄酮含量为3.99g/100g干重,仅降低了4.24%,无显著性差异(p>0.05);而以黑曲霉∶日本根霉∶绿色木霉为2∶1∶2发酵桑叶茶中黄酮含量降低了8.98%,有显著性差异(p<0.05);以黑曲霉∶日本根霉∶绿色木霉为1∶1∶1、2∶1∶1、1∶2∶2发酵的桑叶茶中黄酮含量分别为3.53、3.71、3.76g/100g干重,与自然发酵比较分别降低了15.39%、10.98%、9.73%,均具有极显著差异(p<0.01)。可能是由于黑曲霉、日本根霉、绿色木霉3种菌相互作用,当在黑曲霉∶日本根霉∶绿色木霉为1∶2∶1时利于桑叶茶中黄酮的产生,而其他5种比例时不利于黄酮的产生,反而要利用和分解桑叶茶中的黄酮,或有可能生成了其他有色物质。
2.5 不同菌种比例对发酵桑叶茶中多糖含量影响
分别在不同比例的下加入107cfu黑曲霉+日本根霉+绿色木霉菌液10m L在28℃发酵5h生产桑叶茶,探究其多糖含量的变化。实验结果如图6所示。
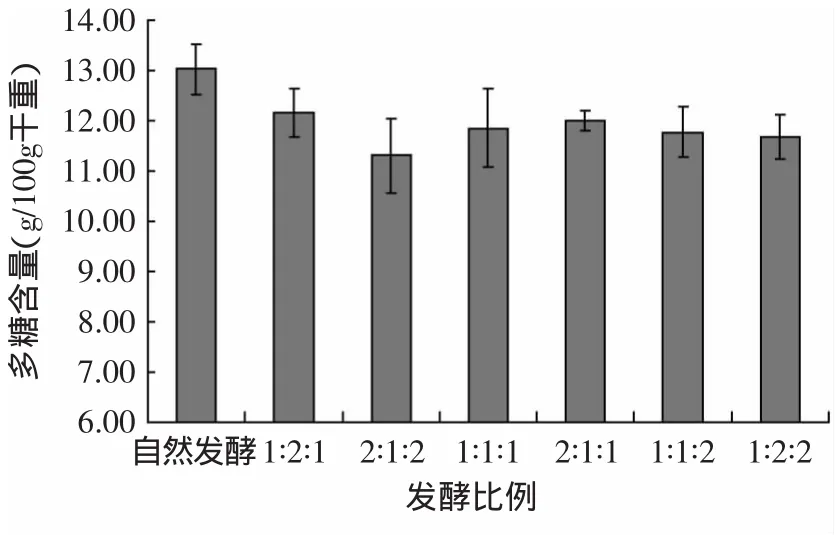
图6 不同发酵比例对发酵桑叶茶中多糖含量影响Fig.6 The contentof polysaccharid ofmulberry-leaf tea by different fermentation strains rate
由图6可知,与自然发酵比较,其中以各比例的黑曲霉∶日本根霉∶绿色木霉发酵的桑叶茶中多糖含量均降低,其中以黑曲霉∶日本根霉∶绿色木霉=1∶2∶1发酵的桑叶茶中多糖含量为12.15g/100g干重,降低了6.78%,无显著性差异(p>0.05);以黑曲霉∶日本根霉∶绿色木霉为1∶1∶1、2∶1∶1、1∶1∶2发酵的桑叶茶中多糖含量分别为11.85、11.99、11.78g/100g干重,分别降低了9.12%、8.01%、9.64%,与自然发酵比较具有显著性差异(p<0.05);而以黑曲霉∶日本根霉∶绿色木霉为2∶1∶2、1∶2∶2发酵的桑叶茶中多糖含量分别为11.30、11.68g/100g干重,与自然发酵比较分别降低了13.30%、10.43%,具有极显著差异(p<0.01)。这可能是因为不同菌种比例的黑曲霉、日本根霉、绿色木霉相互作用后,分解利用了桑叶茶中的多糖,从而利于桑叶茶中其他活性成分的形成。
2.6 不同菌种比例对发酵桑叶茶中茶多酚含量影响
分别在不同比例的下加入107cfu黑曲霉+日本根霉+绿色木霉菌液10m L在28℃发酵5h生产桑叶茶,探究其多酚含量的变化。实验结果如图7所示。
由图7可知,与自然发酵比较,以黑曲霉∶日本根霉∶绿色木霉=1∶2∶1发酵的桑叶茶中多酚含量为0.66g/100g干重,多酚含量仅增加了1.68%,无显著性差异(p>0.05);其余所有比例发酵的桑叶茶中多酚含量均降低,其中黑曲霉∶日本根霉∶绿色木霉=2∶1∶2发酵的桑叶茶中多酚含量为0.61g/100g干重,多酚含量下降了6.26%,与自然发酵比较有显著性差异(p<0.05);而以黑曲霉∶日本根霉∶绿色木霉为1∶1∶1、2∶1∶1、1∶1∶2、1∶2∶2发酵的桑叶茶中多酚含量分别为0.54、0.58、0.57、0.49g/100g干重,与自然发酵比较分别下降了16.04%、9.76%、12.60%、23.90%,具有极显著性差异(p<0.01)。可能是发酵过程中黑曲霉、日本根霉、绿色木霉3种菌相互作用,当比例为1∶2∶1时利于桑叶茶中多酚的形成,而其他5种比例时桑叶茶中的大量多酚类化合物被氧化聚合成有色物质。
3 结论
通过上述研究结果的分析发现,黑曲霉∶日本根霉∶绿色木霉=1∶2∶1发酵的桑叶茶中DNJ增加6.43%,黄酮增加1.16%,多糖降低6.78%,多酚增加1.68%,综合品质好。而用黑曲霉∶日本根霉∶绿色木霉=2∶1∶2发酵的桑叶茶中DNJ增加8.94%,为最高,其中DNJ是桑叶茶中最主要的功能性成分。因此,认为黑曲霉∶日本根霉∶绿色木霉=2∶1∶2是在所用的实验菌种比例中保证发酵桑叶茶功能性质最好的菌种。
[1]王忠华,吴月燕,张燕忠.不同加工工艺制成桑叶茶的感观品质及营养活性成分分析[J].蚕业科学,2011,37(2):272-277.
[2]KIM D C,IN M J,CHAE H J.Preparation of Mulberry Leaves Tea and Its Quality Characteristics[J].Journal of Applied Biological Chemistry,2010,53(1):56-59.
[3]SONGWEI,WANGHanjing,BUCHELIP,etal.Phytochemical profiles of differentmulberry(Morus sp.)species from China[J].Journal of Agricultural and Food Chemistry,2009,57(19):9133-9140.
[4]李旭玫,傅水玉.桑叶茶中营养成分的测定与研究[J].杭州师范学院学报:自然科学版,2006,5(1):58-60.
[5]KOJID,YOSHIHIKO I,TSUNEMATSU T.Studies on the constituents of the water extract of the root of mulberry tree(Morus bombycis Koidz)[J].Chem Pharm Bull,1986,34(5):2243-2246.
[6]MARUO S,YAMASHITA H,MIYAZAKIK,et al.A novel and efficient method for enzymatic synthes is of high purity maltose usingmoranoline(1-deoxynojirimyein)[J].Bios Biotechnol Biochem,1992,56(9):1406-1409.
[7]CHALUNTORN V,KIYOTAKA N,PHUMON S,et al.Developmentof high 1-deoxynojirimycin(DNJ)contentmulberry tea and use of response surface methodology to optimize teamaking conditions for highest DNJ extraction[J].Food Science and Technology,2012,45(2):226-232.
[8]KIMURA T,NAKAGAWA K,KUBOTA H,et al.Food-grade mulberry powder enriched with 1-deoxynojirimycin suppresses the elevation of postprandial blood glucose in humans[J].Journalof Agricultural and Food Chemistry,2007,55(14):5869-5874.
[9]KOJIMA Y,KIMURA T,NAKAGAWA K,et al.Effects of mulberry leaf extract rich in 1-deoxynojirimycin on blood lipid profiles in Hhumans[J].Journal of Clinical Biochemistry and Nutrition,2010,47(2):155-161.
[10]TSUDUKI T,NAKAMURA Y,HONMA T,et al.Intake of 1-deoxynojirimycin suppresses lipid accumulation through activation of the beta-oxidation system in rat liver[J].Journal of Agriculture and Food Chemistry,2009,57(22):11024-11029.
[11]WANG R J,YANG C H,HU M L.1-deoxynojirimycin inhibitsmetastasis of B16F10 melanoma cells by attenuating the activity and expression of matrix metalloproteinases-2 and-9 and altering cell surface glycosylation[J].Journal of Agriculture and Food Chemistry,2010,58(16):8988-8993.
[12]ISLAM B,KHAN SN,HAQUE I,etal.Novelanti-adherence activity of mulberry leaves:inhibition of Streptococcus mutans biofilm by 1-deoxynojirimycin isolated from Morus alba[J].Journal of Antimicrobial Chemotherapy,2008,62(4):751-757.
[13]JACOB J R,MANSFIELD K,YOU J E,et al.Natural iminosugar derivatives of1-deoxynojirimycin inhibitglycosylation of hepatitis viral envelope proteins[J].Journal of Microbiology,2007,45(3):431-440.
[14]杨清,徐立,王俊,等.桑红茶发酵工艺条件优化及活性成分含量的动力学研究[J].蚕业科学,2010,36(2):221-228.
[15]孙国霞,王俊,龚敏,等.不同叶位桑叶及发酵温度对桑红茶中活性成分含量的影响[J].蚕业科学2011,37(6):1061-1066.
[16]王芳,励建荣.桑叶的化学成分、生理功能及应用研究进展[J].食品科学,2005,26(S):111-117.
[17]薛长勇,腾俊英,邱继红,等.桑叶多糖~肽复合物的降血糖、血脂作用[J].营养学报,2005,27(2):167-168.
[18]寇秀颖,杜阳吉,徐勇.桑叶黄酮类和多糖类化合物的提取及其降血糖作用研究[J].食品工程,2010(4):39-41
[19]耿鹏,朱元元,杨洋,等.桑树资源中1-脱氧野尻霉素的测定及其生物活性分析[J].中草药,2005,36(8):1151-1154.
[20]李旭玫.桑叶茶元素分析及其保健功能分析[J].浙江林业科技,2005,25(3):31-33.
[21]李旭玫,傅水玉.桑叶茶中营养成分的测定与研究[J].杭州师范学院学报:自然科学版,2006,5(1):58-60.
[22]中国国家标准化管理委员会.GB/T 8313-2008茶叶中茶多酚和儿茶素类含量的检测方法[S].北京:中国标准出版社,2008.
